Слайд 2Цель: определить эффективность генной терапии при тяжёлом комбинированном иммунодефиците с ретикулярной дисгенезией
Задачи:
Установить

этиологию и патогенез данной патологии
Описать клинические проявления
Изучить методы диагностики
Проанализировать механизм действия генной терапии при тяжёлом комбинированном иммунодефиците;
Обозначить преимущества и недостатки генной терапии.
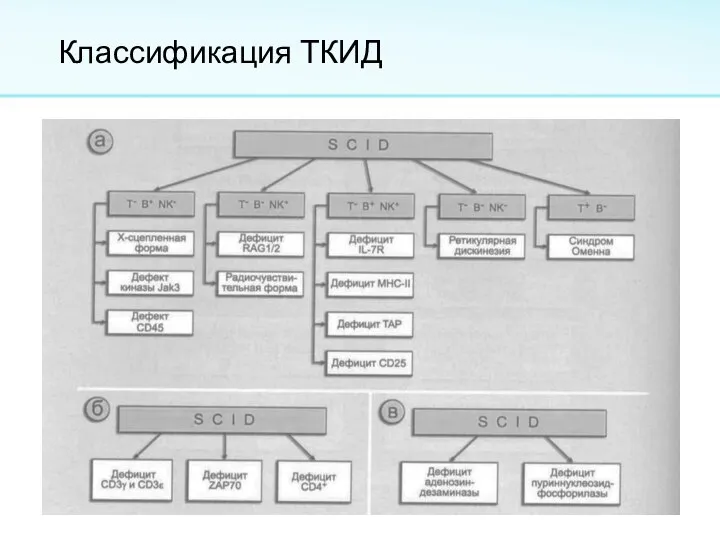
Слайд 3Синонимы: алимфоцитоз, синдром Глянцмана-Риникера, синдром тяжёлого комбинированного иммунодефицита, и тимическая алимфоплазия.
Тяжелый комбинированный

иммунодефицит с ретикулярной дисгенезией (ТКИД, SCID) – ретикулярный дисгенез объединяет группу генетических дефектов, приводящих к лейкопении, нейтропении, лимфоцитопении, дефициту иммуноглобулинов.
Слайд 5Общая этиология и патогенез
Дефекты различных ключевых генов, из-за чего нарушена дифференцировка и

пролиферация гемопоэтической стволовой клетки в лимфоидную и миелоидную стволовые клетки; возможны дефекты СВЗ-комплекса (дзета цепи), рецепторов к интерлейкинам, дефекты передачи внутриклеточных сигналов, HLA-молекул I и II классов.
Слайд 6Клинические проявления
Дети погибают в первые месяцы жизни от септического процесса (триада симптомов:

диарея, интерстициальная пневмония, распространенный микоз слизистых, тяжелые вирусные инфекции - герпес, аденовирусы, цитомегаловирус);
Инфицирование низсковирулентными микроорганизмами (кандидозы, пневмоцисты);
Наблюдается кореподобная сыпь с гиперпигментацией как проявление реакции материнских лимфоцитов, проникших через плаценту;
Отставание в росте и развитии.
Слайд 7Диагностика
Профилактический неонатальный скрининг с использованием теста т-рецепторных эксцизионных колец (Trec);
Наличие персистирующих инфекций;
Уровень

лейкоцитов;
Тесты на пролиферацию лимфоцитов в ответ на стимуляцию митогеном.
Снижение содержания IgG, IgM, IgA в сыворотке крови
Слайд 8Лечение
Обратная изоляция;
Поддерживающее лечение, включающее заместительную терапию иммуноглобулинами, антибиотики и противогрибковые препараты;
Трансплантация гемопоэтических

стволовых клеток;
Заместительная ферментная терапия при дефиците аденозин дезаминазы (AДA);
Генная терапия при SCID-X и ADA-SCID.
Слайд 9The Bubble Boy- Дэвид Филипп Веттер
12 лет своей жизни мальчик провёл

в стерильном пузыре, куда был помещён всего через несколько секунд после рождения. Всё, что попадало в стерильный пузырь, должно было быть обеззаражено.
В 1974 специалисты NASA разработали для Дэвида костюм, который позволил бы ему совершить прогулку за пределы пузыря.
В попытке излечить болезнь мальчику была проведена операция по пересадке костного мозга, несмотря на неполную совместимость. К сожалению, в костном мозге донора-сестры были найдены следы спящего вируса Эпштейна-Бара. Вирус начал стремительно распространяться и прогрессировать. Дэвида пришлось извлечь из пузыря для лечения. Когда отец прямо спросил его, хочет ли он покинуть пузырь, Дэвид ответил, что согласен на что угодно, лишь бы чувствовать себя лучше. Вне пузыря его состояние продолжило ухудшаться, и он впал в кому. Тогда же его мать в первый раз в жизни смогла прикоснуться к своему сыну. Он умер 15 дней спустя, 22 февраля 1984 года. Ему было 12 лет…
Слайд 11X-сцепленная тяжелая комбинированная иммунная недостаточность (SCID-X)
Частота 1:100000 новорождённых (45% от весх случаев);
Встречается
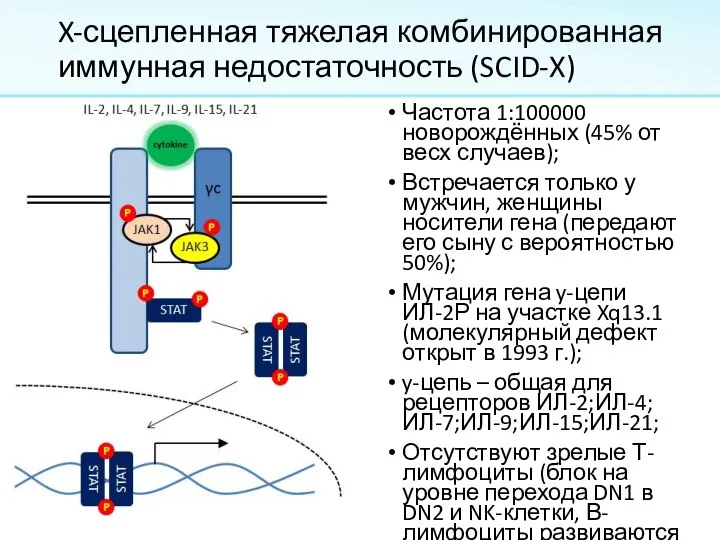
только у мужчин, женщины носители гена (передают его сыну с вероятностью 50%);
Мутация гена y-цепи ИЛ-2Р на участке Xq13.1 (молекулярный дефект открыт в 1993 г.);
y-цепь – общая для рецепторов ИЛ-2;ИЛ-4;ИЛ-7;ИЛ-9;ИЛ-15;ИЛ-21;
Отсутствуют зрелые Т-лимфоциты (блок на уровне перехода DN1 в DN2 и NK-клетки, В-лимфоциты развиваются нормально).
Слайд 12ТКИД с недостаточностью аденозиндезаминазы (АДА)
Вторая по частоте причина ТКИН (15% от

всех случаев);
Наследуется как аутосомно-рецессивный признак;
Встречается как у мальчиков, так и у девочек.
Возникает в результате генетических дефектов фермента, участвующего в метаболизме пуринов. Накопление токсинов вредит развитию Т-клеток, В-клеток и естественных клеток-киллеров, серьезно уменьшая их количество. Если иммунная функция не восстановлена, дети с АДА-дефицитным SCID могут умереть в раннем младенчестве.
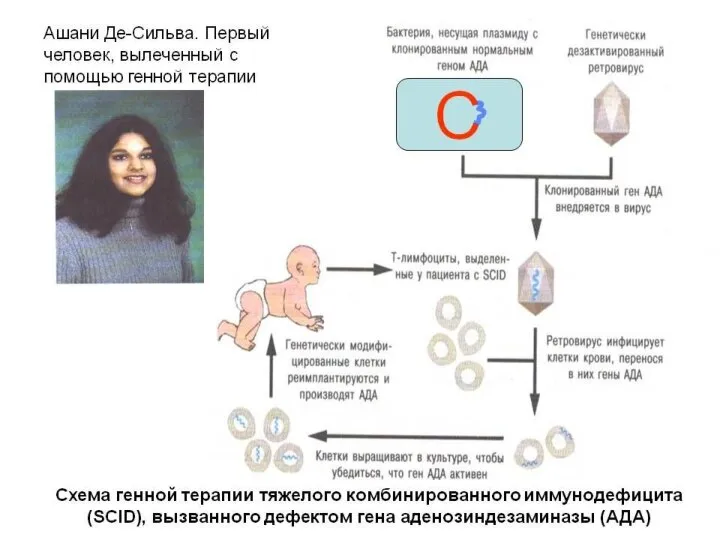
Слайд 13Генная терапия – это лечение наследственных, мультифакториальных и ненаследственных (инфекционных, злокачественных и
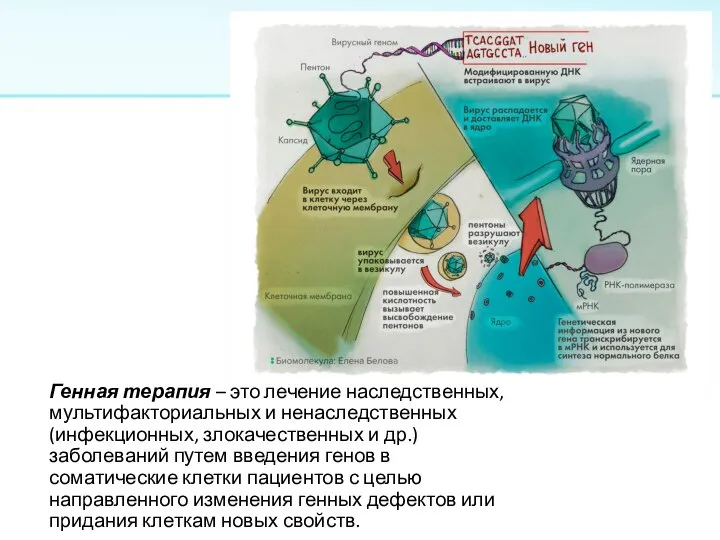
др.) заболеваний путем введения генов в соматические клетки пациентов с целью направленного изменения генных дефектов или придания клеткам новых свойств.
Слайд 14
Исследованием применения генной терапии при SCID занимались:
Профессор педиатрии и иммунологии Бобби Гаспар

(доктор медицинских наук, Университетский колледж Лондона) и профессор микробиологии, иммунологии, молекулярной генетики и педиатрии Дональд Б. Кон (доктор медицины, Калифорнийский университет в Лос-Анджелесе).
Слайд 15Генная терапия SCID-X
10 пациентов получали терапию в среднем в возрасте 10 месяцев

(самый молодой пациент лечился в 4 месяца, а самый старший - в 46 месяцев).
Гемопоэтические стволовые клетки (HSC) удаляли из каждого пациента и «восстанавливали» путем трансдукции (то есть доставки исправленных генов вирусным вектором). Каждому пациенту вливали его/ее собственные трансдуцированные HSC CD34 + и клетки-предшественники. Миелосупрессия или иммуносупрессия не применялись.
Итоги:
все 10 детей (100%) были живы через 54-107 месяцев наблюдения и имели функционирующие поликлональные Т-клетки;
гуморальный иммунитет (отражающий функцию B-клеток) восстановился лишь частично, но 4 пациента (40%) смогли навсегда прекратить заместительную терапию иммуноглобулином. У одного пациента (10%) развился Т-клеточный острый лимфобластный лейкоз, но поликлональные Т-клетки сохранились, и он находится в стадии ремиссии после химиотерапии.
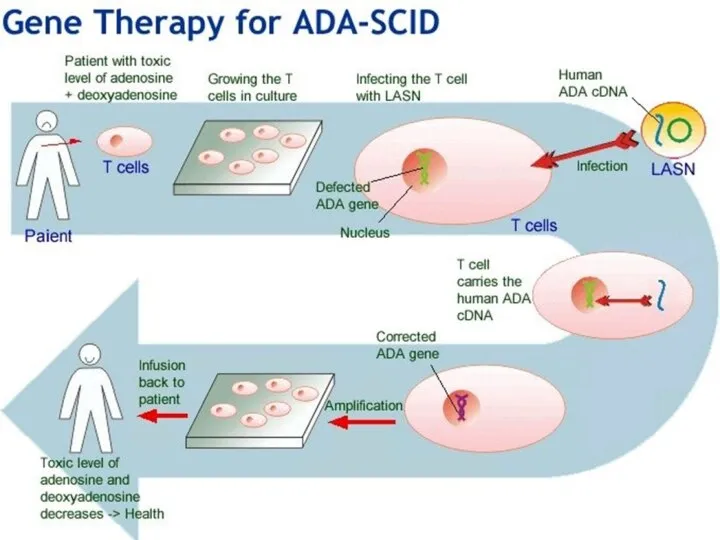
Слайд 16Генная терапия ADA-SCID
Лечили 6 детей в среднем в возрасте 36 месяцев (диапазон

от 6 до 39 месяцев).
Все они ранее получали заместительную ферментную терапию (ЗФТ) и имели лишь частичное восстановление иммунной функции: количество лимфоцитов ниже 1,5 × 106 на литр и/или требовалась заместительная терапия иммуноглобулином G.
Все 6 пациентов прекратили ЗФТ за 1–4 недели до генной терапии и «прошли мягкую химиотерапию» перед генной терапией.
Как и в случае с пациентами с SCID-X1, вливания каждого пациента содержала его или ее собственные генетически восстановленные клетки CD34 +.
Итоги:
все 6 детей (100%), получавших лечение от ТКИД с дефицитом ADA, были живы через 24-84 месяца наблюдения;
четверо (66%) восстановили свою иммунную функцию, а трое (50%) не возобновили ЗФТ.
у двух других пациентов (33%) иммунная функция не восстановилась по «причинам, связанным с конкретным заболеванием и техническим причинам», но они возобновили ЗФТ и чувствуют себя хорошо.
Слайд 18Одно различие между методами лечения АДА-SCID и SCID-X1 заключается в использовании «мягкой

химиотерапии» у пациентов с АДА-SCID перед генной терапией.
«Преимущество выживания для Т-клеток с генной коррекцией у [пациентов с SCID-X1] настолько велико, что нет необходимости в химиотерапии. Если мы введем даже небольшое количество Т-клеток, они повторно заселят компартмент Т-клеток», - сказал доктор Гаспар.
Слайд 20Дональд Б. Кон обобщает историю испытаний генной терапии SCID.
Одна тревожная проблема

представляет собой «лейкозоподобную Т-лимфопролиферацию», наблюдаемую у 5 из 20 пациентов с SCID-X1 в нескольких исследованиях, но ни у одного из более чем 30 пациентов с ADA-SCID, получавших генную терапию.
Причина может заключаться в различиях между генами, доставляемыми вирусными переносчиками: ген, связанный с Х, может обеспечивать пролиферативные сигналы, тогда как ген ADA не передает сигналов активации. Ответы на генную терапию также имеют разные сроки: у пациентов с SCID-X1 наблюдается быстрое увеличение популяции Т-клеток в течение нескольких месяцев, тогда как Т-лимфоцитам пациентов с АДА-SCID требуется более 18 месяцев для восстановления.
Слайд 21Выводы:
Существуют 2 основные разновидности тяжелого комбинированного иммунодефицита с ртикулярной дисгенезией: X-сцепленная тяжелая

комбинированная иммунная недостаточность (SCID-X) и ТКИД с недостаточностью аденозиндезаминазы (АДА), различающиеся по этиологии и патогенезу.
Клинические проявления при обеих формах идентичны.
В методах диагностики отличий не выявлено.
Генная терапия, в основе действия которой лежит принцип временного введения в клетки организма пациента функциональных генов, показала свою высокую эффективность – 40% при X-сцепленной тяжелой комбинированной иммунной недостаточности и 66% при ТКИД с недостаточностью аденозиндезаминазы.
Во время лечения X-сцепленной тяжелой комбинированной иммунной недостаточности в 10% случаев развился Т-клеточный острый лимфобластный лейкоз, но поликлональные Т-клетки сохранились, и пациент находится в стадии ремиссии после химиотерапии.
Авторы статьи заявляют, что описанные ими обобщенные результаты показывают высокий уровень безопасности и эффективности генной терапии и являются аргументом использования генной терапии как лечения первого выбора у пациентов, которым трудно провести трансплантацию костного мозга.

















 Диагностика рака шейки матки при беременности
Диагностика рака шейки матки при беременности лекция 1 - рентгенология история методы
лекция 1 - рентгенология история методы НИР. Травматические повреждения зубов
НИР. Травматические повреждения зубов Макет презентации. Кафедра факультетской педиатрии
Макет презентации. Кафедра факультетской педиатрии Основные, дополнительные и вспомогательные методы диагностики АГ. Этапы диагностического поиска
Основные, дополнительные и вспомогательные методы диагностики АГ. Этапы диагностического поиска Пневмония. Виды пневмонии
Пневмония. Виды пневмонии Острый коронарный синдром
Острый коронарный синдром Тазовое предлежание плода. Ведение беременности и родов
Тазовое предлежание плода. Ведение беременности и родов Көз айналасы терісіне арналған кремдер арасында
Көз айналасы терісіне арналған кремдер арасында Маловесные дети
Маловесные дети Диагностика ВИЧ-инфекции
Диагностика ВИЧ-инфекции Семинар 2_Десмургия
Семинар 2_Десмургия Инфекциялык аурулар
Инфекциялык аурулар Трофобластическая болезнь
Трофобластическая болезнь Лечебное питание
Лечебное питание Особенности сестринского ухода
Особенности сестринского ухода Постинъекционные осложнения
Постинъекционные осложнения Лекарственное лечение рака молочной железы
Лекарственное лечение рака молочной железы Основные этапы послеоперационной работы при ринолалии. Задачи логопеда на каждом этапе
Основные этапы послеоперационной работы при ринолалии. Задачи логопеда на каждом этапе Физические приборы в медицине
Физические приборы в медицине Профилактика сердечно-сосудистых заболеваний
Профилактика сердечно-сосудистых заболеваний Операции на костях
Операции на костях Острые кишечные инфекции у детей
Острые кишечные инфекции у детей Фонационный отдел периферического речевого аппарата
Фонационный отдел периферического речевого аппарата вич инф
вич инф Холера. Определение
Холера. Определение Применение коксибов в клинической практике
Применение коксибов в клинической практике Severe reactive astrocytes precipitate pathological hallmarks of Alzheimer's disease via H2O2- production
Severe reactive astrocytes precipitate pathological hallmarks of Alzheimer's disease via H2O2- production