Содержание
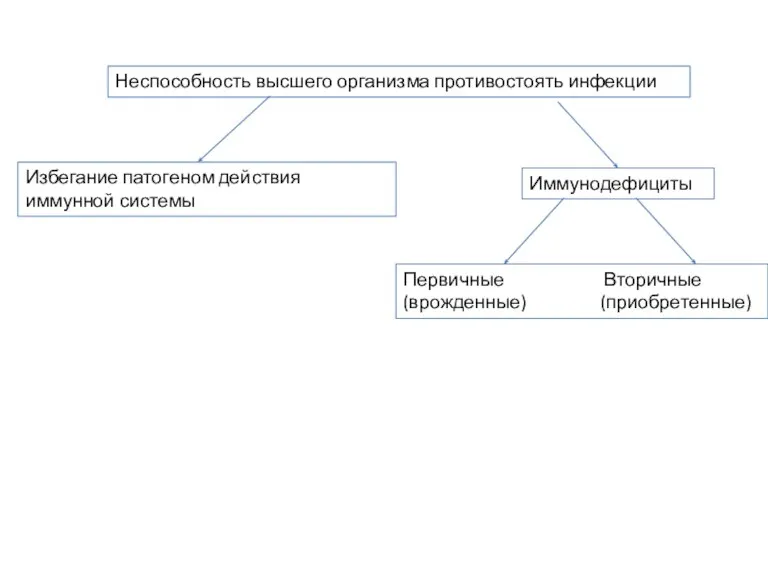
- 2. Иммунодефициты Первичные Вторичные (врожденные) (приобретенные) Неспособность высшего организма противостоять инфекции Избегание патогеном действия иммунной системы
- 3. Многие инфекционные агенты существуют в нескольких антигенных вариантах. Streptococcus pneumoniae – 84 серотипа = 84 варианта
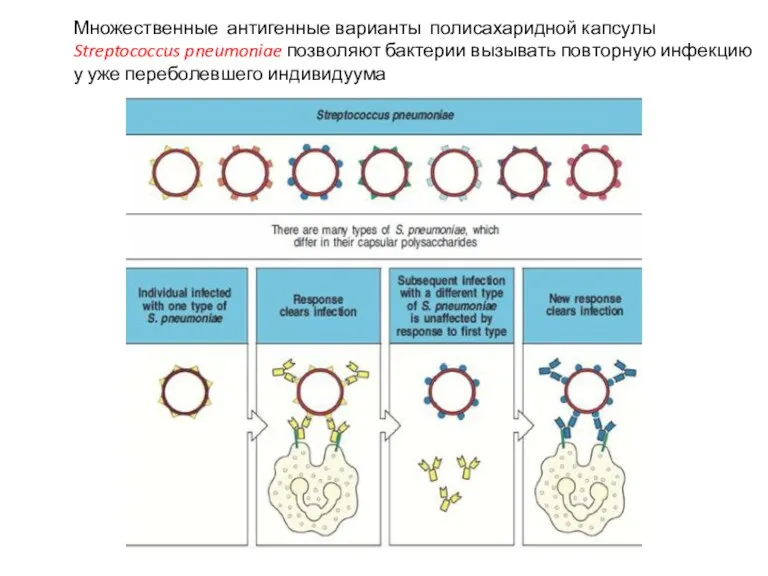
- 4. Множественные антигенные варианты полисахаридной капсулы Streptococcus pneumoniae позволяют бактерии вызывать повторную инфекцию у уже переболевшего индивидуума
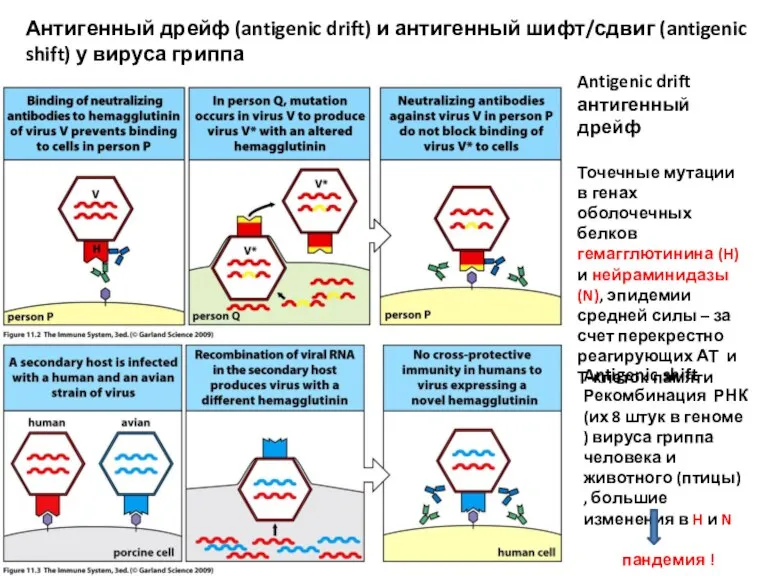
- 5. Антигенный дрейф (antigenic drift) и антигенный шифт/сдвиг (antigenic shift) у вируса гриппа Antigenic drift антигенный дрейф
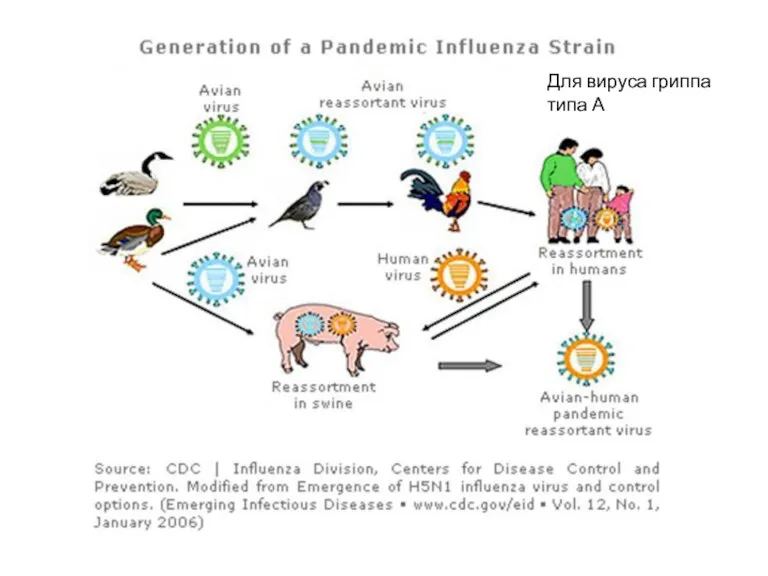
- 6. Для вируса гриппа типа А
- 7. Смена подтипов вируса гриппа А и связанные с ней пандемии и эпидемии человека Антигенный шифт вызывает
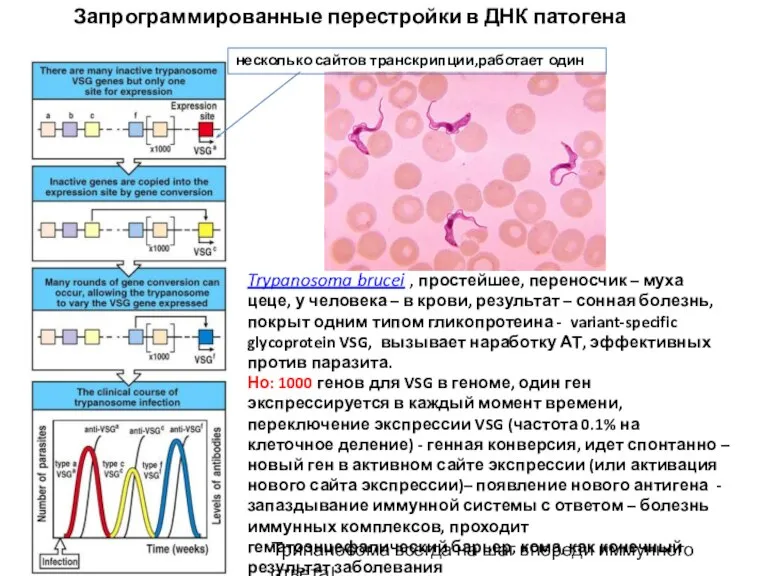
- 8. Запрограммированные перестройки в ДНК патогена Trypanosoma brucei , простейшее, переносчик – муха цеце, у человека –
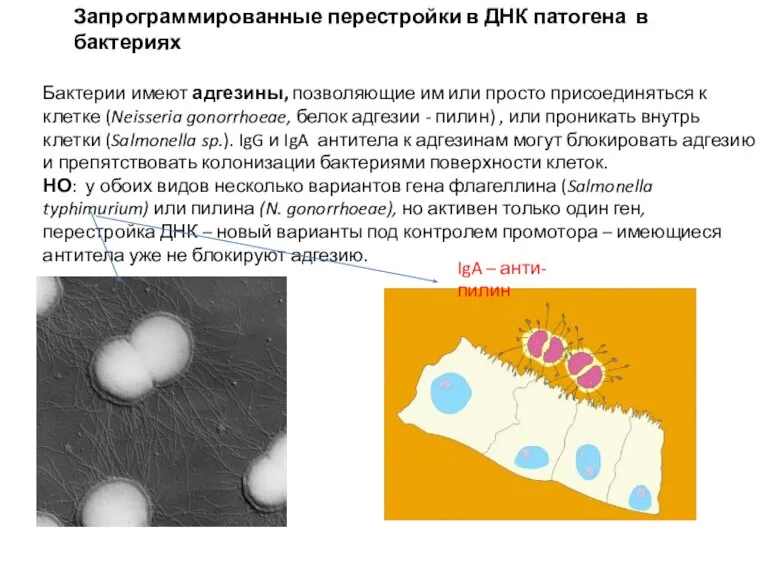
- 9. Бактерии имеют адгезины, позволяющие им или просто присоединяться к клетке (Neisseria gonorrhoeae, белок адгезии - пилин)
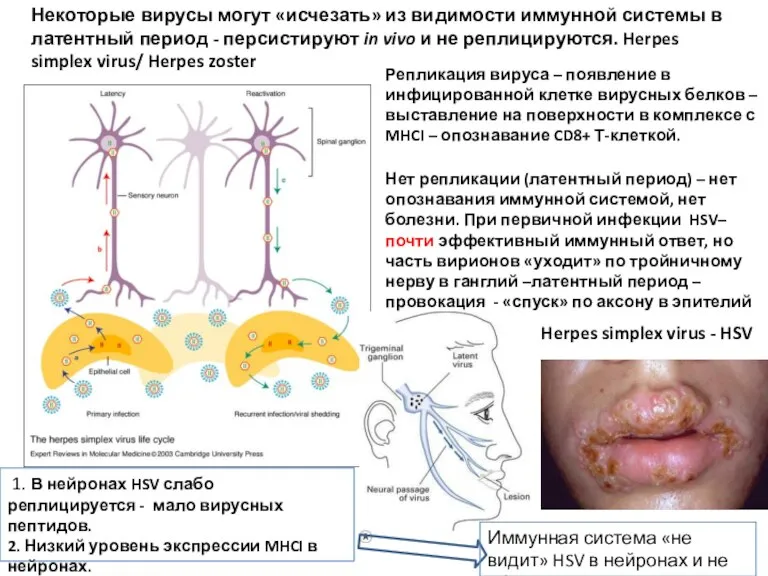
- 10. Некоторые вирусы могут «исчезать» из видимости иммунной системы в латентный период - персистируют in vivo и
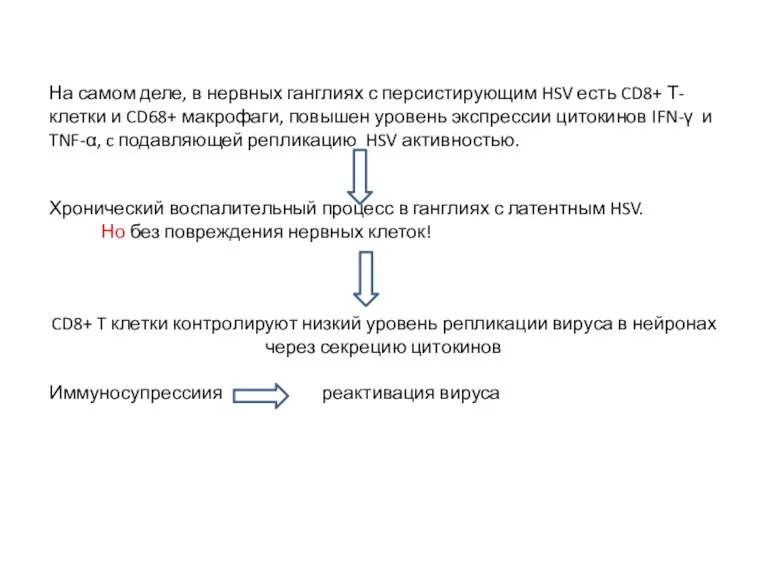
- 11. На самом деле, в нервных ганглиях с персистирующим HSV есть CD8+ Т-клетки и CD68+ макрофаги, повышен
- 12. Каковы молекулярные механизмы избегания вирусом HSV нормального иммунного ответа в клетках эпителия? M. L. Oldham, R.K.
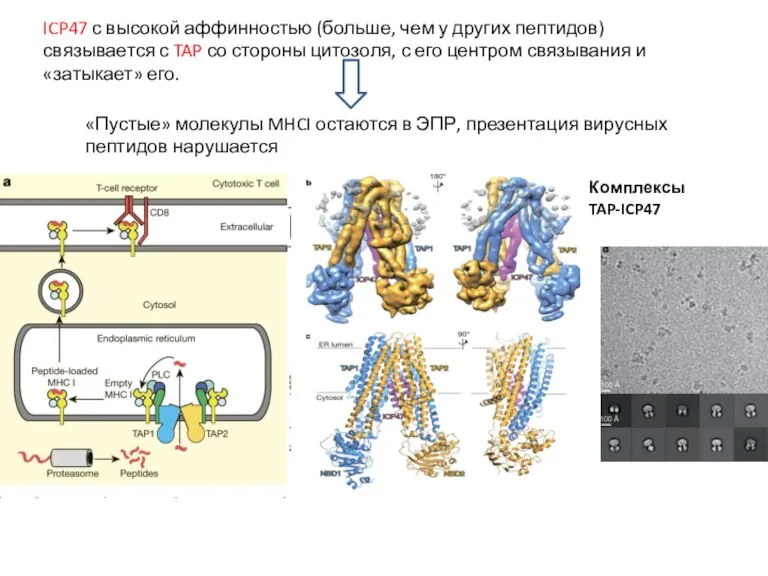
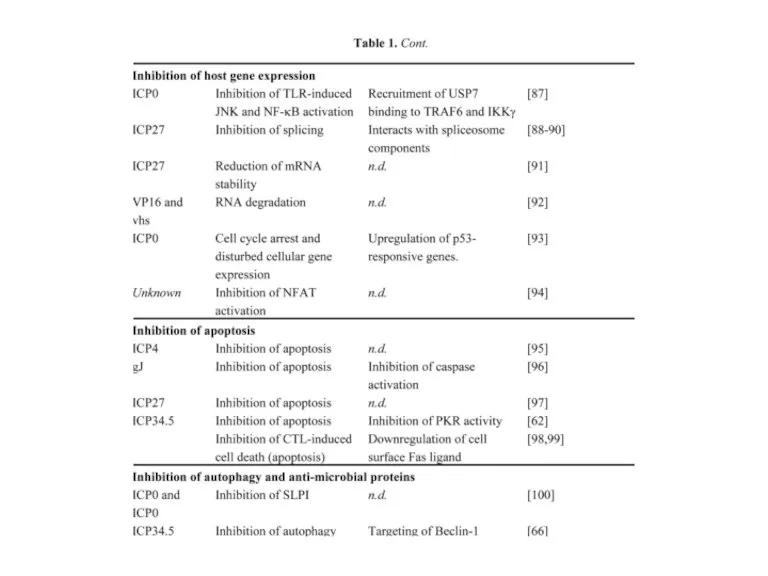
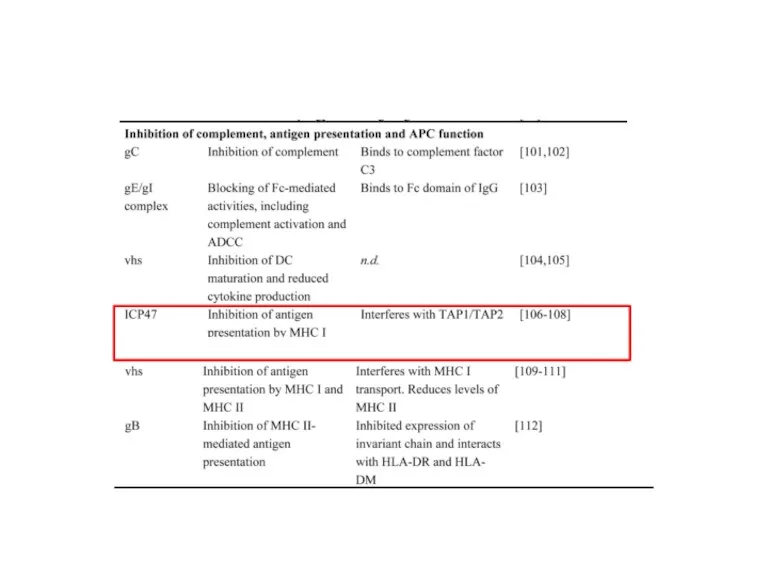
- 13. ICP47 с высокой аффинностью (больше, чем у других пептидов) связывается с TAP со стороны цитозоля, с
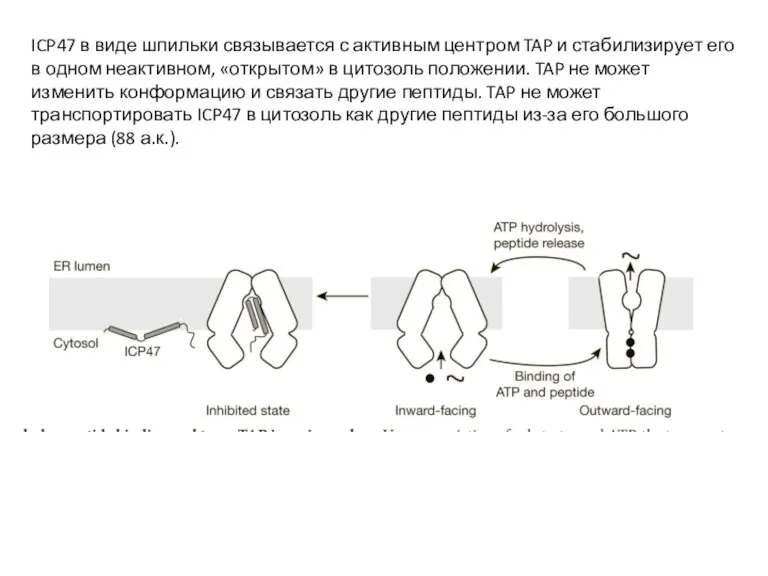
- 14. ICP47 в виде шпильки связывается с активным центром TAP и стабилизирует его в одном неактивном, «открытом»
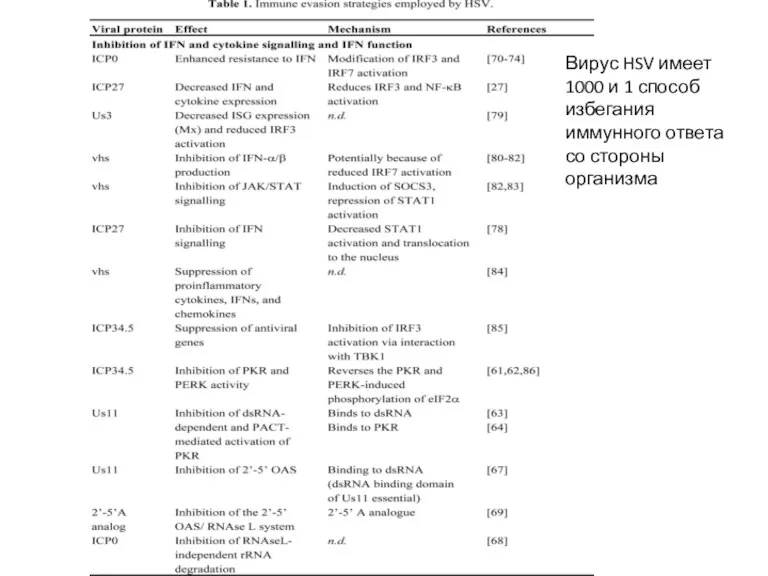
- 15. Вирус HSV имеет 1000 и 1 способ избегания иммунного ответа со стороны организма
- 18. Epstein-Barr virus EBV Инфицирует В-клетки через СD21 и MHCII. Первичная инфекция – или бессимптомно или инфекционный
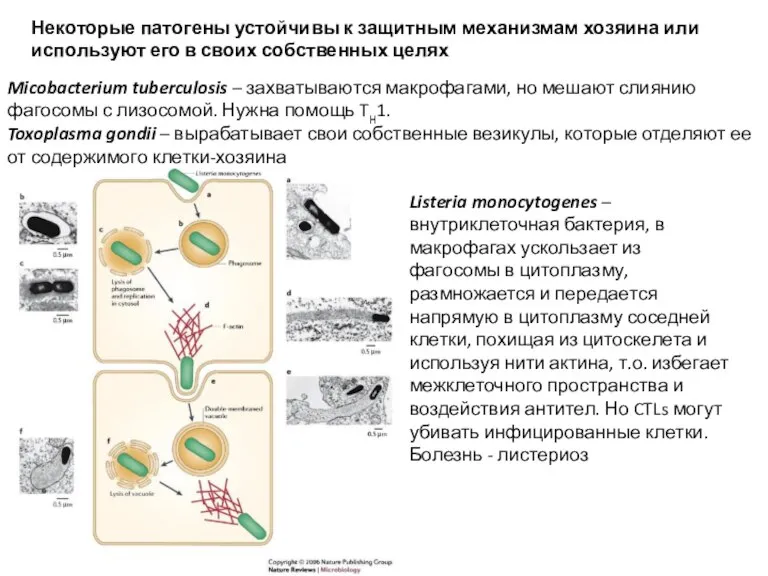
- 19. Некоторые патогены устойчивы к защитным механизмам хозяина или используют его в своих собственных целях Micobacterium tuberculosis
- 20. Врожденные иммунодефициты (более 100) –дефекты в генах, участвующих в контроле иммунного ответа Общая особенность - в
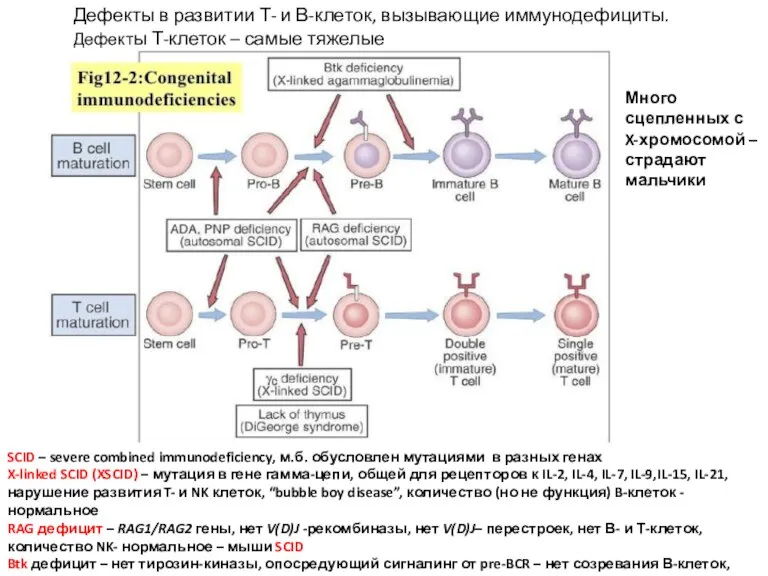
- 21. Дефекты в развитии Т- и В-клеток, вызывающие иммунодефициты. Дефекты Т-клеток – самые тяжелые SCID – severe
- 22. Синдром приобретенного иммунодефицита СПИД/AIDS подавление иммунного ответа, вызванное инфекцией HIV (human immunodeficiency virus) 1981 – первое
- 23. Пути попадания HIV в организм человека: Через слизистую половых путей – основной путь С кровью (через
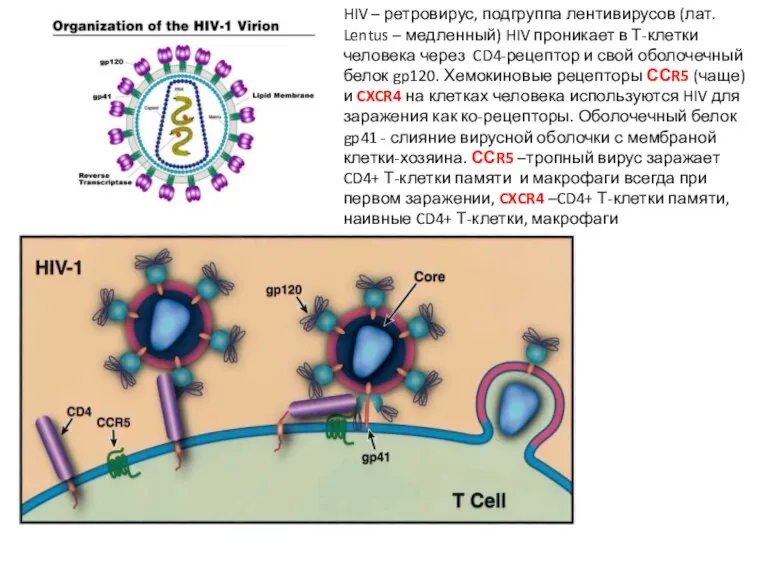
- 24. HIV – ретровирус, подгруппа лентивирусов (лат. Lentus – медленный) HIV проникает в Т-клетки человека через CD4-рецептор
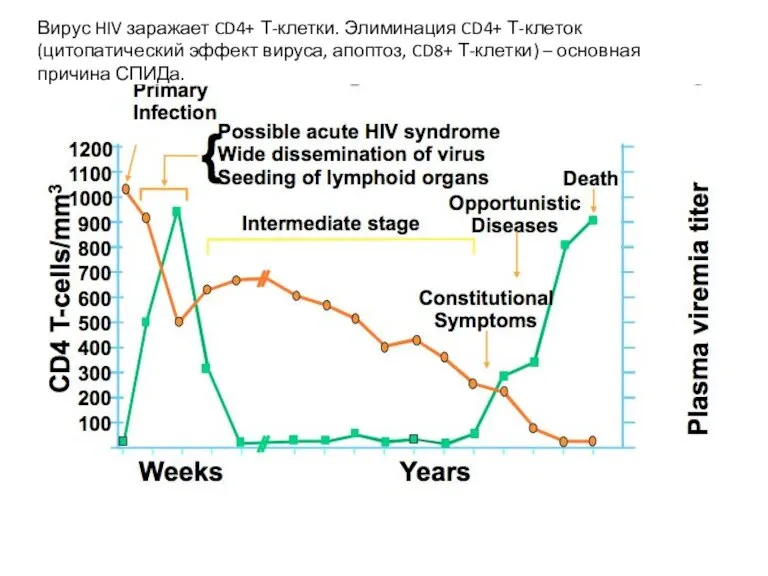
- 25. Вирус HIV заражает CD4+ Т-клетки. Элиминация CD4+ Т-клеток (цитопатический эффект вируса, апоптоз, CD8+ Т-клетки) – основная
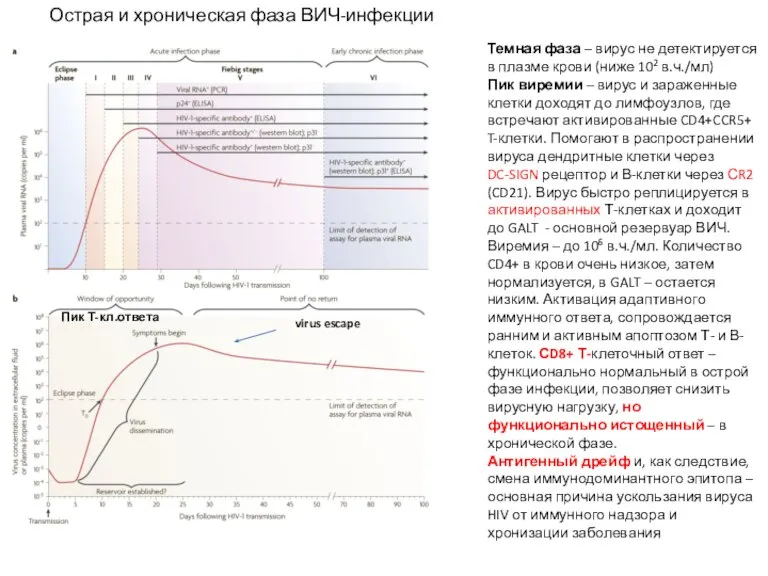
- 26. Темная фаза – вирус не детектируется в плазме крови (ниже 102 в.ч./мл) Пик виремии – вирус
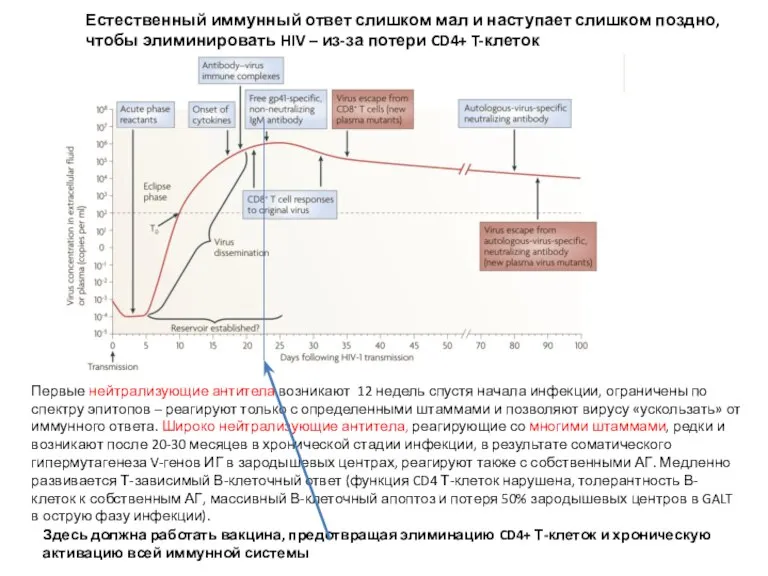
- 27. Первые нейтрализующие антитела возникают 12 недель спустя начала инфекции, ограничены по спектру эпитопов – реагируют только
- 28. Вакцина против ВИЧ должна обеспечивать присутствие широко нейтрализующих антител в плазме и слизистых
- 29. Антигенный дрейф и функциональное истощение CTLs – основные причины неспособности иммунной системы человека элиминировать ВИЧ
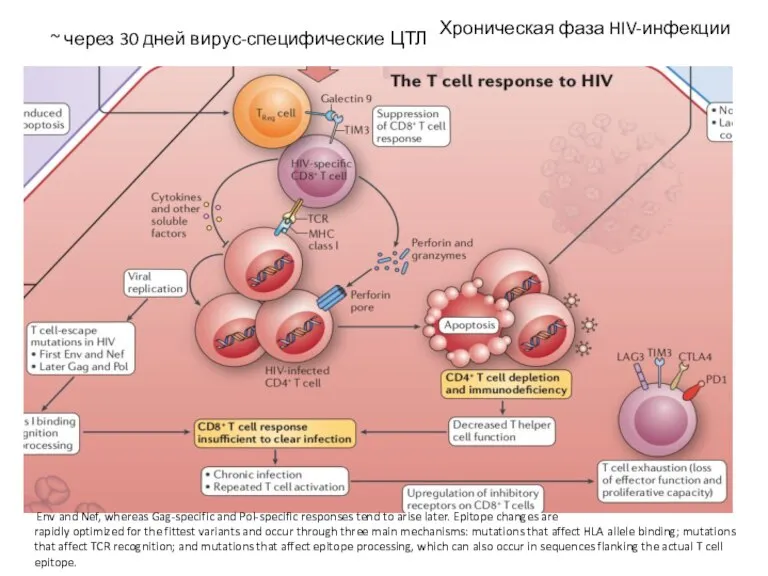
- 30. ~ через 30 дней вирус-специфические ЦТЛ Env and Nef, whereas Gag-specific and Pol-specific responses tend to
- 31. Хроническая фаза ВИЧ-инфекции Результат хронической антигенной стимуляции CD8+ T-клеток и, как следствие, повышенной экспрессии ингибирующих рецепторов
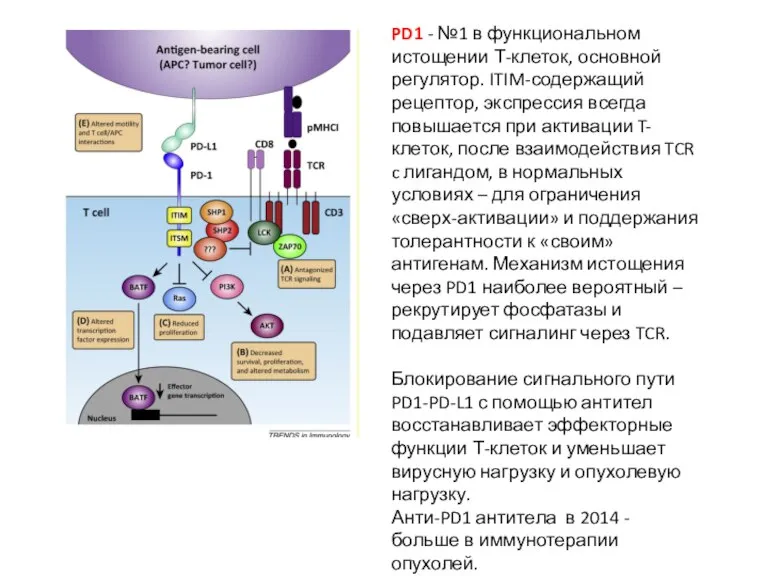
- 32. PD1 - №1 в функциональном истощении Т-клеток, основной регулятор. ITIM-содержащий рецептор, экспрессия всегда повышается при активации
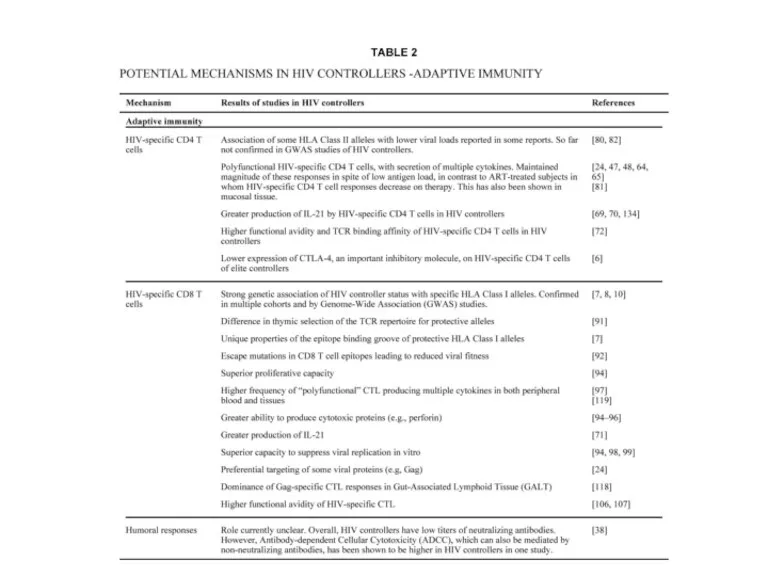
- 33. Около 1% ВИЧ-зараженных – «элит-контроллеры» или «элит-нон-прогрессоры» или «элит-супрессоры». Без ретровирусной терапии – вирусная нагрузка не
- 36. ССR5del Это теперь не зазорно! 2008. Timothy Brown, also known as the «Berlin patient» 1995 –
- 38. Скачать презентацию












 Ureter. Parts of the ureter
Ureter. Parts of the ureter Антикоагулянты 2022 МИД
Антикоагулянты 2022 МИД Хронические гепатиты
Хронические гепатиты Обгрунтування складу фармацевтичної композиції для лікування нейродегенеративних захворювань
Обгрунтування складу фармацевтичної композиції для лікування нейродегенеративних захворювань Острая сердечная недостаточность
Острая сердечная недостаточность Синдромы раннего детского аутизма
Синдромы раннего детского аутизма Оптимизация процесса работы с документами для исполнения контракта
Оптимизация процесса работы с документами для исполнения контракта Центр гигиены и эпидемиологии в Республике Карелия
Центр гигиены и эпидемиологии в Республике Карелия Основы профилактики. Первичная, вторичная и третичная профилактика
Основы профилактики. Первичная, вторичная и третичная профилактика Компенсаторно-приспособительные процессы
Компенсаторно-приспособительные процессы Краснуха. Полиомиелит
Краснуха. Полиомиелит Влияет ли зубная паста на прочность зубов
Влияет ли зубная паста на прочность зубов Типовые ошибки в терапевтической экспозиции
Типовые ошибки в терапевтической экспозиции Неврологическое наблюдение детей первого года жизни. Риск формирования патологии ЦНС
Неврологическое наблюдение детей первого года жизни. Риск формирования патологии ЦНС Здоровое питание
Здоровое питание Слово врача, как лечебный фактор
Слово врача, как лечебный фактор Жеңіл дәрежедегі миопиямен ауратын 20 – 25жас аралық трентал пентоксифиллиннен қарағанда аскынудын алдын алуын анықтау
Жеңіл дәрежедегі миопиямен ауратын 20 – 25жас аралық трентал пентоксифиллиннен қарағанда аскынудын алдын алуын анықтау Полисомнография. Сущность метода. Показания к проведению исследования
Полисомнография. Сущность метода. Показания к проведению исследования Заболеваемость женского населения злокачественными новообразованиями по Владимирской области в период с 2005 по 2015 года
Заболеваемость женского населения злокачественными новообразованиями по Владимирской области в период с 2005 по 2015 года Вирусные пневмонии
Вирусные пневмонии Вирусные гепатиты
Вирусные гепатиты Периодическая аккредитация специалистов
Периодическая аккредитация специалистов Сестринская помощь при недержании кала
Сестринская помощь при недержании кала Нәресте гипотермиясы, профилактикасы және емі
Нәресте гипотермиясы, профилактикасы және емі ЭКГ при патологических состояниях
ЭКГ при патологических состояниях Нейрон. Қозудың зерттелуі. Қозудың жүйке талшықтарының бойымен өткізілуі. Милендік қабықша. Демиелинизация
Нейрон. Қозудың зерттелуі. Қозудың жүйке талшықтарының бойымен өткізілуі. Милендік қабықша. Демиелинизация Лихорадочный синдром
Лихорадочный синдром Заболевания прямой кишки
Заболевания прямой кишки