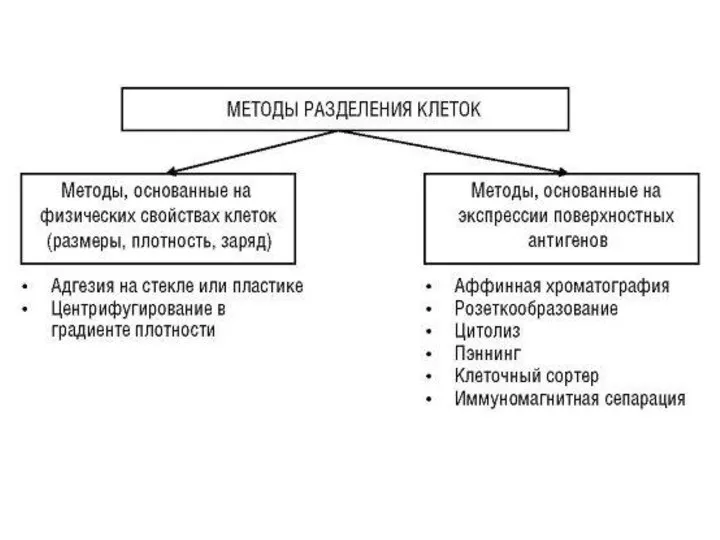
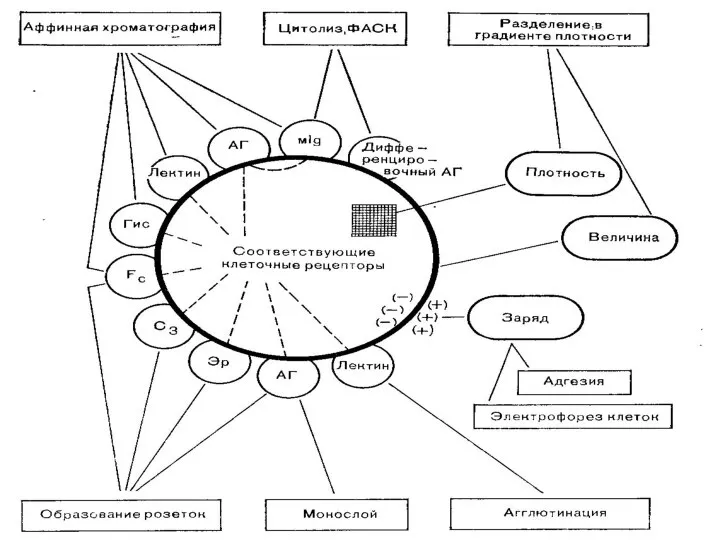
Содержание
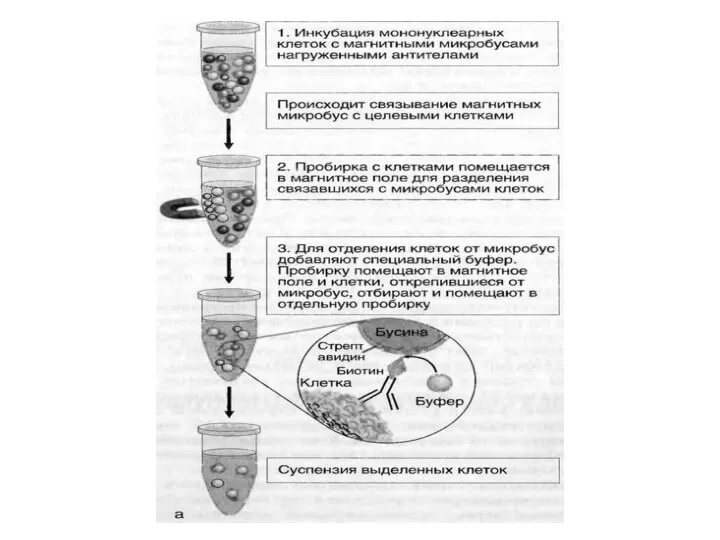
- 4. Иммуномагнитная сепарация клеток Принцип метода: Магнитная сепарация клеток основана на использовании парамагнитных бус (микросфер), покрытых монАТ
- 5. Микросферы добавляют непосредственно к исследуемому образцу, что обеспечивает быстрый и прямой доступ к максимальному числу целевых
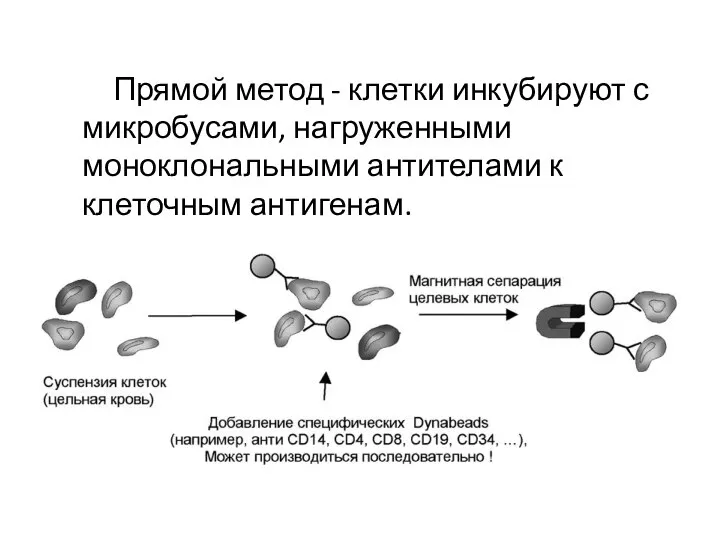
- 6. Прямой метод - клетки инкубируют с микробусами, нагруженными моноклональными антителами к клеточным антигенам.
- 7. Непрямой метод - клетки на первом этапе инкубируют с первичными антителами к клеточным антигенам, которые бывают:
- 9. Негативное выделение клеток Негативное выделение клеток осуществляется при удалении всех нежелательных клеточных популяций из образца мононуклеарной
- 10. Позитивное выделение клеток Для позитивного выделения клеток используются полимерные магнитные микросферы, конъюгированные с первичными антителами, специфичными
- 11. Достоинства метода Высокий уровень корреляции с проточной цитометрией Высокая чувствительность: 10-20 клеток на мкл Экономичность, нет
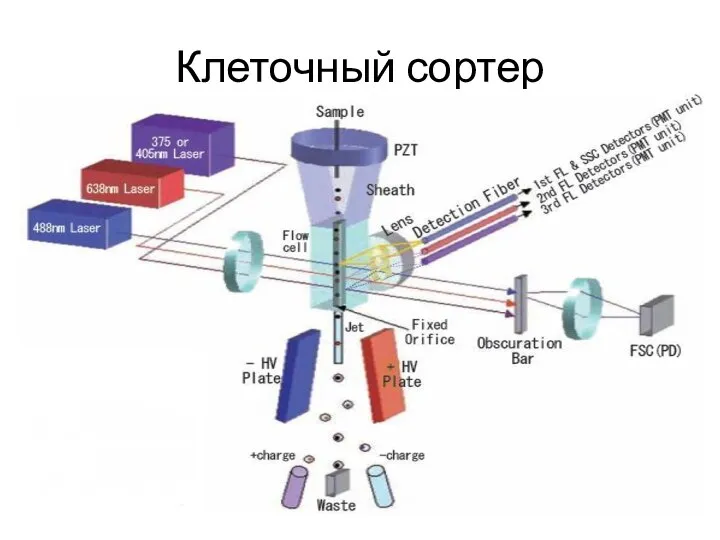
- 12. Клеточный сортер
- 13. Заранее изготовленную суспензию клеток помещают в пробоотборник, после чего по системе трубочек суспензия перемещается в центральную
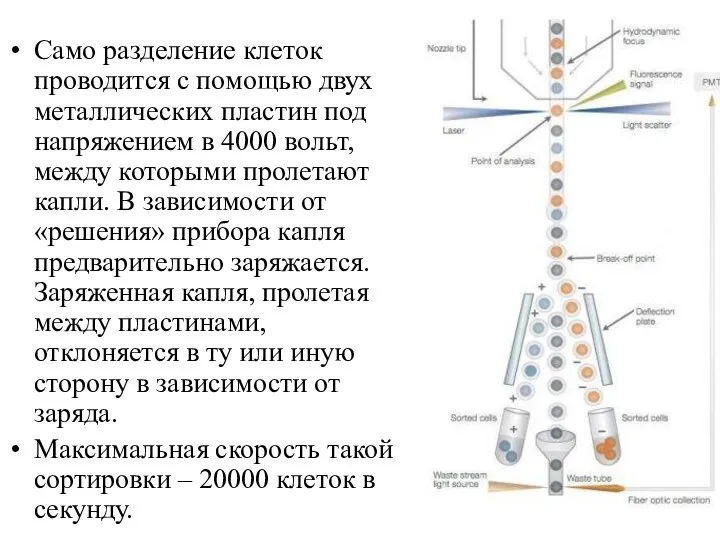
- 14. Само разделение клеток проводится с помощью двух металлических пластин под напряжением в 4000 вольт, между которыми
- 15. Разделение клеток при помощи адгезии. Фагоцитирующие клетки, в том числе и часть лимфоцитов, имеют тенденцию к
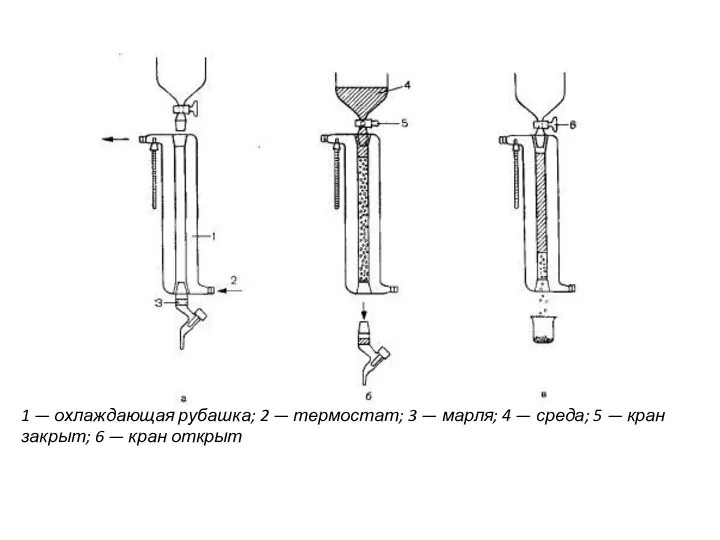
- 16. 1 — охлаждающая рубашка; 2 — термостат; 3 — марля; 4 — среда; 5 — кран
- 17. Разделение клеток на нейлоновых волокнах Фракционирование на найлоновой вате представляет собой простой и быстрый метод разделения
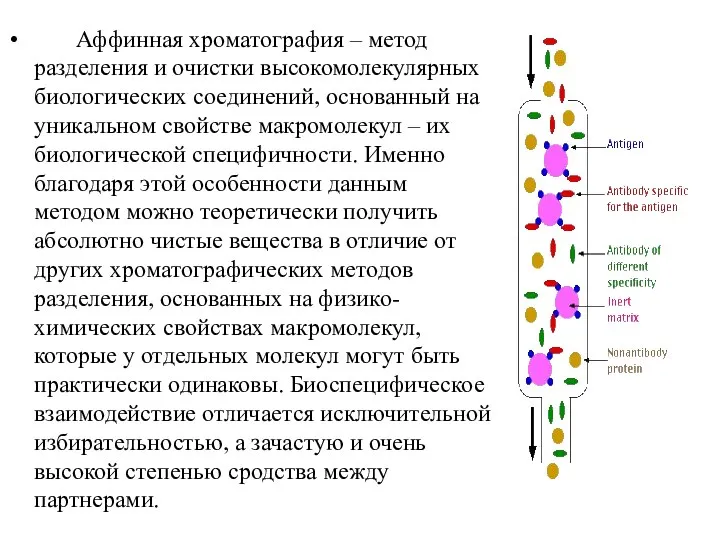
- 18. Аффинная хроматография – метод разделения и очистки высокомолекулярных биологических соединений, основанный на уникальном свойстве макромолекул –
- 19. Разделение клеток на аффинных колонках Аффинная сепарация основана на избирательной сорбции клеток различных субпопуляций носителями, содержащими
- 20. Оценка метода: Степень чистоты выделенных Т- или В-лимфоцитов достигает почти 100%, т. е. она выше или
- 23. Скачать презентацию











 Спинномозговые нервы
Спинномозговые нервы Сучасне уявлення про здоров'я. Холістична модель здоров'я
Сучасне уявлення про здоров'я. Холістична модель здоров'я Хирургические методы лечения заболеваний пародонта: лоскутные операции и методы остеопластики дефектов альвеолярного отростка
Хирургические методы лечения заболеваний пародонта: лоскутные операции и методы остеопластики дефектов альвеолярного отростка Ранние половые связи
Ранние половые связи Лёгочный кровоток
Лёгочный кровоток Синдром Марфана
Синдром Марфана Лимфоидное кольцо
Лимфоидное кольцо Синхронизация колебаний в связанных осцилляторах ФитцХью-Нагумо в ходе эпилептического приступа
Синхронизация колебаний в связанных осцилляторах ФитцХью-Нагумо в ходе эпилептического приступа Ишемический колит
Ишемический колит История развития психопатологии в России и зарубежных странах
История развития психопатологии в России и зарубежных странах Закономерности онтогенеза
Закономерности онтогенеза Наследование, сцепленное с полом
Наследование, сцепленное с полом Классификация дефектов зубных рядов
Классификация дефектов зубных рядов Системні захворювання сполучної тканини
Системні захворювання сполучної тканини Болезни почек. Функциональные пробы почек
Болезни почек. Функциональные пробы почек Права и обязанности застрахованных лиц в системе ОМС
Права и обязанности застрахованных лиц в системе ОМС Пациент с мигрирующей полиартралгией
Пациент с мигрирующей полиартралгией Прививка вакциной Спутник V
Прививка вакциной Спутник V Профилактика детского травматизма
Профилактика детского травматизма Диагностика инфекционных стоматитов у стоматологических больных
Диагностика инфекционных стоматитов у стоматологических больных Клинический случай. Сфингомиелиноз – болезнь Нимана-Пика,
Клинический случай. Сфингомиелиноз – болезнь Нимана-Пика, gg
gg Актуальные аспекты заболевания ботулизмом. Медсестринский процесс
Актуальные аспекты заболевания ботулизмом. Медсестринский процесс Анализ ассортимента и наличия группы противокашлевых и бронхолитических лекарственных средств в Республике Беларусь
Анализ ассортимента и наличия группы противокашлевых и бронхолитических лекарственных средств в Республике Беларусь Атипичные формы инфаркта миокарда
Атипичные формы инфаркта миокарда Оптико-акустический метод регистрации динамики растворения наночастиц кремния при лазерном облучении
Оптико-акустический метод регистрации динамики растворения наночастиц кремния при лазерном облучении Эффективность лечения пациентов детского возраста с острыми респираторными вирусными инфекциями
Эффективность лечения пациентов детского возраста с острыми респираторными вирусными инфекциями Детская инфекционная болезнь корь
Детская инфекционная болезнь корь