Содержание
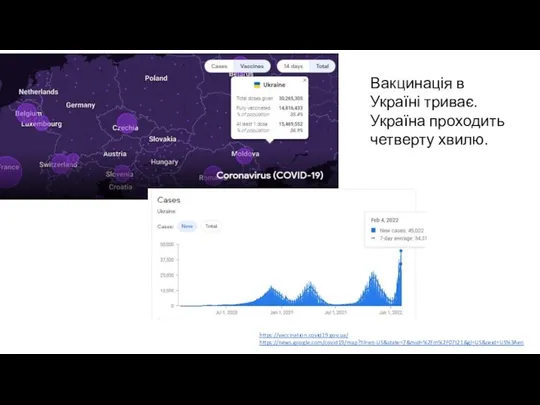
- 5. https://vaccination.covid19.gov.ua/ https://news.google.com/covid19/map?hl=en-US&state=7&mid=%2Fm%2F07t21&gl=US&ceid=US%3Aen Вакцинація в Україні триває. Україна проходить четверту хвилю.
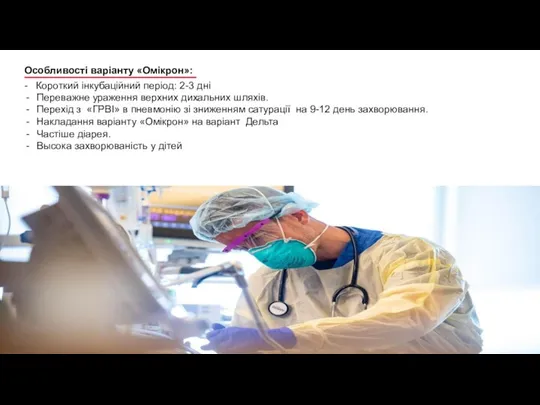
- 6. - Короткий інкубаційний період: 2-3 дні Переважне ураження верхних дихальних шляхів. Перехід з «ГРВІ» в пневмонію
- 7. Протягом 2021 р. стрімке зростання кількості випадків «проривної» інфекції (breakthrough infection) SARS-CoV-2 у країнах з високим
- 8. Збільшення витрат на лікування COVID-19 пов'язано зі збільшенням хворих у відділеннях інтенсивної терапії та збільшенням споживання
- 9. https://www.dec.gov.ua/wp-content/uploads/2022/01/2020_762_protokol_covid19.pdf ПРОТОКОЛ «НАДАННЯ МЕДИЧНОЇ ДОПОМОГИ ДЛЯ ЛІКУВАННЯ КОРОНАВІРУСНОЇ ХВОРОБИ (COVID-19)» КЛІНІЧНЕ ВЕДЕННЯ ПАЦІЄНТІВ З COVID-19 «ЖИВА»
- 10. Пацієнти групи ризику потребують госпіталізації!!! (вік 60+, супутні захворювання) Та на ранньому амбулаторному та госпитальному этапах
- 11. Вступ У березні 2020 року дослідники з Університету Еморі (США) опублікували статтю про молекулу під назвою
- 12. Молнупіравір 1. Toots M, et al. Sci Transl Med. 2019;11:eaax586 2. Hernandez-Santiago BI, et al. Antimicrob
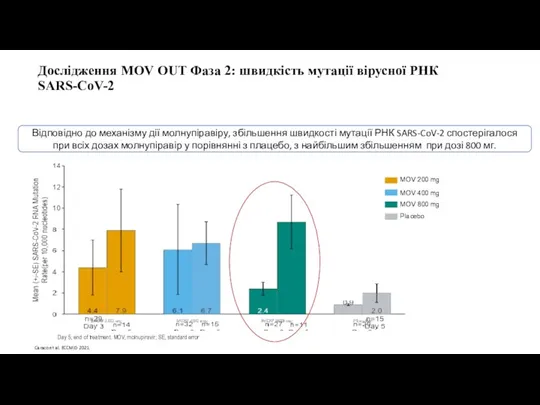
- 13. Дослідження MOV OUT Фаза 2: швидкість мутації вірусної РНК SARS-CoV-2 Відповідно до механізму дії молнупіравіру, збільшення
- 14. ДОЗВІЛ НА ЕКСТРЕНЕ ЗАСТОСУВАННЯ ПРЕПАРАТУ МОЛНУПІРАВІР- два документи: для лікарів та для паціетнів.
- 15. Препарат молнупіравір дозволено для екстреного застосування в Україні 26 січня 2022 на основі рішення Управління по
- 16. ОБМЕЖЕННЯ СХВАЛЕНОГО ЗАСТОСУВАННЯ Молнупіравір не затверджено: для застосування у пацієнтів віком до 18 років для початку
- 17. СПОСІБ ЗАСТОСУВАННЯ ТА ДОЗИ • 800 мг (чотири капсули по 200 мг) приймати перорально кожні 12
- 18. Поточні рекомендації NIH щодо амбулаторного лікування (в порядку переваги, last update 19.01.22) Паксловід (нирматрелвір 300 мг
- 19. Клінічні дані, що підтверджують це EUA, базуються на даних 1433 рандомізованих суб’єктів у дослідженні Фази 3
- 20. ДОЗВІЛ НА ЕКСТРЕНЕ ЗАСТОСУВАННЯ ПРЕПАРАТУ МОЛНУПІРАВІР UA/19184/01/01 http://www.drlz.com.ua Зниження ризику летальності на 89% в групі молнупіравіру.
- 21. Немає необхідності у коригуванні дози у окремих груп пацієнтів ( з нирковою або печінковою недостатністю або
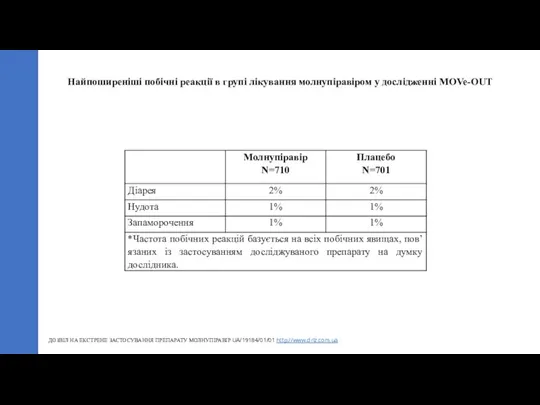
- 22. ДОЗВІЛ НА ЕКСТРЕНЕ ЗАСТОСУВАННЯ ПРЕПАРАТУ МОЛНУПІРАВІР UA/19184/01/01 http://www.drlz.com.ua Найпоширеніші побічні реакції в групі лікування молнупіравіром у
- 23. Контрацепція Жінки Слід рекомендувати особам репродуктивного віку належним чином та постійно використовувати надійний метод контрацепції, відповідно
- 26. Скачать презентацию

















 ДБҚБ
ДБҚБ Гипертонические препараты
Гипертонические препараты Злокачественные опухоли яичника
Злокачественные опухоли яичника Система верхней полой вены. Система нижней полой вены. Система воротной вены
Система верхней полой вены. Система нижней полой вены. Система воротной вены Микробиологический мониторинг и рациональный выбор антибиотиков
Микробиологический мониторинг и рациональный выбор антибиотиков Клиническая картина ишемического инсульта в бассейне задней мозговой артерии
Клиническая картина ишемического инсульта в бассейне задней мозговой артерии Бір жасқа дейінгі балаларды аралас және аралас тамақтандыру
Бір жасқа дейінгі балаларды аралас және аралас тамақтандыру Полимеразная цепная реакция - новый метод лабораторной диагностики
Полимеразная цепная реакция - новый метод лабораторной диагностики Упражнения на укрепление осанки
Упражнения на укрепление осанки Стивенс-Джонсон синдромы - өткір токсикоаллергиялық ауру
Стивенс-Джонсон синдромы - өткір токсикоаллергиялық ауру Философия психиатрии
Философия психиатрии Профилактика гриппа и новой коронавирусной инфекции Сovid-19
Профилактика гриппа и новой коронавирусной инфекции Сovid-19 Аутичный ребёнок
Аутичный ребёнок Кардиоверсия при ФП - электрическая или фармакологическая
Кардиоверсия при ФП - электрическая или фармакологическая Анестетики
Анестетики Кандиломатоз перианальной области
Кандиломатоз перианальной области Микробоносительство как одна из форм инфекции: его сущность, практическое значение
Микробоносительство как одна из форм инфекции: его сущность, практическое значение Все мы любим и слушаем музыку. Звуки музыки всюду сопровождают нас, будь то шум дождя или пение птиц, шелест листвы или мелодии люби
Все мы любим и слушаем музыку. Звуки музыки всюду сопровождают нас, будь то шум дождя или пение птиц, шелест листвы или мелодии люби Что такое Донованоз. ИППП
Что такое Донованоз. ИППП Анатомические особенности кисти
Анатомические особенности кисти Синдром Брилла – Симмерса
Синдром Брилла – Симмерса Прикладная анатомия брюшной стенки. Техника лапароскопии
Прикладная анатомия брюшной стенки. Техника лапароскопии Профилактическая медицина
Профилактическая медицина Первая помощь при укусах насекомых
Первая помощь при укусах насекомых Стандартизация лекарственных растительных средств
Стандартизация лекарственных растительных средств ВИЧ и СПИД
ВИЧ и СПИД ТеоретическиеОсновы
ТеоретическиеОсновы Инфекционные заболевания
Инфекционные заболевания