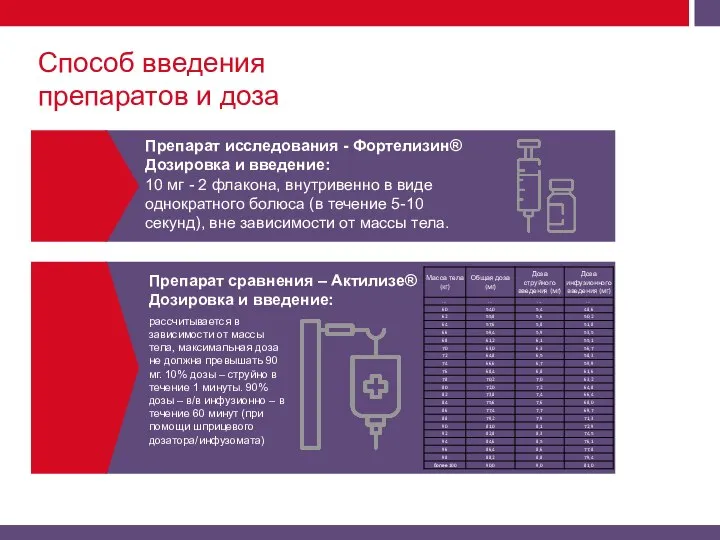
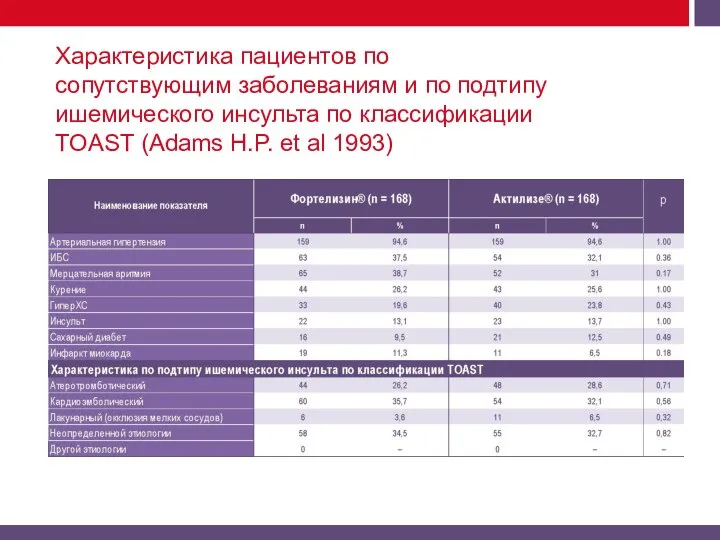
Актилизе и Фортелизин).
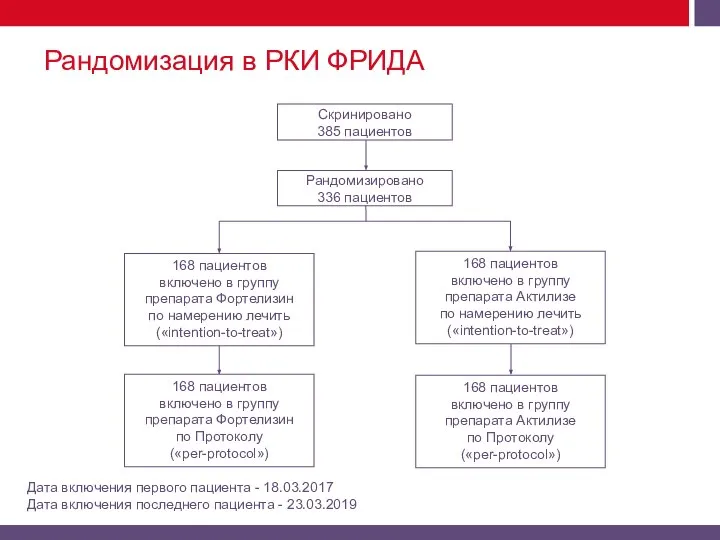
Метод рандомизации - методом «конвертов», «блочная» рандомизация.
Исследователь не имел доступа к рандомизационной последовательности и выбирал конверт в соответствии с последовательностью включения пациента в исследование от наименьшего.
Рандомизация и «заслепление»
Критерии включения пациентов
Мужчины и женщины в возрасте 18 лет и старше, после 80 лет с осторожностью*.
Верифицированный диагноз ишемического инсульта*.
Продолжительность симптомов ишемического инсульта не более 4,5 ч до начала проведения тромболитической терапии.
Наличие подписанного и датированного информированного согласия пациента на участие в исследовании.
Согласие пациента на использование надежных методов контрацепции на протяжении всего исследования и в течение 3 недель после.
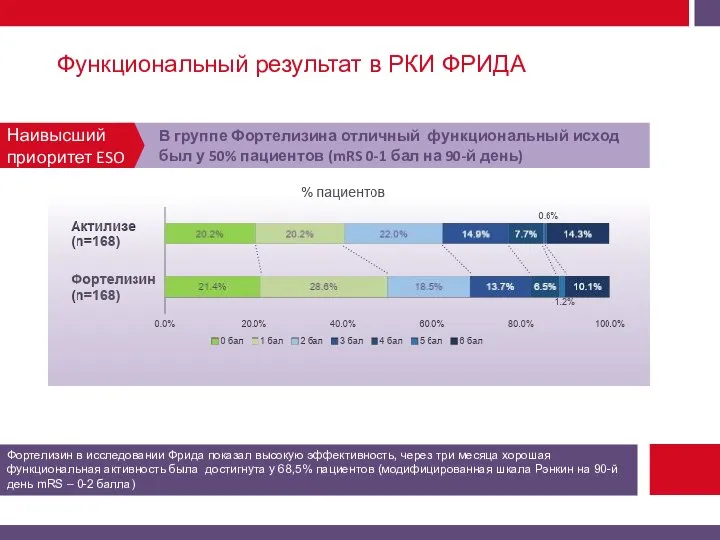
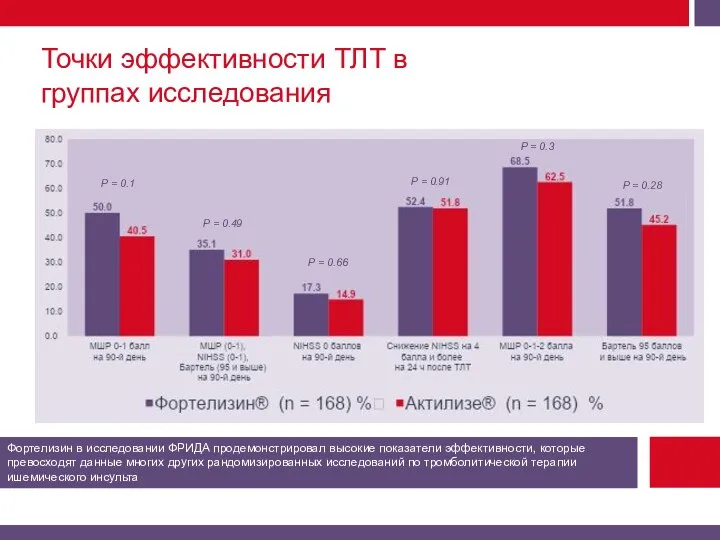
Первичная конечная точка эффективности – хорошее функциональное восстановление на 90-й день (МШР 0-1 балл).
Вторичная комбинированная конечная точка эффективности на 90-й день – МШР (0-1 балл) + индекс NIHSS (0-1 балл) + индекс Бартель (95 баллов и выше).
Дополнительный критерий эффективности – балл NIHSS через 24 ч и через 90 дней.
Критерии оценки эффективности
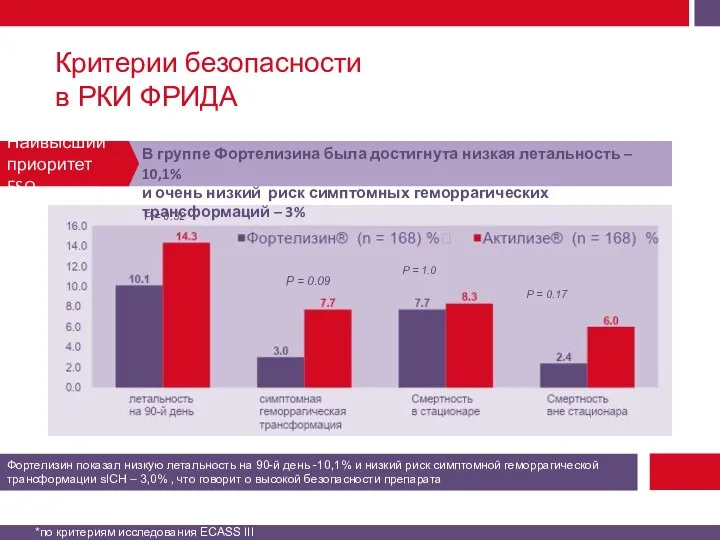
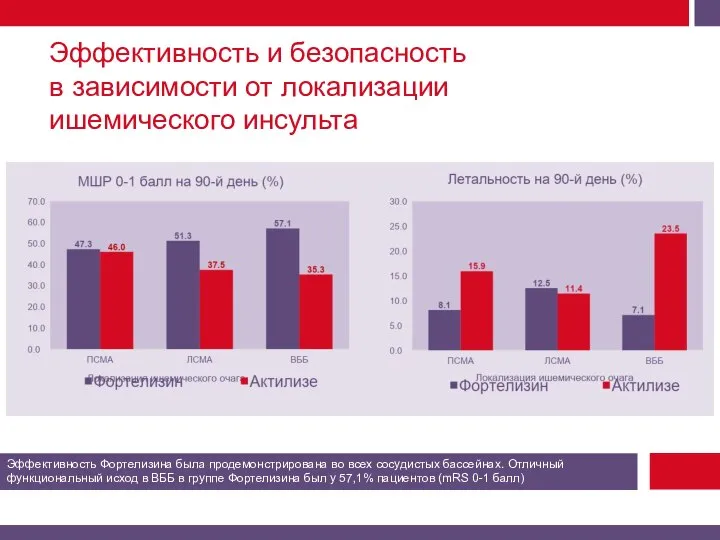
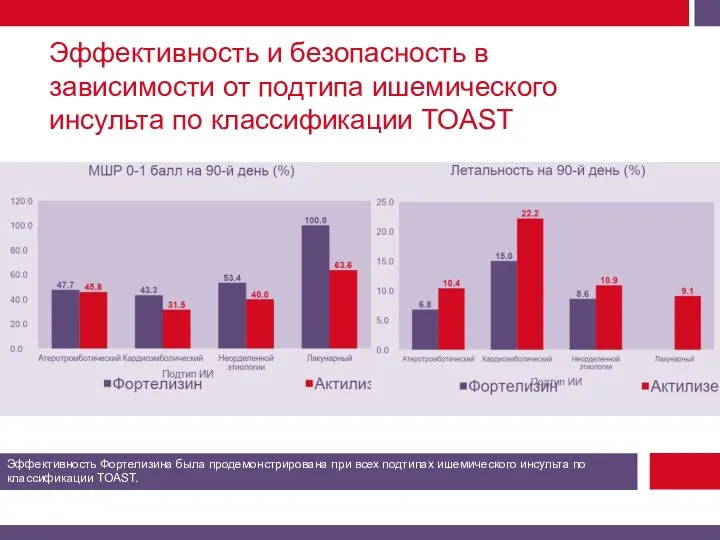
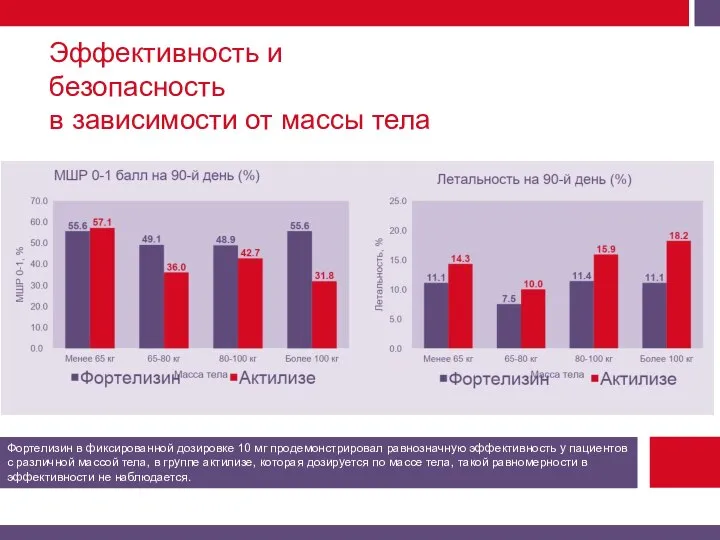
Смертность от всех причин на 90-й день.
Геморрагическая трансформация (все случаи).
Симптомная геморрагическая трансформация («Геморрагическая трансформация очага поражения головного мозга является симптомной, если ее развитие приводит к увеличению суммарной оценки по шкале инсульта NIH на 4 балла и более от исходного или наименьшего уровня в первые 7 дней, либо любое кровоизлияние, закончившееся смертельным исходом (критерии исследования ECASS III)»*).
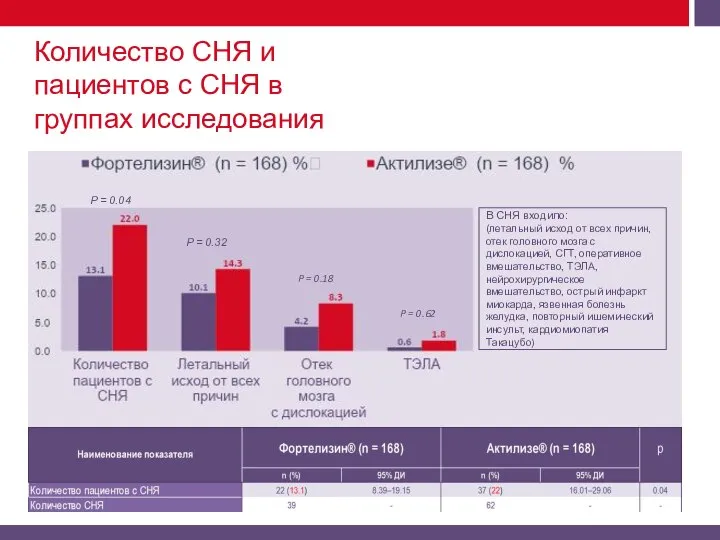
Количество СНЯ и НЯ по органам и системам.
Критерии оценки безопасности:
* Н.А. Шамалов, Л.В. Стаховская
Клинический Протокол «Тромболитическая терапия ишемического инсульта», 2017 год
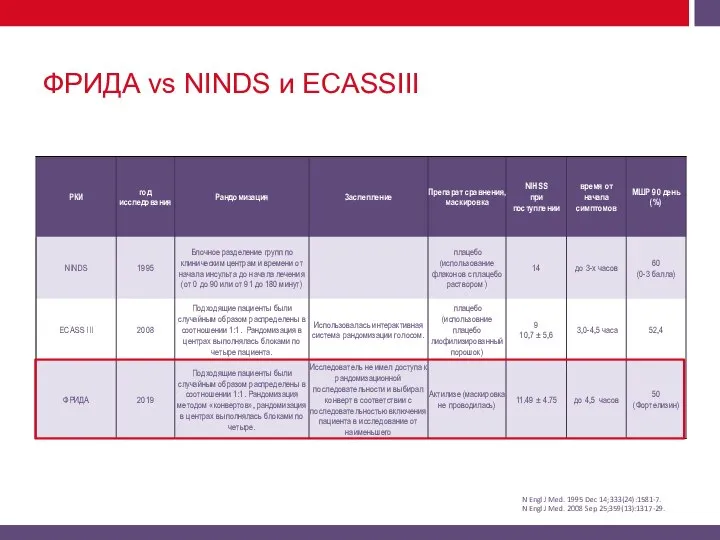
Фортелизин® в Рандомизированном ИсслеДовании vs Актилизе
ClinicalTrials.gov NCT 03151993
Single Bolus Recombinant Nonimmunogenic Staphylokinase (Fortelyzin)
and Bolus Infusion Alteplase in Patients With Acute Ischemic Stroke
FRIDA Stroke





 LAMBINI. Уход за кожей ребенка
LAMBINI. Уход за кожей ребенка Аномалии развития и заболевания органов речи у детей
Аномалии развития и заболевания органов речи у детей Психосоматические растройтсва
Психосоматические растройтсва Gesundheitsversorgung in Deutschland
Gesundheitsversorgung in Deutschland Еркін нарық оңтайлылық. Аяқталмаған нарығы. Еркін нарық денсаулық жағдайларына жұмыс істеуі
Еркін нарық оңтайлылық. Аяқталмаған нарығы. Еркін нарық денсаулық жағдайларына жұмыс істеуі Қызылиектің және пародонт қабынуын дәрілермен жергілікті емдеу
Қызылиектің және пародонт қабынуын дәрілермен жергілікті емдеу Желчнокаменная болезнь (ЖКБ)
Желчнокаменная болезнь (ЖКБ) Мобильный кардиоанализатор
Мобильный кардиоанализатор Клиника интеллектуальных нарушений при слепоте и слабовидении возникших в раннем детстве
Клиника интеллектуальных нарушений при слепоте и слабовидении возникших в раннем детстве Правильное питание как основа здорового образа жизни
Правильное питание как основа здорового образа жизни Тестостерон, адреналин, слабость
Тестостерон, адреналин, слабость Ересек және балалардағы синкопальды жағдайлар
Ересек және балалардағы синкопальды жағдайлар Центральный парез
Центральный парез Первая степень атрио-вентрикулярной блокады
Первая степень атрио-вентрикулярной блокады Заболевания сердечно-сосудистой системы
Заболевания сердечно-сосудистой системы Желчнокаменная болезнь
Желчнокаменная болезнь Лечебная физическая культура в комплексной реабилитации больных хроническими бронхитами
Лечебная физическая культура в комплексной реабилитации больных хроническими бронхитами Особенности пространственной ориентировки детей с нарушениями зрения
Особенности пространственной ориентировки детей с нарушениями зрения Физиология выделения. Характеристика выделительной системы
Физиология выделения. Характеристика выделительной системы Быстрые роды
Быстрые роды Предупреждение заболеваний почек. Питьевой режим
Предупреждение заболеваний почек. Питьевой режим Лекарственные препараты
Лекарственные препараты Аборт как социально-медицинская проблема
Аборт как социально-медицинская проблема Основные положения гигиены. Раздел 1
Основные положения гигиены. Раздел 1 Ветсансараптау әдістері
Ветсансараптау әдістері Чума. Эпизоотология. Носители
Чума. Эпизоотология. Носители Шовный материал
Шовный материал Закономерности метастазирования опухолей
Закономерности метастазирования опухолей