Слайд 2Синонимы, термины
новообразование,
неоплазма (neoplasma),
бластома (blastoma),
тумор (tumor),
онкос (oncos);
эпителиома – доброкачественная опухоль

из эпителия,
рак или карцинома (cancer, carcinoma) – злокачественная опухоль из эпителия,
саркома (sarcoma) – злокачественная опухоль мезенхимального происхождения.
Слайд 3Определения
Дж. Юинг (1940): основное свойство злокачественной опухоли – «наследственно обусловленный автономный

рост».
В. Уиллис (1967): злокачественная опухоль – «патологическая масса ткани с чрезмерным, некоординированным ростом, который сохраняется даже после прекращения действия факторов, его вызвавших».
А.И. Струков, В.В. Серов (1995): злокачественная опухоль – «патологический процесс, характеризующийся безудержным размножением (ростом) клеток».
М.А. Пальцев, Н.М. Аничков (2005): опухоль – «патологический процесс , представленный новообразованной тканью, в которой изменения генетического аппарата клеток приводят к нарушению регуляции их роста и дифференцировки».
Слайд 4Эпидемиология
Онкологические заболевания многие годы уверенно занимают 2 место в структуре причин смерти

после сердечно-сосудистой патологии.
Наблюдается рост заболеваемости и смертности от онкологических заболеваний во всех странах мира.
Из-за тенденции к снижению смертности от сердечно-сосудистых причин опухоли имеют шанс стать лидером среди причин смерти в ХХI в.
Ежегодно в мире:
регистрируется около 5,9 млн. новых случаев злокачественных опухолей;
погибает 2 млн. больных.
В России число больных с впервые выявленным диагнозом злокачественного новообразования в 1999 г. составило 303,3 на 100 тыс. человек.
При этом летальность в течение 1 года с момента постановки диагноза – 36,2%.
Слайд 5Этиология опухолей
Различные этиологические факторы, способные вызвать развитие опухолей, называют канцерогенными факторами (канцерогенами).

Основные группы канцерогенов: химические, физические (радиационные) и вирусные.
Полагают, что 80–90% злокачественных опухолей – результат неблагоприятного воздействия окружающей среды (проблема рака – экологическая проблема).
Процесс развития опухолей под влиянием канцерогенных факторов носит название канцерогенеза.
Основные теории канцерогенеза:
теория химических канцерогенов,
теория физических канцерогенов,
вирусно-генетическая теория,
инфекционная теория,
полиэтиологическая теория,
дизонтогенетическая теория (теория «эмбриональных зачатков») Ю. Конгейма.
Слайд 6Теория химических канцерогенов
Первое наблюдение химического канцерогенеза: сэр Персиваль Потт описал рак мошонки

у трубочистов.
Примеры: РМП у у работающих с анилиновыми красителями, РЛ у контактирующих с асбестом, РП у работников ПХВ-производства.
Химические канцерогены:
эпигенетические (хлорорганические соединения, иммунодепрессанты) – не дают положительных результатов в тестах на мутагенность, но их введение вызывает развитие опухолей;
генотоксические (полициклические ароматические углеводороды, ароматические амины, нитрозосоединения) взаимодействуют с ДНК (напрямую или после химических превращений).
Слайд 7Теория химических канцерогенов
Стадии химического канцерогенеза:
инициация,
промоция,
прогрессия опухоли.
Инициация: генотоксический канцероген взаимодействует с геномом клетки,

что вызывает его перестройку.
Промоция: протоморы (эпигенетические канцерогены) вызывают дополнительные перестройки генома и обеспечивают опухолевую трансформацию клетки.
Прогрессия: клетка малигнизируется и начинает бесконтрольно делиться.
Слайд 8Теория физических канцерогенов
Физические канцерогены – самые распространённые канцерогенные факторы для человека:
солнечная, космическая

и ультрафиолетовая радиация;
ионизирующая и неионизирующая радиация;
радиоактивные вещества.
Слайд 9Инфекционная теория канцерогенеза
Основоположник вирусно-генетической теории – Л.А. Зильбер.
Развитие ряда опухолей возможно под

действием онкогенных вирусов.
Первый онкогенный вирус описал в 1911 г. Пэйтон Раус как фильтруемый агент, способный вызвать развитие саркомы у кур.
В 1930-х годах были открыты вирусы рака молочных желёз мышей и папилломы кроликов.
Доказана роль ДНК- и РНК-содержащих вирусов в развитии следующих опухолей человека:
лимфома Беркитта (ДНК-вирус Эпстайна–Барр),
папиллома и рак кожи гениталий (ДНК-вирус папилломы),
T-клеточные лейкозы и лимфомы (РНК-вирус HLTVI).
Бактериальный канцерогенез:
Helicobacter pylori – бактерия, признанная этиологическим фактором развития лимфом (мальтом) и рака желудка.
Слайд 10Роль наследственности
Злокачаственные опухоли диагностируют с различной частотой среди разных этнических групп, проживающих

на одной территории (в США среди негров заболеваемость РЛ в 2 раза выше, чем среди белых).
Многие опухоли у детей (ретинобластома, нефробластома, гепатобластома) наследственны, а в этих семьях обнаруживают специфические хромосомные аномалии (напр., развитие ретинобластомы связывают с потерей гена р53 из-за делеции хромосомы 13).
С наследственными факторами связывают возникновение опухолей при синдроме атаксии-телеангиоэктазии (лейкозы и лимфомы), синдроме Блума (лейкозы и др.), множественном полиэндокринном аденоматозе.
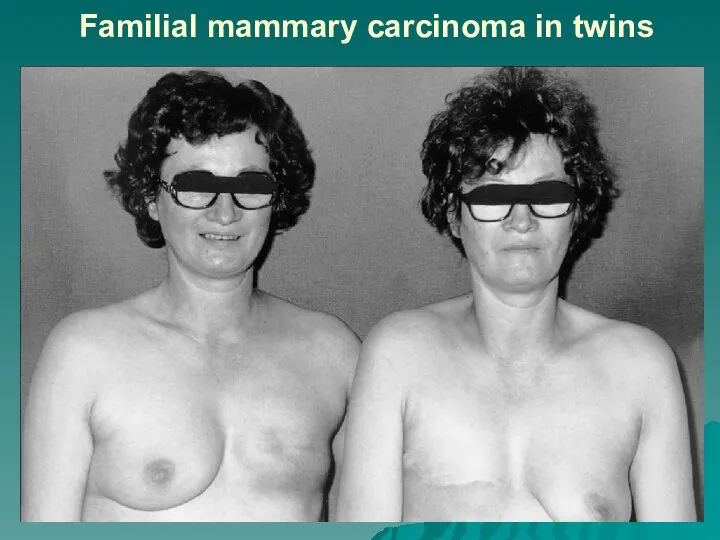
Рак молочных желёз, толстой кишки и почек возникает чаще в определённых семьях.
Слайд 11Familial mammary carcinoma in twins
Слайд 12Полиэтиологическая теория
Объединяет все другие теории.
Развитие опухолей – результат влияния разнообразных канцерогенных агентов,

под действием которых происходят генетические перестройки (мутации) в клетках (соматических, половых) в результате повреждения молекул ДНК.
Возможно суммирование и усиление эффекта всех известных канцерогенов.
Мишени канцерогенных агентов:
протоонкогены – регуляторы нормальной пролиферации и дифференцировки клеток;
гены-супрессоры опухолей (антионкогены), ингибирующие пролиферацию клеток;
гены, участвующие в апоптозе клеток;
гены-мутаторы, в том числе гены, отвечающие за репарацию ДНК;
теломераза.
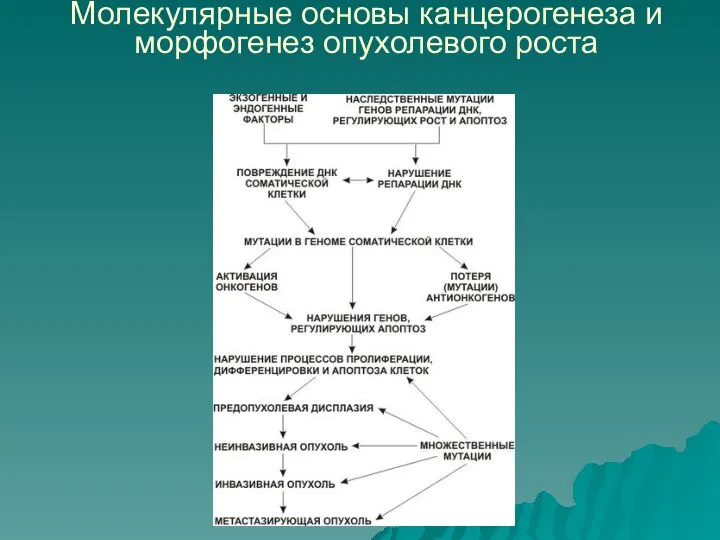
Слайд 13Молекулярные основы канцерогенеза и морфогенез опухолевого роста
Слайд 14Классификация опухолей
Выделяют опухоли:
доброкачественные,
злокачественные,
пограничные
в зависимости от:
степени зрелости

опухолевых клеток,
темпов роста опухоли,
характера роста опухоли,
способности опухоли рецидивировать,
способности опухоли метастазировать.
Слайд 15Доброкачественные опухоли:
состоят из зрелых, дифференцированных клеток;
растут медленно;
экспансивный рост с формированием

капсулы из соединительной ткани на границе с окружающей нормальной тканью (опухоль растёт «сама из себя»);
не рецидивируют после удаления;
не дают метастазов.
Название доброкачественных опухолей состоит, как правило, из корня (названия исходной ткани) с добавлением суффикса «-ома».
Слайд 17Злокачественные опухоли:
построены из частично дифференцированных или недифференцированных клеток;
растут быстро;
рост инфильтрирующий: прорастают

окружающие ткани, врастают в сосуды (инвазивный рост);
могут рецидивировать;
могут метастазировать;
нередко бывают вторичные изменения в виде очагов
некроза,
кровоизлияний,
ослизнения,
петрификации.
Слайд 19Взаимоотношения доброкачественных и злокачественных опухолей:
одни доброкачественные опухоли способны к трансформации в злокачественные

в результате опухолевой прогрессии (аденоматозные полипы, аденомы);
другие доброкачественные опухоли никогда (почти никогда) не переходят в злокачественные.
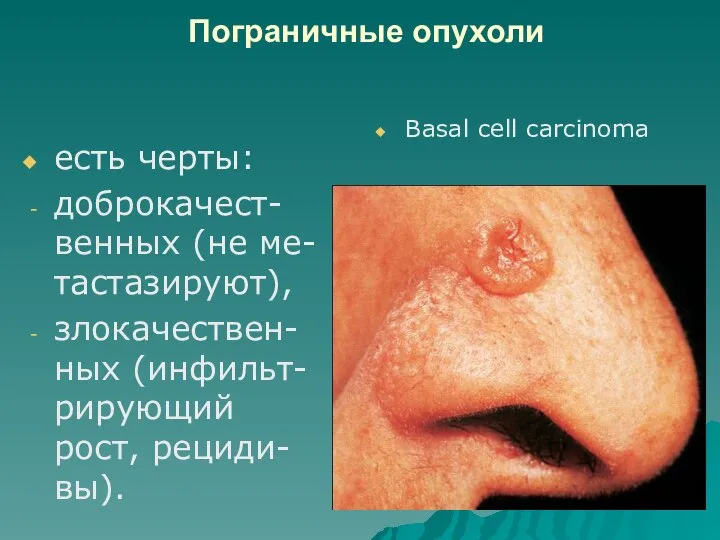
Слайд 20Пограничные опухоли
есть черты:
доброкачест-венных (не ме-тастазируют),
злокачествен-ных (инфильт-рирующий рост, рециди-вы).
Basal cell carcinoma
Слайд 21Основные свойства опухолей:
автономный рост,
нарушение митоза и апоптоза,
наличие атипизма,
способность к прогрессии и

метастазированию.
Слайд 22Автономный (чрезмерный, бесконтрольный) рост
Автономность опухоли – приобретение опухолевыми клетками способности к самоуправлению,

а не полная независимость их от организма.
В доброкачественных опухолях автономность выражена слабо (опухолевые клетки подчиняются регуляторным воздействиям).
В злокачественных опухолях автономный рост значительно выражен (характерно отсутствие контроля за пролиферацией и дифференцировкой клеток со стороны организма-опухоленосителя).
Автономность опухоли относительна, т.к. опухолевая ткань:
постоянно получает от организма с током крови питательные вещества, кислород, гормоны, цитокины;
испытывает влияния иммунной системы и окружающей неопухолевой ткани.
Слайд 23Патология митоза и апоптоза
Патология митоза:
фракция делящихся клеток в опухолевой ткани значительно выше

(около 20% клеток), чем в гомологичных зрелых неопухолевых клетках.
Патология апоптоза:
недостаточный (по отношению к уровню пролиферации) апоптоз способствует выживанию мутированных клеток и развитию опухолей,
незавершённый апоптоз (без последующего фагоцитоза апоптозных телец) может стимулировать рост опухоли за счёт высвобождения из распадающихся апоптозных телец митогенетических факторов.
Таким образом, рост опухолевой ткани связан с
увеличением числа делящихся клеток,
недостаточным апоптозом,
незавершённым характером апоптоза.
Слайд 24Атипизм
От греч. atypicus - отклонение от нормы.
Также используют понятия «анаплазия» (возврат к

эмбриональному этапу развития) и «катаплазия» (уподобление эмбриональной ткани).
Последний термин более правильный, так как при опухолевом росте возврата к эмбриональной ткани не происходит, хотя многие свойства опухолевой ткани сближают её с эмбриональной.
Виды атипизма в опухолях:
морфологический,
биохимический,
антигенный,
функциональный.
Слайд 25Морфологический атипизм
Морфологический атипизм (атипизм структуры опухоли) означает, что ткань опухоли не повторяет

строение аналогичной зрелой ткани, и клетки опухоли могут быть не похожи на зрелые клетки того же происхождения.
Виды морфологического атипизма:
тканевой,
клеточный.
Слайд 26Морфологический атипизм
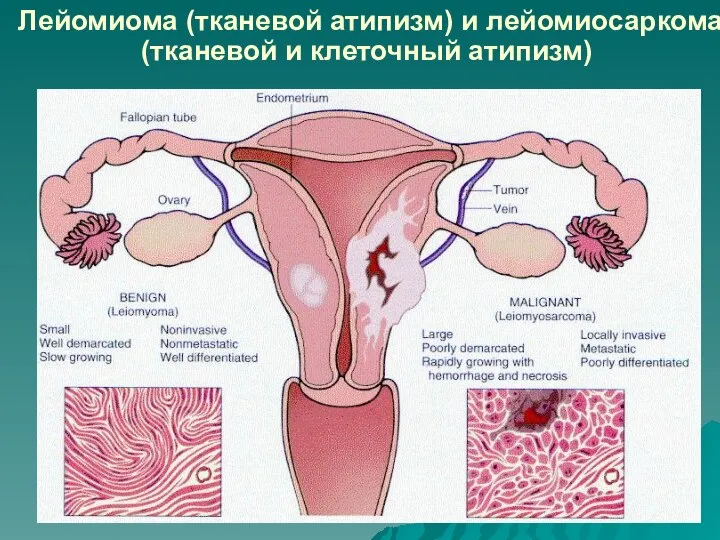
Тканевой атипизм:
нарушение формы и величины эпителиальных структур, изменение соотношения между паренхимой

и стромой опухоли;
хаотичное расположение волокнистых структур в мезенхимальных опухолях.
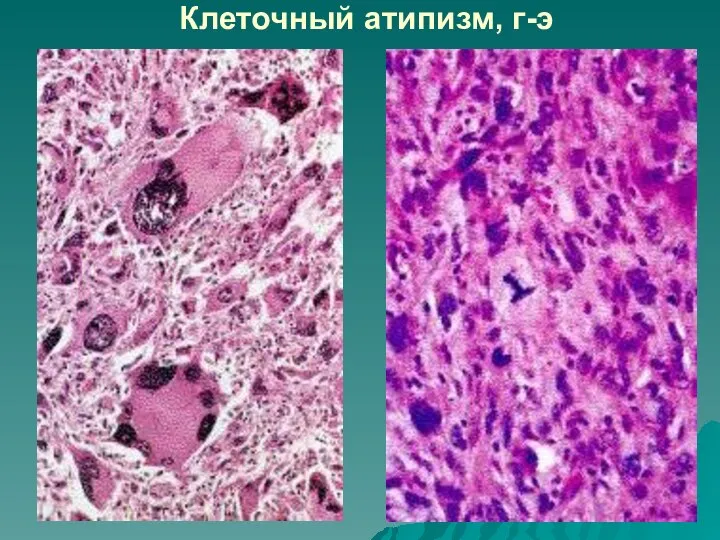
Клеточный атипизм (атипизм ядра, цитоплазмы, мембраны опухолевых клеток):
полиморфизм клеток, прежде всего – их ядер (по величине, форме, степени окраски, количеству);
укрупнение ядер с увеличением ядерно-цитоплазматического соотношения;
появление крупных ядрышек;
большое количество митозов;
патологические митозы.
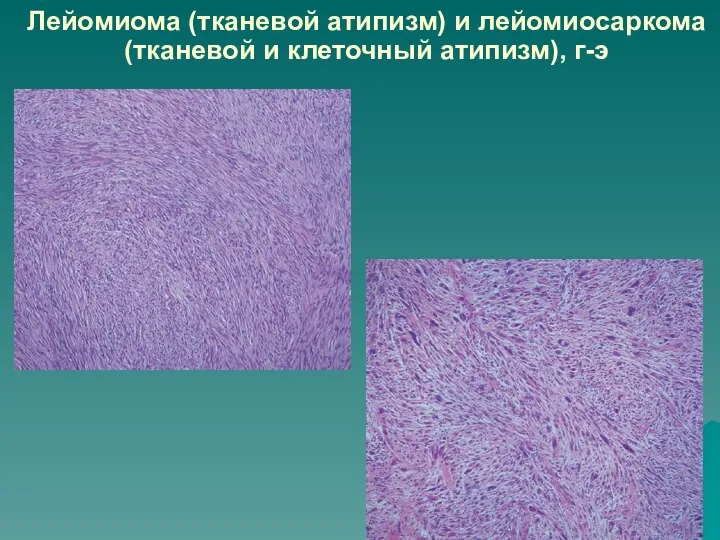
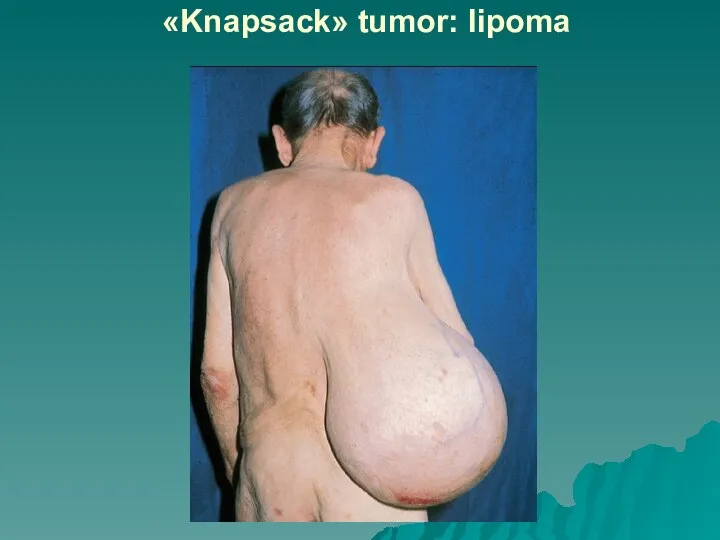
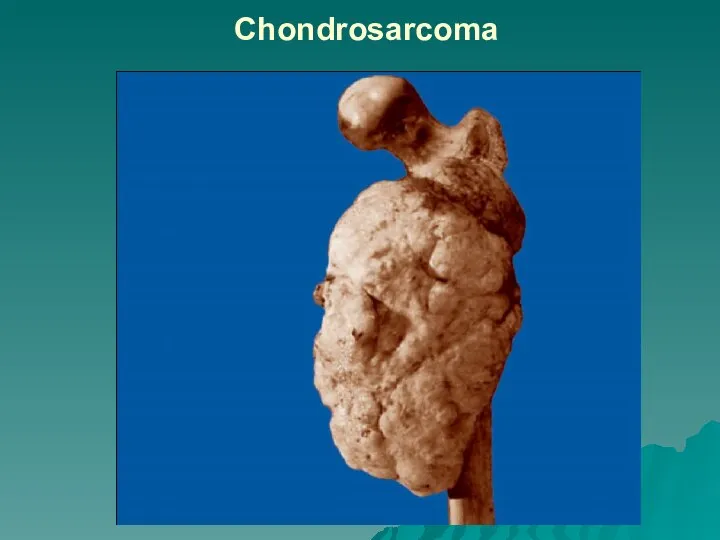
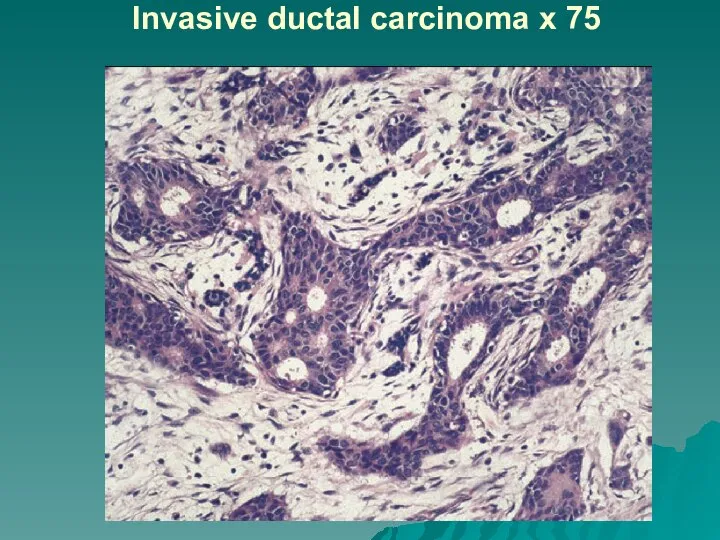
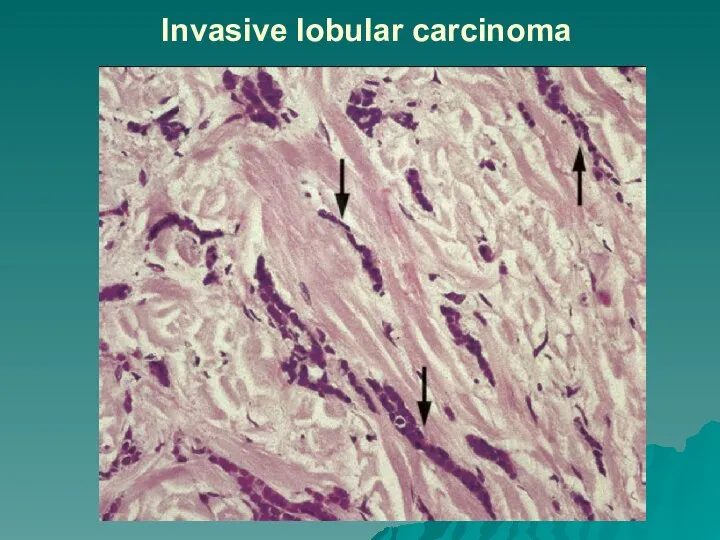
Слайд 27Лейомиома (тканевой атипизм) и лейомиосаркома (тканевой и клеточный атипизм)
Слайд 28Лейомиома (тканевой атипизм) и лейомиосаркома (тканевой и клеточный атипизм), г-э
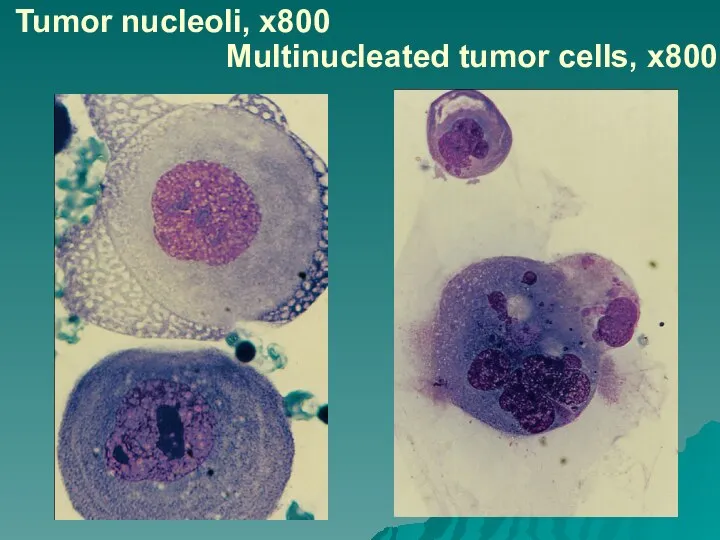
Слайд 30Tumor nucleoli, x800
Multinucleated tumor cells, х800
Слайд 31Морфологический атипизм
Доброкачественным опухолям свойственен только тканевой атипизм, поскольку они построены из зрелых,

дифференцированных клеточных элементов.
Злокачественным опухолям присущи оба типа морфологического атипизма (тканевой и клеточный).
Существует положительная корреляция между степенью выраженности морфологического атипизма и злокачественностью опухоли.
Клеточный атипизм можно изучать с помощью электронной микроскопии (изменения ядра, органелл цитоплазмы, мембраны).
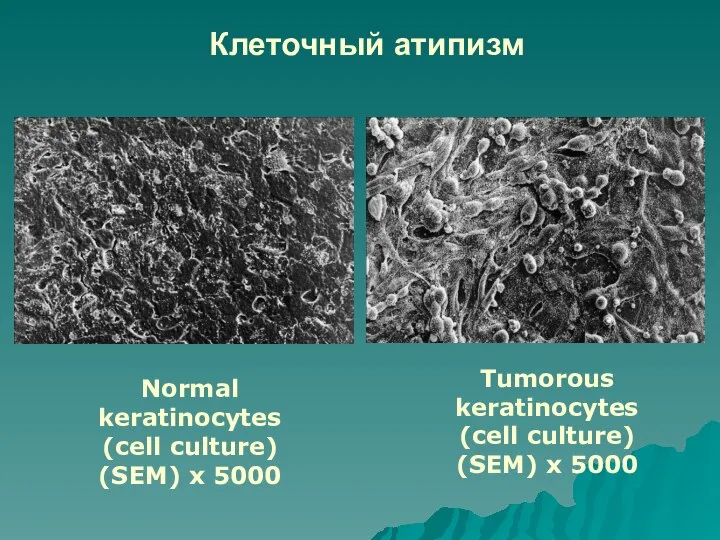
Слайд 32Клеточный атипизм
Tumorous keratinocytes
(cell culture)
(SEM) x 5000
Normal
keratinocytes
(cell culture)
(SEM) x 5000
Слайд 33Биохимический атипизм
Биохимический атипизм – метаболические изменения опухолевой ткани.
Перестройки метаболизма в опухоли направлены

на обеспечение её роста и приспособление к дефициту кислорода, возникающему при быстром росте опухоли (с превращением опухолевых клеток в факультативные анаэробы).
Биохимический атипизм можно изучать с помощью ГХ-метода (гистохимический атипизм).
Слайд 34Антигенный атипизм
Антигенный атипизм: опухоль содержит ряд свойственных только ей антигенов.
Выявление этих антигенов

(онкомаркёров белковой природы) ИГХ-методами широко используют в диагностике недифференцированных и низкодифференцированных опухолей.
Слайд 35ИГХ-маркёры опухолей
Групповые маркёры эпителиальных карцином – промежуточные филаменты (цитокератины).
Маркёры нейроэндокринных опухолей – хромогранин,

синаптофизин.
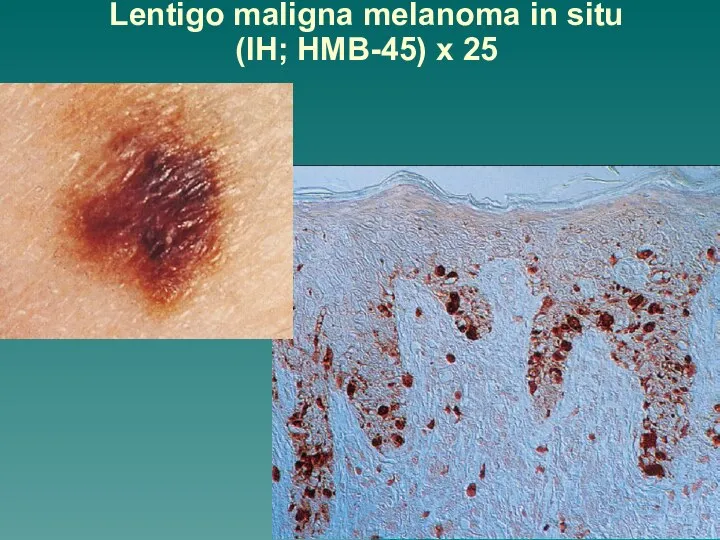
Меланома экспрессирует антиген HMB-45.
Саркомы мягких тканей синтезируют фибробластические – виментин, мышечные – десмин, гладкомышечные – гладкомышечный актин (SMA).
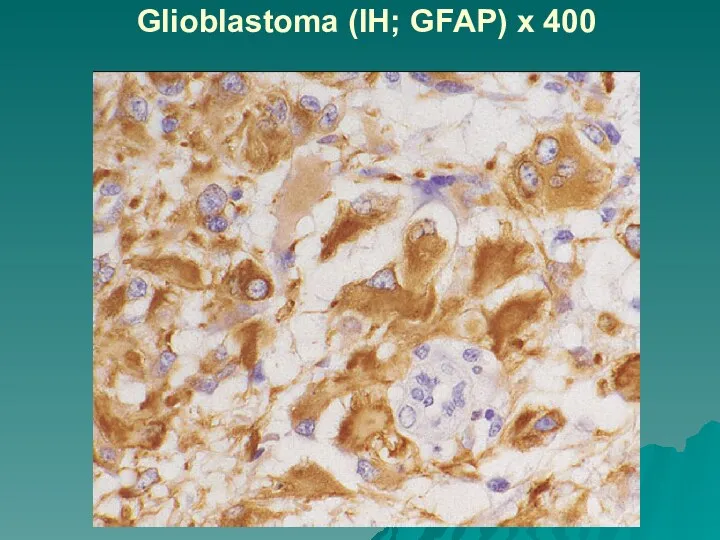
Нейрогенные опухоли – нейрон-специфическую енолазу (NSE), глиальный фибриллярный кислый белок (GFAP).
Сосудистые саркомы экспрессируют CD34 и другие маркёры эндотелиальных клеток.
Слайд 36Lentigo maligna melanoma in situ
(IH; HMB-45) x 25
Слайд 38Функциональный атипизм:
утрата опухолевыми клетками специализированных функций, присущих аналогичным зрелым клеткам,
или (и)

появление новой функции, не свойственной клеткам данного типа (напр., клетки скирра усиленно синтезируют коллаген стромы).
Слайд 39Прогрессия опухолей
Согласно теории прогрессии опухолей (Л. Фулдс, 1969), происходит постоянный стадийный прогрессирующий

рост опухоли с прохождением ею качественно разных стадий (теория стадийной трансформации).
Однако существует представление о развитии опухоли de novo (теория скачкообразной трансформации).
Слайд 40Теории опухолевой трансформации
Теория скачкообразной трансформации: развитие опухоли возможно без предшествующих изменений тканей

(однако в большинстве экспериментальных моделей опухолей представлено их многоступенчатое развитие).
Теория стадийной трансформации (с выделением 4-х стадий в морфогенезе злокачественных опухолей):
предопухоли (гиперплазия и дисплазия),
неинвазивной опухоли (рак in situ),
инвазивного роста опухоли,
метастазирования.
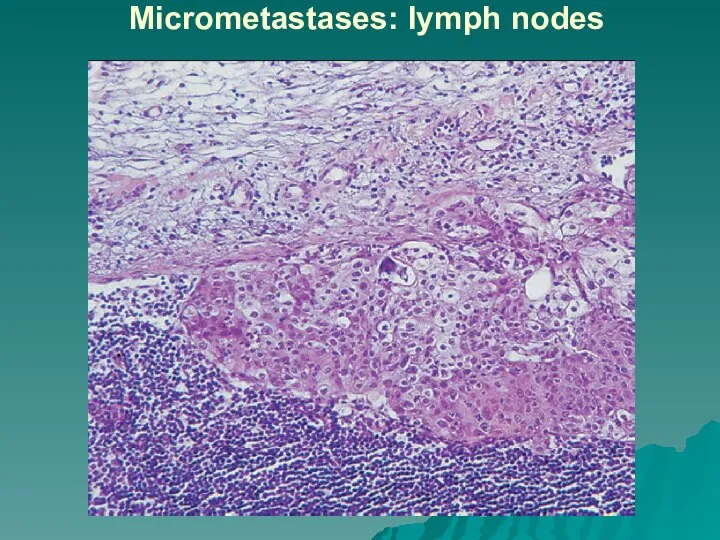
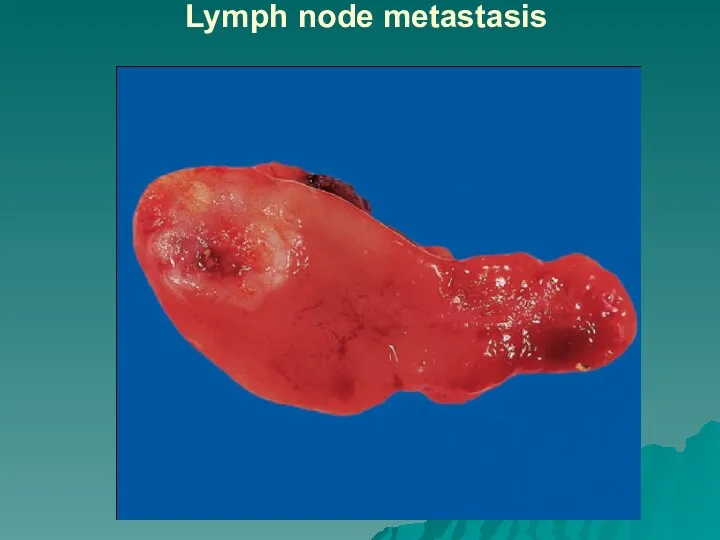
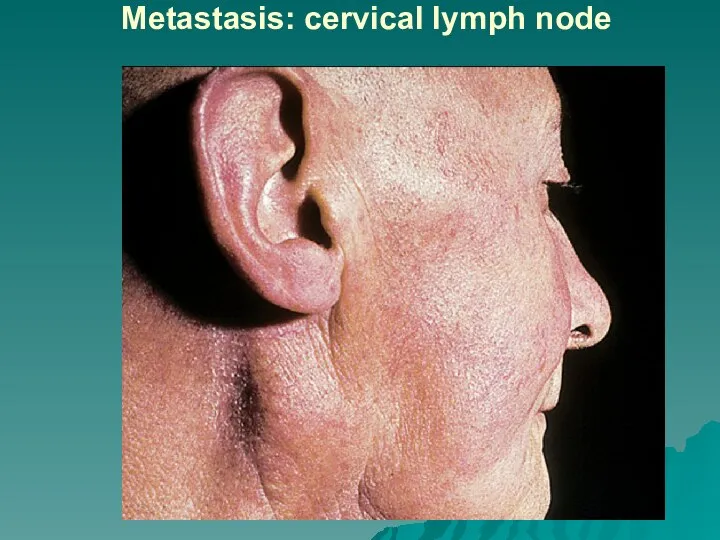
Слайд 41Метастазирование
Метастазирование - заключительная стадия морфогенеза опухоли.
Процесс метастазирования связан с распространением опухолевых клеток

из первичной опухоли в другие органы по лимфатическим, кровеносным сосудам, имплантационно, периневрально, что легло в основу выделения видов метастазирования:
лимфгенный,
гематогенный,
имплантационный,
периневральный,
смешанный.
.
Слайд 42Метастазирование
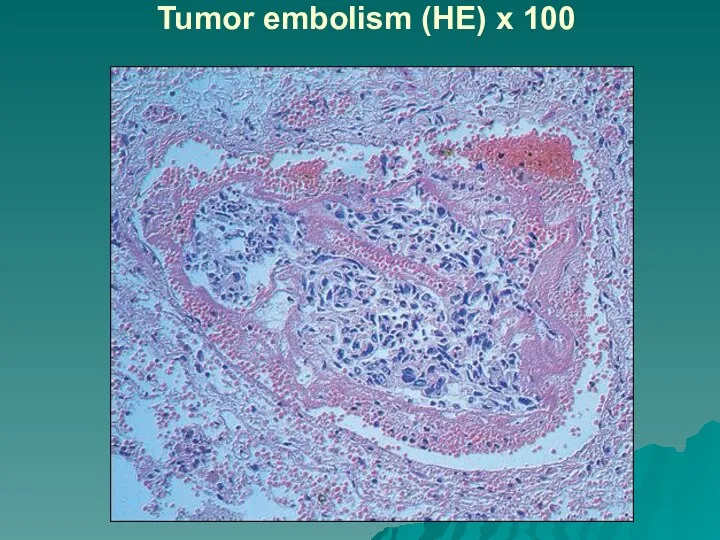
Процесс метастазирования объясняет теория метастатического каскада.
В соответствии с ней опухолевая клетка

претерпевает цепь (каскад) перестроек, обеспечивающих распространение в отдалённые органы.
Этапы метастатического каскада:
формирование метастатического опухолевого субклона;
инвазия в просвет сосуда;
циркуляция опухолевого эмбола в кровотоке (лимфотоке);
оседание на новом месте с развитием вторичной опухоли.
Слайд 43Метастазирование
Процесс метастазирования начинается с появления метастатического субклона опухолевых клеток с изменённой плазмолеммой.

Эти клетки, теряя межклеточные контакты и приобретая способность к передвижению, мигрируют через межклеточный матрикс, прикрепляются при помощи интегринов к ламинину, фибронектину, коллагеновым молекулам базальной мембраны сосуда и осуществляют её протеолиз за счёт выделения коллагеназ, катепсина, эластазы, гликозаминогидролазы, плазмина и др.
Это позволяет опухолевым клеткам инвазировать базальную мембрану сосуда, прикрепляться к его эндотелию, а затем, изменяя свои адгезивные свойства (за счёт супрессии адгезивных молекул), отделяться от опухолевого пласта и эндотелия сосуда.
Следующий этап - формирование опухолевых эмболов, состоящих только из опухолевых клеток или в сочетании с тромбоцитами и лимфоцитами. Фибриновое покрытие таких эмболов может защищать опухолевые клетки от уничтожения клетками иммунной системы и действия неспецифических факторов защиты.
Заключительный этап - взаимодействие опухолевых клеток с эндотелием венул, прикрепление к базальной мембране и протеолиз её, проникновение в периваскулярную ткань и рост вторичной опухоли.
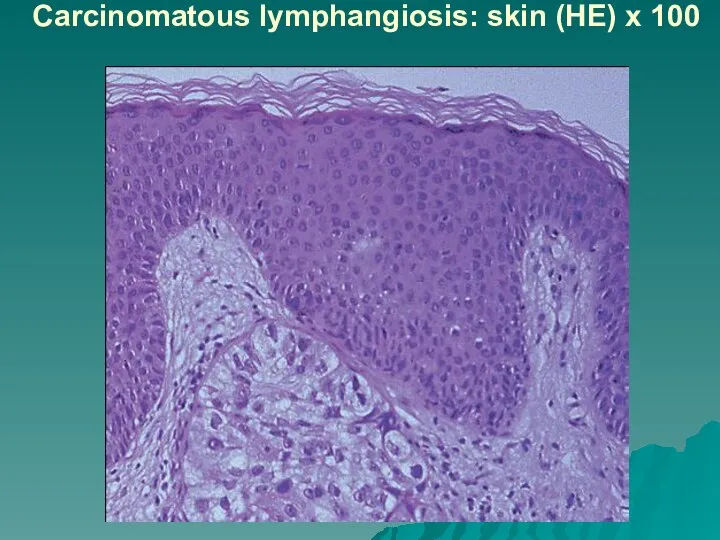
Слайд 44Carcinomatous lymphangiosis: skin (HE) x 100
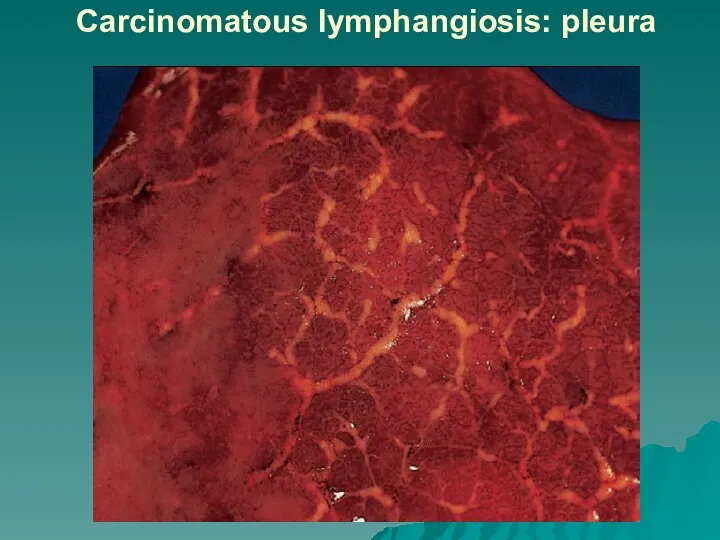
Слайд 45Carcinomatous lymphangiosis: pleura
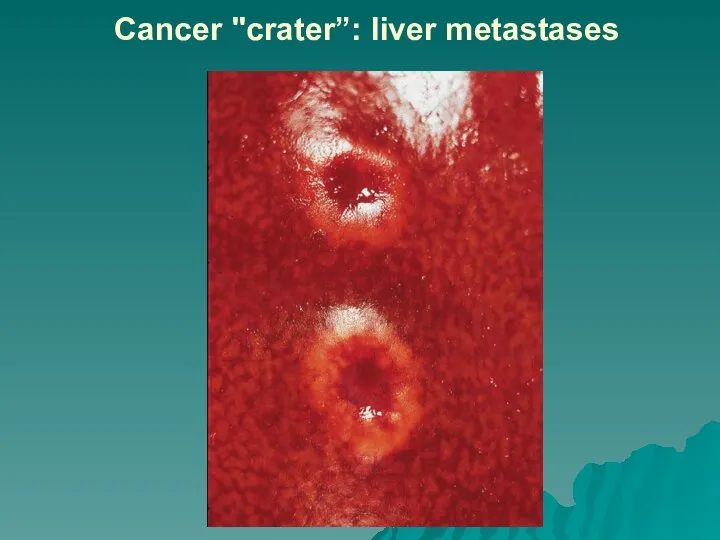
Слайд 50Cancer "crater”: liver metastases
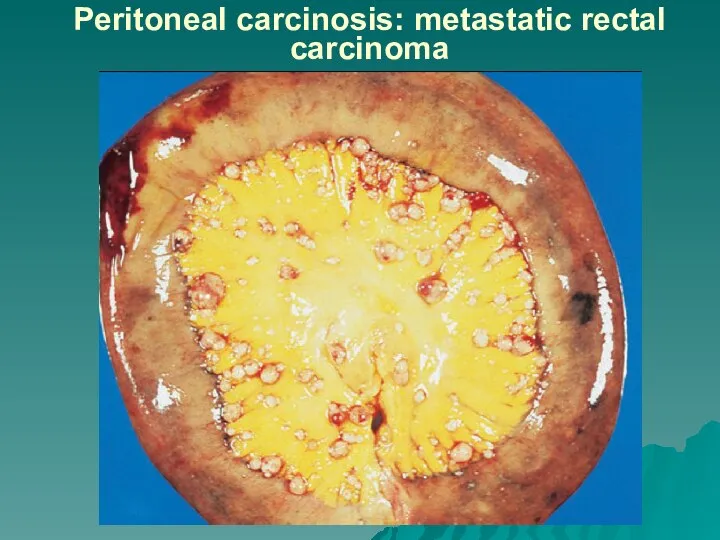
Слайд 51Peritoneal carcinosis: metastatic rectal carcinoma
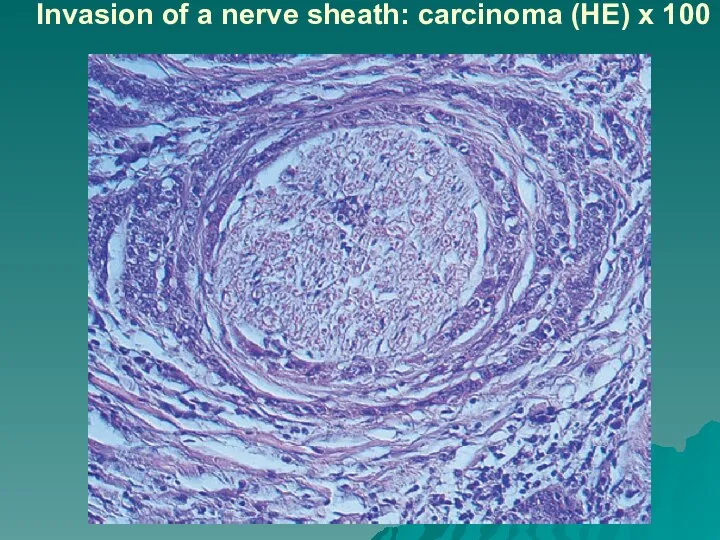
Слайд 52Invasion of a nerve sheath: carcinoma (HE) x 100
Слайд 53Морфология опухолевого роста
Опухоли состоят из паренхимы и стромы.
Паренхима опухоли - это собственно опухолевые

клетки, возникшие в результате злокачественной трансформации исходной клетки и её клональной пролиферации.
Строма в опухоли (клетки, межклеточный матрикс СТ, сосуды, нервные окончания) выполняет следующие функции:
опорную,
трофическую,
модулирующую (влияет на пролиферацию и дифференцировку опухолевых клеток, а также на возможности инвазивного роста и метастазирования).
Слайд 54Органоидные и гистиоидные опухоли
В зависимости от развитости стромы различают опухоли:
органоидные,
гистиоидные.
Органоидные опухоли имеют

паренхиму и развитую строму (напр., опухоли из эпителия). По степени развитости стромы:
медуллярный рак – редкие узкие фиброзные прослойки с сосудами капиллярного типа,
фиброзный рак (скирр) – мощные поля фиброзной ткани с едва различимыми эпителиальными опухолевыми цепочками.
Гистиоидные опухоли: строма практически отсутствует, так как представлена лишь тонкостенными капиллярами, необходимыми для питания (опухоли из соединительной ткани, хорионэпителиома).
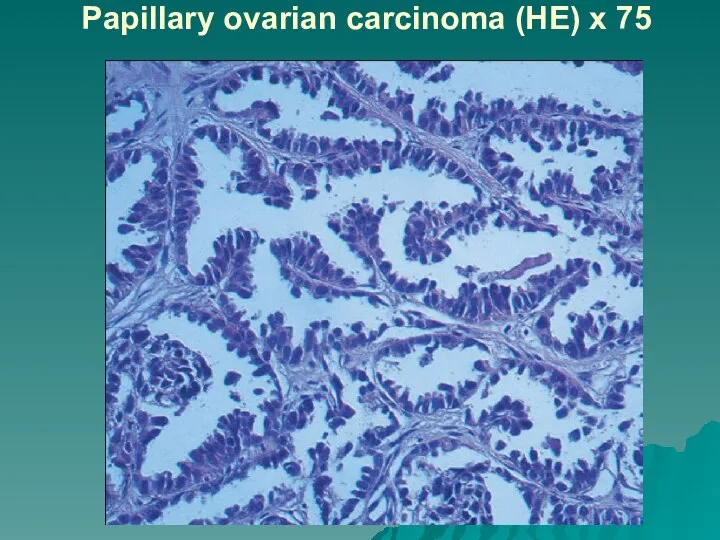
Слайд 55Papillary ovarian carcinoma (HE) x 75
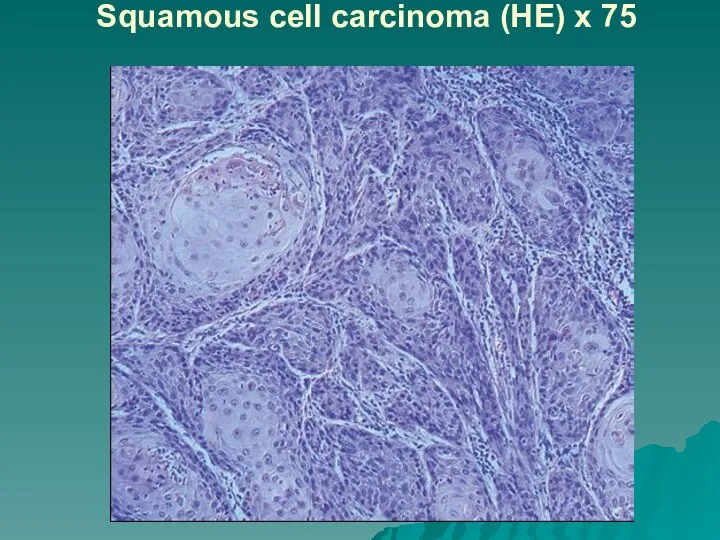
Слайд 56Squamous cell carcinoma (HE) x 75
Слайд 59Характер роста опухолей
По отношению к окружающим тканям:
экспансивный - с формированием соединительнотканной капсулы и

оттеснением прилежащих сохранных тканей;
инфильтрирующий и инвазивный - с прорастанием прилежащих тканей.
В полых органах выделяют:
экзофитный тип роста - при росте опухоли в просвет органа,
эндофитный - при росте опухоли в стенку органа,
ммешанный (экзо-эндофитный).
В зависимости от количества узлов первичной опухоли:
уницентрический рост,
мультицентрический рост.
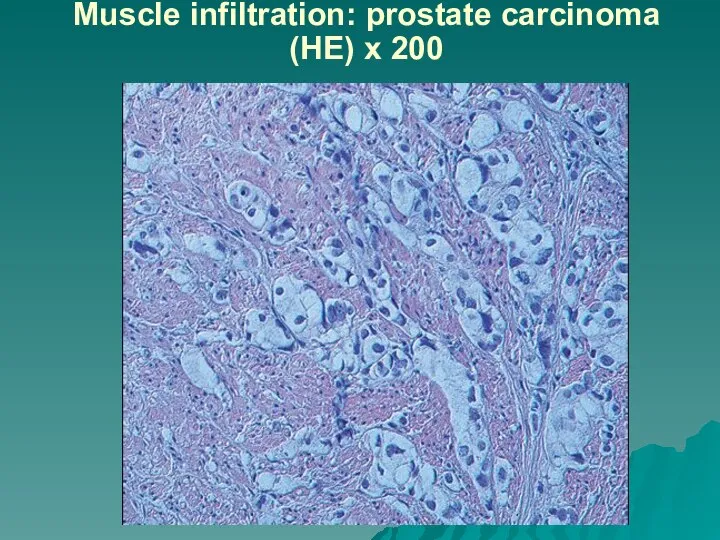
Слайд 60Muscle infiltration: prostate carcinoma
(HE) x 200
Слайд 61Взаимодействие опухоли и организма
Состоит из:
влияния опухоли на организм,
защиты организма от опухоли.
Действие

опухоли на организм хозяина:
локальное,
общее.
Слайд 62Локальное воздействие опухоли на организм:
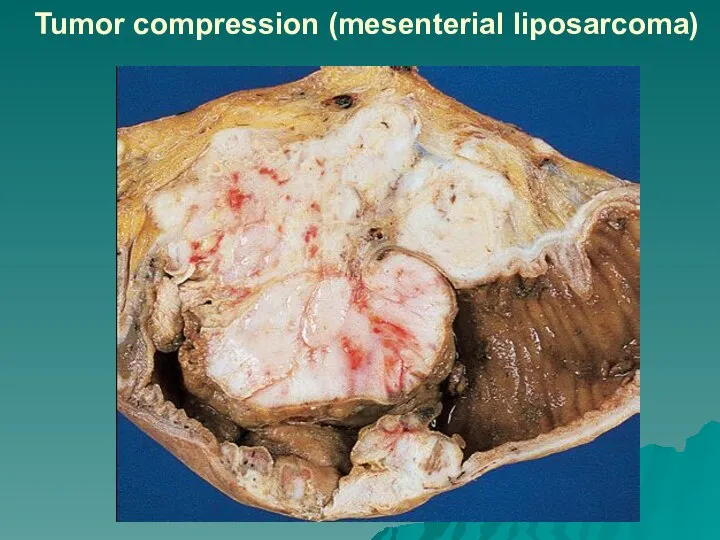
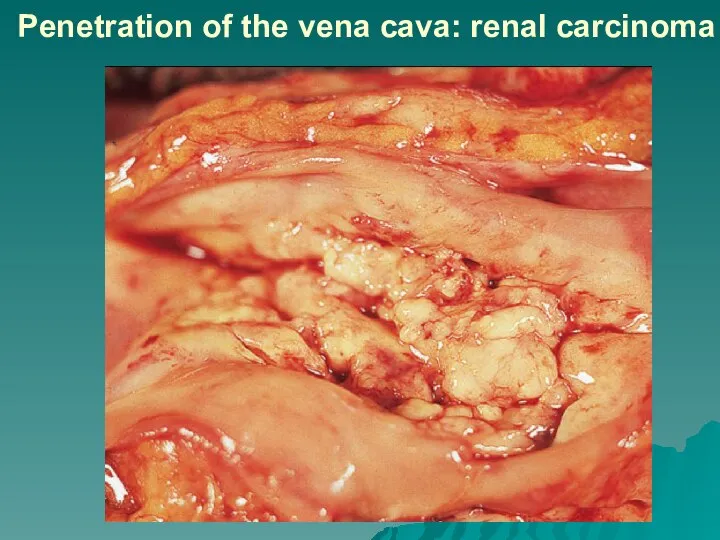
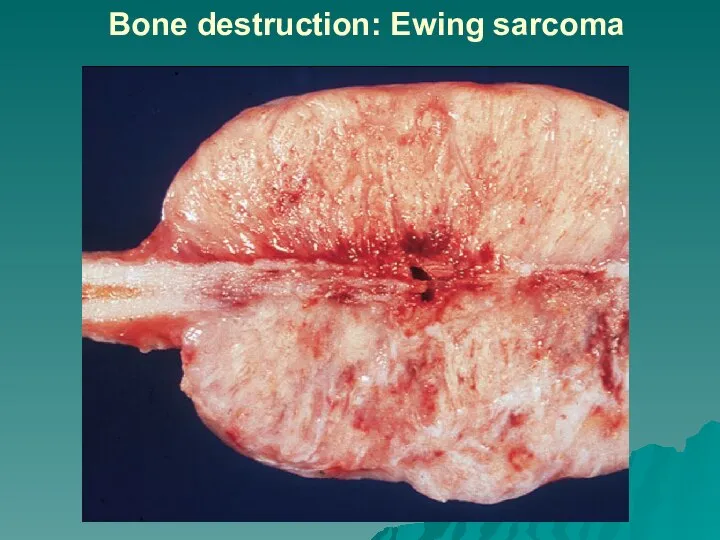
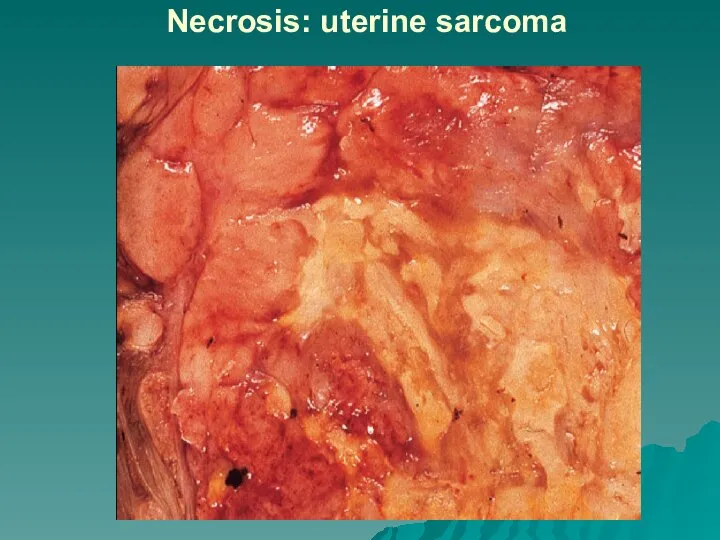
сдавление и разрушение прилежащих тканей,
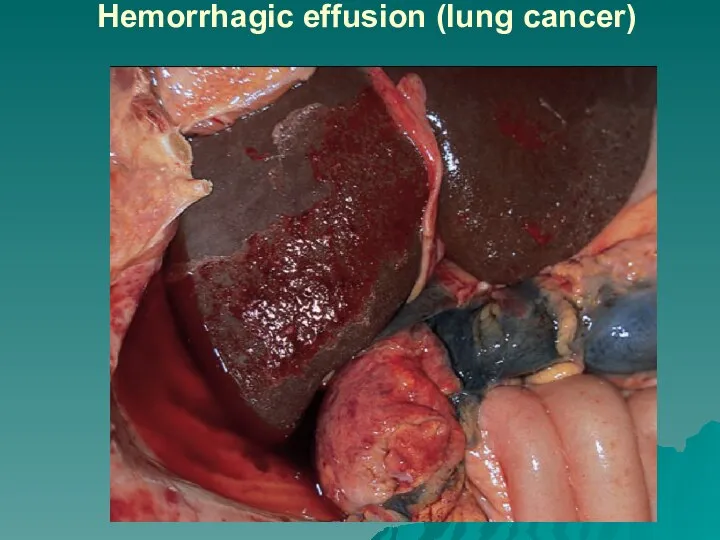
кровотечение,
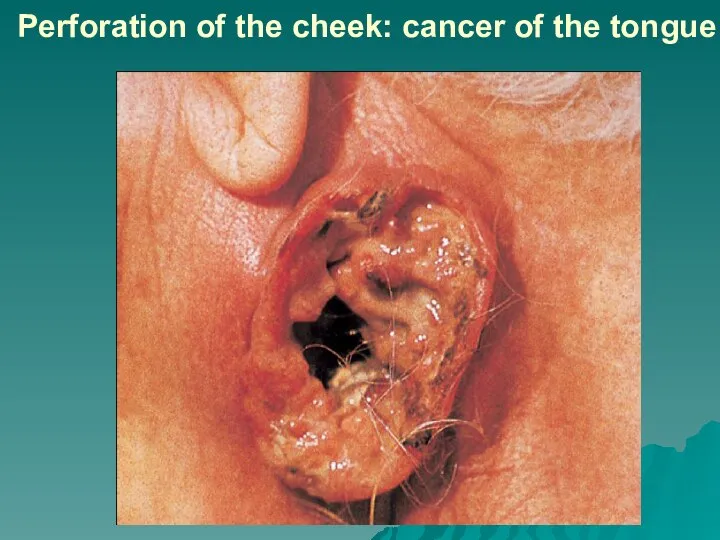
некроз и изъязвление

опухоли,
присоединение инфекции и воспаление.
Слайд 63Tumor compression (mesenterial liposarcoma)
Слайд 65Penetration of the vena cava: renal carcinoma
Слайд 68Perforation of the cheek: cancer of the tongue
Слайд 69Tissue destruction:
carcinoma of the maxillary sinus

Слайд 70Hemorrhagic effusion (lung cancer)
Слайд 71Общее воздействие опухоли на организм:
различные виды анемии,
раковая интоксикация,
раковая кахексия,
паранеопластические синдромы.

Слайд 72Классификация опухолей
Современные классификации опухолей основаны на их:
клинических проявлениях,
морфологических проявлениях.

Слайд 73Клиническая классификация TNM
Клинические критерии характеризуют стадию процесса и распространённость метастазов в организме.

Система TNM (tumour, lymph nodules, organ metastases) учитывает размеры опухоли (Т), наличие метастазов в регионарные и отдалённые лимфатические узлы (N), а также в другие органы (M).
Примеры: T1N0M0, T2N1M0, T3N2M0, T3N2Mх.
Традиционное цифровое обозначение стадий опухоли: 0 (carcinoma in situ), I, II, III, IV.
Оккультные опухоли не имеют проявлений и не диагностируются при клиническом обследовании.
Слайд 74Морфологические критерии классификации:
макроскопические,
микроскопические.

Слайд 75Макроскопические
морфологические критерии классификации:
Включают размеры и форму опухоли, а также характер её

роста.
Макроскопические варианты:
РЖ с экзофитным ростом имеет бляшковидную, полиповидную, грибовидную и блюдцеобразную формы;
РЛ с эндофитным инфильтрирующим ростом представлен узловатой, разветвлённой и узловато-разветвлённой формами.
Слайд 76Микроскопические
морфологические критерии классификации:
Включают следующие признаки:
степень зрелости опухолевых клеток (доброкачественные и злокачественные

опухоли);
гисто- и цитогенез - тканевое и клеточное происхождение опухоли (из эпителиальной, меланинообразующей, нейроэктодермальной, менингососудистой, кроветворной, лимфоидной ткани и др.);
органоспецифичность (органоспецифические и органонеспецифические);
уровень дифференцировки (высоко-, умеренно и низкодифференцированные карциномы и саркомы).
Слайд 77Гисто- и цитогенетическая
классификация опухолей
Часто гисто- и цитогенез опухоли можно определить, только

изучая препараты, окрашенные г-э.
Однако в низкодифференцированных и недифференцированных опухолях гистогенетическую принадлежность определяют только с помощью специальных методов:
ЭМ,
ИГХ,
молекулярная биология (FISH),
хромосомный анализ и др.































































 Сестринский процесс при гастритах, язвенной болезни желудка и ДПК
Сестринский процесс при гастритах, язвенной болезни желудка и ДПК Проведение антропометрии (рост, вес) ребенку до 1 года
Проведение антропометрии (рост, вес) ребенку до 1 года Сифилис
Сифилис Лечебно-оздоровительная продукция Тибета и России. Российская компания Формула жизни
Лечебно-оздоровительная продукция Тибета и России. Российская компания Формула жизни Спеціальність фармацевт
Спеціальність фармацевт Әр түрлі аурулардағы диетотерапия
Әр түрлі аурулардағы диетотерапия Drebrin controls scar formation and astrocyte reactivity upon traumatic brain injury by regulating membrane trafficking
Drebrin controls scar formation and astrocyte reactivity upon traumatic brain injury by regulating membrane trafficking Болезни печени
Болезни печени Болезни сердца
Болезни сердца Антибиотики. Ципрофлоксацины, амоксициллины
Антибиотики. Ципрофлоксацины, амоксициллины Санация полости рта
Санация полости рта ВИЧ,СПИД. Профилактика
ВИЧ,СПИД. Профилактика Контрактура жевательных мышц
Контрактура жевательных мышц Инфекциялардың табиғи ошақтарының эпидемиологиясы
Инфекциялардың табиғи ошақтарының эпидемиологиясы Проведение зоогигиенических, профилактических и ветеринарно-санитарных мероприятий
Проведение зоогигиенических, профилактических и ветеринарно-санитарных мероприятий Особенности ведения пациенток при сочетании наружного эндометриоза и миомы матки
Особенности ведения пациенток при сочетании наружного эндометриоза и миомы матки Բժշկական էթիկա եվ դեոնտոլոգիա
Բժշկական էթիկա եվ դեոնտոլոգիա Хирургические инструменты
Хирургические инструменты Заболевания пищевода. Ахалазия, эзофагопатия при ссд, варикозное расширение вен пищевода
Заболевания пищевода. Ахалазия, эзофагопатия при ссд, варикозное расширение вен пищевода Микоэкология окружающей среды
Микоэкология окружающей среды Средства, применяемые при заболеваниях пищеварительной системы
Средства, применяемые при заболеваниях пищеварительной системы Корь у детей
Корь у детей Оборудование палаты
Оборудование палаты Экдокринная система и органы иммунной защиты. Контрольные микропрепараты и электроннограммы
Экдокринная система и органы иммунной защиты. Контрольные микропрепараты и электроннограммы Лекция № 9. Учение об инфекции.ppt_
Лекция № 9. Учение об инфекции.ppt_ Витамины
Витамины Стоп ВИЧ/СПИД
Стоп ВИЧ/СПИД Пульпит, периодонтит. Лекция №3
Пульпит, периодонтит. Лекция №3