Слайд 2Определение. Этиология и патогенез. Эпидемиология.
Саркома кости – редкая злокачественная опухоль, развивающаяся

в костной системе.
К факторам риска развития сарком костей можно отнести предшествующую лучевую терапию, состояние иммунодефицита, болезнь Педжета, болезнь Олье, доброкачественные опухолевые поражения кости так же могут приводить к злокачественной трансформации. Однако, у большинства пациентов специфических этиологических факторов не выявляется.
Первичные злокачественные опухоли костей составляют 0,001% от всех впервые выявленных злокачественных новообразований. В России заболеваемость первичными злокачественными опухолями костей составляет 1,03 случая на 100 тыс. населения, что соответствует данным по заболеваемости в других странах [1].
Слайд 3Классификация опухолей опорно-двигательного аппарата. (С40.0 – С41.9).
Система стадирования первичных злокачественных опухолей кости

по TNM №7 положена в основу алгоритма выбора тактики лечения, вида операции, оценке прогноза выживаемости пациента. Стадирование сарком кости включает определение степени злокачественности опухоли, объём местного распространения опухоли, наличия отдаленных метастазов.
G-степень злокачественности (G1-2 – низкая степень злокачественности; G3-4 – высокая степень злокачественности);
Т – местная распространённость (T1 – опухоль ограничена кортикальным слоем; T2 – опухоль распространяется за кортикальный слой);
М – отдалённые метастазы (М0—без метастазов; М1 – отдалённые метастазы).
Слайд 4TNM - классификация опухолей костей (2010).
T – местная распространенность: Тх – Недостаточно

данных для оценки первичной опухоли; Т0 – Первичная опухоль не определяется; Т1 – Опухоль 8 см в наибольшем измерении; T3 – опухоль без границ в поражённой кости.
N – регионарные лимфатические узлы: Nх – Недостаточно данных для определения регионарных лимфатических узлов; N0 – Нет признаков метастатического поражения регионарных лимфатических узлов; N1 – Регионарные лимфатические узлы поражены метастазами.
M – отдаленные метастазы: Мх – Недостаточно данных для определения отдаленных метастазов; М0 – Нет признаков отдаленных метастазов; М1 – Имеются отдаленные метастазы: M1a – лёгкое; M1b – в другие отдалённые органы.
G – степень дифференцировки опухоли (определяется на основании гистологического строения опухоли, степени дифференцировки, количества митозов и спонтанных некрозов): Gх – Степень дифференцировки не может быть установлена; G1 – Высокая степень дифференцировки; G2 – Средняя степень дифференцировки; G3 – Низкая степень дифференцировки; G4 – Недифференцированные опухоли.
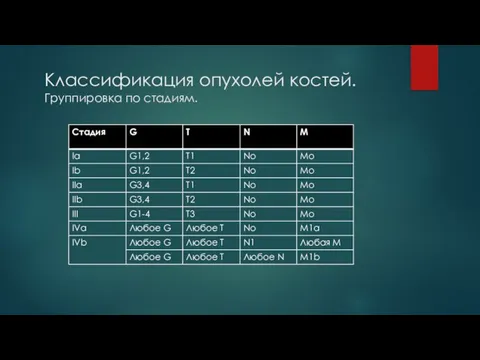
Слайд 5Классификация опухолей костей. Группировка по стадиям.
Слайд 6Физикальное обследование.
1. Рекомендуется тщательный сбор анамнеза у пациента, родителей. У пациентов

старше 40 лет необходимо исключить метастатическое поражение скелета. Уточняют начало развития заболевания, наличие болевого синдрома, изменения функции, оценивают влияние клинических проявлений на качество жизни больного.
2. Рекомендуется в случае подозрений на развитие саркомы кости, направить пациента в специализированное лечебное учреждение (онкологического профиля).
3. Рекомендуется оценить состояние области пораженной кости, проверить функцию работы сустава, исключить риск развития патологического перелома, оценить периферические лимфоузлы.
Слайд 7Инструментальное обследование.
1. Рекомендуется рентгенография пораженной области и близлежащего сустава в двух

проекциях с линейкой. Позволяет провести первичную диагностику и спрогнозировать при необходимости органосохраняющий вид реконструкции.
2. Рекомендуется ультразвуковое исследование (УЗИ) пораженной области. Позволяет оценить наличие и объем мягкотканого компонента опухоли и оценить связь опухоли с магистральными сосудами.
3. Рекомендуется сцинтиграфия костей с 99Tc. Позволяет исключить множественное поражение скелета и оценить степень накопления радиофармпрепарата в очаге поражения.
Слайд 8Инструментальное обследование.
4. Рекомендуется магнитно-резонансная томография (МРТ) пораженного отдела скелета. Позволяет оценить наличие

мягкотканого компонента опухоли, поражение мышц, вовлечение сосудов и нервов в опухолевый процесс, оценить распространенность по костномозговому каналу.
5. Рекомендуется компьютерная томография (КТ) органов грудной клетки с целью исключения патологии органов грудной клетки, в том числе метастазов.
6. Рекомендуется УЗИ органов брюшной полости, забрюшинного пространства, периферических лимфатических узлов для исключения метастазов и патологии.
7. Рекомендуется при подозрении на диссеминированную форму саркомы кости проводить расширенное обследование, которое включает: 1. Рентгенографию костей с очагами патологического накопления 99Tc; 2. Пункцию костного мозга не менее, чем из 2-х точек с последующим цитологическим исследованием (по 3 образца из каждой точки).
Слайд 9Инструментальное обследование.
8. Рекомендуется первым этапом лечения больного с подозрением на саркому

кости выполнять биопсию опухоли. Правильное проведение биопсии опухоли позволяет в короткие сроки верифицировать диагноз и начать лечение. Вне зависимости от способа проведения биопсии (трепанобиопсия или хирургический) выполнение забора материала должно производиться наименее травматично для пациента. При выборе места забора материала необходимо учитывать предполагаемый доступ последующего хирургического лечения, что позволит в дальнейшем удалить биопсийный рубец, без изменения стандартного хирургического доступа. Учитывая, что нарушение целостности кости может спровоцировать патологический перелом, биопсию внутрикостного фрагмента опухоли необходимо проводить только в случаях, когда внекостный компонент опухоли отсутствует или слабо выражен.
Слайд 10Стандарты выполнения биопсии опухоли.
1. Биопсия должна выполняться под контролем сертифицированного онкоортопеда или

радиолога;
2. Морфологическая верификация полученного биопсийного материала должна проводиться в крупных учреждениях онкологического профиля, при наличии морфолога соответствующей подготовки;
3. Предпочтительным способом получения опухолевой ткани для патоморфологического исследования является толстоигольная биопсия;
4. Проведение биопсии опухоли открытым доступом возможно: 1) при анатомически трудной локализации очага опухоли; 2) как второй этап, при отрицательном результате после проведённой трепанобиопсии, скудности и малой информативности полученного с помощью трепанобиопсии материала;
5. При выполнении биопсии опухоли открытым доступом основополагающим топографическим критерием её проведения является стандартный оперативный доступ предстоящего оперативного лечения, с учётом локализации опухоли;
6. Определение тактики дальнейшего лечения должно проводиться совместно с участием хирурга онкоортопеда, химиотерапевта и при необходимости лучевого терапевта;
7. Неправильный выбор места биопсии или нарушения техники её выполнения, ставит под угрозу адекватный локальный контроль, ограничивает выбор способа мышечной пластики, значительно повышает риск рецидива после выполнения последующей органосохранной операции.
Слайд 11Дополнительное обследование.
1. Рекомендуется консультация кардиолога и невролога. показана перед методами инструментальной

диагностики, требующими проведения наркоза и при подготовке к любым видам оперативного вмешательства.
2. Рекомендуется консультация стоматолога, оториноларинголога. Для исключения очагов инфекции с целью их санации перед высокодозной химиотерапией и по показаниям.
3. Рекомендуется проводить дифференциальную диагностику с доброкачественными и метастатическими опухолями костей, остеомиелитом, артритом и другими дегенеративно-дистрофическими изменениями суставов. Как правило, ошибочный диагноз остеомиелита, артрита и другими дегенеративно-дистрофических изменений суставов приводит к неправильной диагностике на начальном этапе, неправильному лечению и как следствие приводит к прогрессированию болезни и зачастую невозможности выполнения органосохраняющего лечения.
Слайд 12Лечение.
1. Рекомендуется выбор тактики лечения в зависимости от возраста пациента, стадии

заболевания, размера и локализации опухоли, степени дифференцировки опухоли.
2. Рекомендуется выполнение органосохранных операций для пациентов с диагнозом саркома кости. Главным условием операбельности пациентов с диагнозом саркома кости является радикальность и абластичность удаления опухоли, что гарантирует отсутствие местного рецидива.
Слайд 13Хирургическое лечение.
1. В первую очередь следует рассматривать возможность выполнения органосохранных операций. Размер

первичного очага опухоли, степень распространения внекостного компонента не могут использоваться как самостоятельные независимые критерии в решении вопроса о проведении калечащей операции.
2. Костные резекции при наличии минимального необходимого отступа от предполагаемого края опухоли не менее 3–5 см (при условии отсутствия распространения опухоли в костномозговом канале оставшейся части кости).
3. При невозможности выполнения органосохранных операций необходимо выполнение калечащих операций в радикальном объеме.
4. Рекомендуемая хирургическая тактика лечения пациентов с саркомой Юинга кости и остеосаркомой не имеет принципиальных различий и проводиться с соблюдением онкологических и ортопедических правил выполнения такого вида операций, описанных в разделе.
Слайд 14Хирургическое лечение.
Ампутация или экзартикуляция конечности выполняются в следующих случаях:
Обширное первично-множественное

распространение опухоли;
Вовлечение в опухолевый процесс магистрального сосудисто-нервного пучка, технически исключающий проведение реконструктивно-пластического этапа операции;
Прогрессирование на фоне предоперационной химиотерапии;
Отказ пациента от органосохранной операции;
Жизненные показания к экстренной хирургии – распад опухоли, кровотечения.
В специализированных центрах операции с сохранением конечности удается выполнить у 80 % больных. Широкое отступление от опухоли важно для профилактики местных рецидивов вне зависимости от опухолевого ответа.
Слайд 15Хирургическое лечение.
Рекомендуются следующие тактики лечения в зависимости от формы остеосаркомы:
Паростальная (юкстакортикальная)

остеосаркома – только радикальное хирургическое лечение (вне зависимости от степени распространения опухоли);
Периостальная остеосаркома – радикальное хирургическое лечение. В зависимости от размера первичного очага и степени распространения опухоли на консилиуме в составе хирурга-онкоортопеда и химиотерапевта принимается решение о целесообразности консервативного лечения. Применяемая химиотерапия в ряде случаев может уменьшить размеры первичного очага и метастазов опухоли, способствовать ее отграничению псевдокапсулой и перевести в резектабельное состояние;
Остеосаркома высокой степени злокачественности – проведение комбинированного лечения: блока неоадъювантной химиотерапии, радикальное хирургическое лечение, блок адъювантной химиотерапии.
Слайд 16Хирургическое лечение. Эндопротезирование.
Рекомендуется использование модульных систем эндопротезирования, что признано наиболее актуальным

и современным, отвечающим основным требованиям реконструкции костных дефектов при саркомах костей.
Выделяют следующие виды реконструктивных операций в объеме эндопротезирования:
Стандартные первичные операции у взрослых;
Стандартные первичные операции у детей и подростков;
Эндопротезирование редких анатомических зон;
Ревизионное эндопротезиование.
Слайд 17Хирургическое лечение. Эндопротезирование.
Требования, предъявляемые к конструкции эндопротеза при первичном эндопротезировании у

взрослых:
Модульность конструкции эндопротеза;
Максимальная надежность и ремонтопригодность эндопротеза;
Универсальность компонентов эндопротеза;
Максимальный срок службы;
Стабильная фиксация эндопротеза;
Хороший функциональный результат;
Короткий срок изготовления эндопротеза.
Слайд 18Хирургическое лечение. Эндопротезирование.
Особенности эндопротеза при первичном эндопротезировании у детей и подростков:

Наличие бесцементного способа фиксации эндопротеза;
Раздвижной механизм эндопротеза (инвазивный и неинвазивный).
Слайд 19Хирургическое лечение. Эндопротезирование.
Рекомендуется проведение ревизионных операций у онкологических больных, вне зависимости

от их причин, в клиниках с подготовленной командой онкоортопедов, специализированного инновационного наукоемкого оборудования, высокотехнологического хирургического инструментария. Вследствие чего этот вид хирургического лечения пациентов должен производиться в крупных специализированных стационарах онкологического профиля, где накоплен опыт и отработаны методики ревизионного эндопротезирования.
Слайд 20Хирургическое лечение. Эндопротезирование.
В современной онкоортопедии рост числа первичного эндопротезирования, успехи в

химиотерапии костных сарком приводят к ежегодному увеличению числа пациентов, требующих проведения повторных ортопедических операцией, связанных с нестабильностью или поломкой эндопротеза. Каждый ревизионный эндопротез изготавливается индивидуально.
Применение модульной системы эндопротезирования упрощает выполнение последующих ревизионных операций, увеличивает биологический резерв кости. Возможность изготовления индивидуальных компонентов эндопротеза для ревизионных операций, при развитии нестабильности позволяет, не удаляя весь эндопротез, заменить его часть.
Слайд 21Консервативное лечение.
Рекомендуется проводить комбинированное лечение больным с локализованной формой остеосаркомы, которое

включает предоперационную химиотерапию, операцию, послеоперационную химиотерапию.
Только хирургическое лечение нецелесообразно, так как у 80–90 % больных в течение 1,5 лет после операции диагностируются метастазы в легких и локальные рецидивы. Химиотерапия как часть комплексного лечения значительно улучшает 5-летнюю выживаемость у больных с локализованным процессом (с 20 % до 60 %).
Рекомендуется проводить предоперационную химиотерапию. Преимущества предоперационной химиотерапии заключаются в возможности оценки in vivo активности химиотерапевтических препаратов и облегчении выполнения операции. Обычно проводится 3–4 цикла предоперационной химиотерапии. Степень некроза опухоли после предоперационной химиотерапии – надежный независимый прогностический фактор.
Рекомендуется проводить послеоперационную химиотерапию. Послеоперационная химиотерапия определяется степенью лекарственного патоморфоза.
Слайд 22Комбинированное лечение.
С учетом высокой частоты метастазирования в кости и костный мозг.

Рекомендуемое локальное лечение (операция или лучевая терапия) должно обязательно сопровождаться комбинированной химиотерапией, т.к. при клинически локализованной форме заболевания к моменту установления диагноза 90 % больных имеют микрометастазы. Комбинация химиотерапии, операции и/или лучевой терапии повысила уровень 5-летней выживаемости с 10 % до 60 %.
Радикальная операция в тех случаях, когда она выполнима, расценивается как наилучшая возможность локального контроля.
Лучевая терапия показана при невозможности выполнения радикального оперативного вмешательства и обсуждается в тех случаях, когда при гистологическом исследовании удаленного материала определяется недостаточный лечебный патоморфоз (то есть выявляется более 10 % жизнеспособных опухолевых клеток). Нерадикальная операция с последующей лучевой терапией не более эффективна, чем только лучевая терапия. Лучевая терапия проводится в дозах 40–45 Гр при микроскопических остаточных опухолях и 50–60 Гр при наличии макроскопических изменений.
Слайд 23Реабилитация.
Рекомендуются следующие реабилитационные мероприятия:
Экзопротезирование для пациентов перенесших калечащие операции;
Проведение курсов

ранней и отсроченной реабилитации больных после органосохраняющего лечения в специализированных стационарах и центрах реабилитации.
Слайд 24Профилактика рецидов. Наблюдение.
Больным, закончившим этап комбинированного лечения, рекомендуется динамическое наблюдение каждые 3

месяца в течение первых 2 лет, далее раз в 6 месяцев до 5 лет. Обязательными процедурами являются: КТ грудной клетки, УЗИ области послеоперационного рубца.
Задачей наблюдения является раннее выявление прогрессирования заболевания с целью раннего начала химиотерапии или хирургического лечения резектабельных метастатических очагов, рецидивных опухолей, профилактика ортопедических осложнений, выявление нестабильности эндопротеза в ранних сроках.
Больным с остеосаркомой дополнительно рекомендуется рентгенография зоны костного поражения.
Больным с саркомой Юинга дополнительно рекомендуется УЗИ брюшной полости, периферических лимфоузлов.
Слайд 25Прогноз.
Единственным прогностическим фактором, имеющим значение при рецидиве, является время его возникновения: пациенты,

у которых рецидив возник позже, чем через 2 года после установки диагноза, имеют лучшие результаты.
Пациенты с метастатической формой заболевания должны получать такую же стандартизированную химиотерапию, как и больные с локализованным процессом, с соответствующим локальным воздействием на метастазы (в основном с помощью лучевой терапии).
У больных с метастазами в легкие повышение выживаемости может быть достигнуто путем резекции остаточных метастазов только после эффективной химиотерапии и тотальным облучением легкого.
Пациенты с метастазами в кости или костный мозг имеют плохой прогноз (5- летняя выживаемость менее 20 %). При наличии костных метастазов показано проведение лучевой терапии.
Применение интенсивных и высокодозных режимов химиотерапии с последующей аутологичной трансплантацией костного мозга оправдано у отдельных пациентов после тщательного обследования.
























 Профилактика ОРВИ и Гриппа
Профилактика ОРВИ и Гриппа Способы реанимации
Способы реанимации Применение методики полимеразной цепной реакции для неинвазивной пренатальной диагностики резус-фактора плода
Применение методики полимеразной цепной реакции для неинвазивной пренатальной диагностики резус-фактора плода Хвороби серцевосудинної систеим
Хвороби серцевосудинної систеим Пневмония. Бактериальная пневмония
Пневмония. Бактериальная пневмония Наследственные болезни человека
Наследственные болезни человека Медицинская сортировка, ее цели, задачи, виды и принципы
Медицинская сортировка, ее цели, задачи, виды и принципы Общие аспекты МРТ
Общие аспекты МРТ Антибиотики, антисептики, сульфаниламиды, нитрофураны, оксифинолины, хиноксалины. Лекція № 8
Антибиотики, антисептики, сульфаниламиды, нитрофураны, оксифинолины, хиноксалины. Лекція № 8 Клиника. 4 периода в клинической картине ОРДС
Клиника. 4 периода в клинической картине ОРДС Опухоль. Канцерогенные факторы
Опухоль. Канцерогенные факторы Нейсерии
Нейсерии Особенности восприятия окружающего мира слабослышащими
Особенности восприятия окружающего мира слабослышащими Эффективность реваскуляризации у пациентов со стабильной ИБС
Эффективность реваскуляризации у пациентов со стабильной ИБС Технология использования липосом для непосредственной доставки в головной мозг. Области применения данных технологий
Технология использования липосом для непосредственной доставки в головной мозг. Области применения данных технологий Функциональная анатомия черепа
Функциональная анатомия черепа Актуальные вопросы заикания. Тест
Актуальные вопросы заикания. Тест Синдром протеинурии
Синдром протеинурии Переливание крови
Переливание крови Инструкция пользователя по работе на портале непрерывного медицинского и фармацевтического образования
Инструкция пользователя по работе на портале непрерывного медицинского и фармацевтического образования Антикоагулянтная активность плазмы
Антикоагулянтная активность плазмы Ориентировочно-диагностическое значение изменений наружных покровов при воспалительных заболеваниях глаза и защитного аппарата
Ориентировочно-диагностическое значение изменений наружных покровов при воспалительных заболеваниях глаза и защитного аппарата История возникновения и формирования медицинской терминологии
История возникновения и формирования медицинской терминологии Травмы и болезни кожи. 8 класс
Травмы и болезни кожи. 8 класс Проект Я – ГОДА. Организация работы спортивно-оздоровительного клуба для пожилых с использованием комплексов ЛФК
Проект Я – ГОДА. Организация работы спортивно-оздоровительного клуба для пожилых с использованием комплексов ЛФК Обман в частных клиниках: пошаговая инструкция
Обман в частных клиниках: пошаговая инструкция Эффективность фитнес-браслетов ONETRAK в системе оздоровления студентов
Эффективность фитнес-браслетов ONETRAK в системе оздоровления студентов Исследование безопасности и поддержание эффективности монотерапии однократно-дневным Зонисамидом
Исследование безопасности и поддержание эффективности монотерапии однократно-дневным Зонисамидом