Слайд 2ВОЗ - это наблюдательная и координирующая международная организация, занимающаяся вопросами здравоохранения в

рамках системы ООН. Под фальсификацией, с учетом документов ВОЗ и Совета Европы, понимается преднамеренное снабжение фармацевтического продукта ложной маркировкой в отношении его подлинности, источника происхождения, а также несоответствие заявленных компонентов, содержащихся в препарате. Фальсификация может относиться как к фирменным, так и к воспроизведенным препаратам (дженерикам)
Слайд 3Основными документами СЕ, применяемыми в решении проблемы пресечения и предотвращения оборота фальсифицированных

лекарственных средств, являются:
1) Европейская конвенция о правах человека
2) Европейская социальная хартия
3) Европейская фармакопея
4) Конвенция о защите прав и достоинства человека в связи с применением достижений биологии и медицины
5) Конвенция о преступности в сфере компьютерной информации
6) Проект европейской конвенции о противодействии обороту фальсифицированных лекарственных средств
Слайд 4Государственный контроль качества, эффективности, безопасности лекарственных препаратов в Российской Федерации
Государственное регулирование отношений,

возникающих в сфере обращения ЛП, осуществляется согласно Федеральному закону № 61-ФЗ от 12.04.2010 г. «Об обращении лекарственных препаратов», путём государственной регистрации ЛП, лицензирования деятельности в сфере обращения ЛП, аттестации и сертификации специалистов, занятых в сфере обращения ЛП, государственного контроля производства, изготовления, качества, эффективности, безопасности ЛП федеральным органом исполнительной власти и органами исполнительной власти субъектов РФ в сфере здравоохранения.
Государственная система контроля качества (ГСКК) ЛП и ИМН - это комплекс мероприятий по обеспечению качества ЛП, ИМН, медицинской техники, биологически активных добавок, лечебно-профилактических средств и других товаров аптечного ассортимента
Слайд 5ФЗ№ 61-ФЗ от 12.04.2010 г. «Об обращении лекарственных препаратов»
Статья 57. Запрещение продажи фальсифицированных

лекарственных средств, недоброкачественных лекарственных средств, контрафактных лекарственных средств
Продажа фальсифицированных лекарственных средств, недоброкачественных лекарственных средств, контрафактных лекарственных средств запрещается
Слайд 6Основания и порядок уничтожения лекарственных средств
1. Недоброкачественные лекарственные средства, фальсифицированные лекарственные средства

подлежат изъятию из гражданского оборота и уничтожению в порядке, установленном Правительством Российской Федерации. Основанием для уничтожения лекарственных средств является решение владельца лекарственных средств, решение соответствующего уполномоченного федерального органа исполнительной власти или решение суда.
2. Контрафактные лекарственные средства подлежат изъятию из гражданского оборота и уничтожению по решению суда. Порядок уничтожения контрафактных лекарственных средств устанавливается Правительством Российской Федерации.
3. Расходы, связанные с уничтожением контрафактных лекарственных средств, недоброкачественных лекарственных средств, фальсифицированных лекарственных средств, возмещаются их владельцем.
Слайд 7В соответствии с приказом Минздрава России № 734 от 30.10.2006 г. «Об

утверждении административного регламента Федеральной службы по надзору в сфере здравоохранения и социального развития по исполнению государственной функции по организации проведения экспертизы качества, эффективности и безопасности ЛП» государственный контроль осуществляется в следующих видах: предварительный контроль качества ЛП; выборочный контроль качества ЛП; повторный выборочный контроль качества ЛП; контроль качества веществ растительного, животного и синтетического происхождения, обладающих фармакологической активностью и предназначенных для производства ЛП (субстанций); проведение периодических проверок предприятий - производителей ЛП, находящихся на территориях субъектов РФ, с целью инспектирования выпускаемых ими ЛП.
Слайд 8Нормативно-правовая база, регулирующая деятельность системы
контроля качества лекарственных препаратов
Процесс формирования нормативно-правовой базы в

системе контроля качества лекарственных препаратов в РФ проходил в несколько этапов.
Первый этап охватывает период с 1992 г. до принятия в 1998 г. Федерального закона № 86-ФЗ от 22.07. 1998 «О лекарственных средствах» и представлен в основном нормативными актами федерального органа исполнительной власти в сфере здравоохранения.
На первом этапе основной задачей была разработка базовых нормативно-правовых актов, позволяющих в условиях формирующегося рынка максимально оградить население РФ от поступления некачественных ЛП на рынок. В течение 1992-1998 гг. были разработаны нормативно-регламентирующие документы, направленные на совершенствование предрегистрационных испытаний, экспертизы и регистрации ЛП. При этом нормативная база составляла исключительно распорядительные документы Минздрава России, в которых закладывался достаточно высокий уровень требований, что обеспечило соответствующее качество допущенных к реализации на территории России ЛП. В этот период были приняты приказы Минздравмедпрома России от 25.03.94 № 53 «Об усилении контроля качества», устанавливающий порядок проведения государственного контроля качества ЛП и от 14.06.94 № 118 «Об аккредитации контрольно-аналитических лабораторий (центров контроля качества лекарственных препаратов) и сертификации лекарственных препаратов в Российской Федерации», которые стали основополагающими документами, как для федеральных, так и для региональных органов контроля качества ЛП и позволили реанимировать государственный контроль качества ЛП на территории РФ. Так, объем государственного контроля качества ЛП возрос в 1996 г. по сравнению с 1994 г. более чем на 80,0%
Слайд 9Закон «О техническом регулировании» внес существенные изменения и в систему стандартизации, которая

должна осуществляться в соответствии с принципами добровольного применения стандартов, в которых в целях добровольного многократного использования устанавливаются характеристики продукции, правила осуществления и характеристики процессов производства, эксплуатации, хранения, перевозки, реализации и утилизации, выполнения работ или оказания услуг.








 Сердечно-сосудистая система
Сердечно-сосудистая система Учение об иммунитете
Учение об иммунитете Методы исследования сердечно-сосудистой системы II
Методы исследования сердечно-сосудистой системы II Санация ротовой полости
Санация ротовой полости Кого спасают первым. Медицинские и этические дилеммы: как решить их по совести и по закону
Кого спасают первым. Медицинские и этические дилеммы: как решить их по совести и по закону Celtra Press. Клиническое образование
Celtra Press. Клиническое образование Презентация Фибрилляция
Презентация Фибрилляция Тест. Клиникалық жағдай
Тест. Клиникалық жағдай Дифференциальная диагностика артритов
Дифференциальная диагностика артритов Болезнь Шойермана-Мау
Болезнь Шойермана-Мау ppp2
ppp2 Строение нервной системы, брюшной полости и кожи. (Тема 2.4)
Строение нервной системы, брюшной полости и кожи. (Тема 2.4) Курение и болезни
Курение и болезни Операцияға дейінгі кезең
Операцияға дейінгі кезең Комплексная профилактика стоматологических заболеваний
Комплексная профилактика стоматологических заболеваний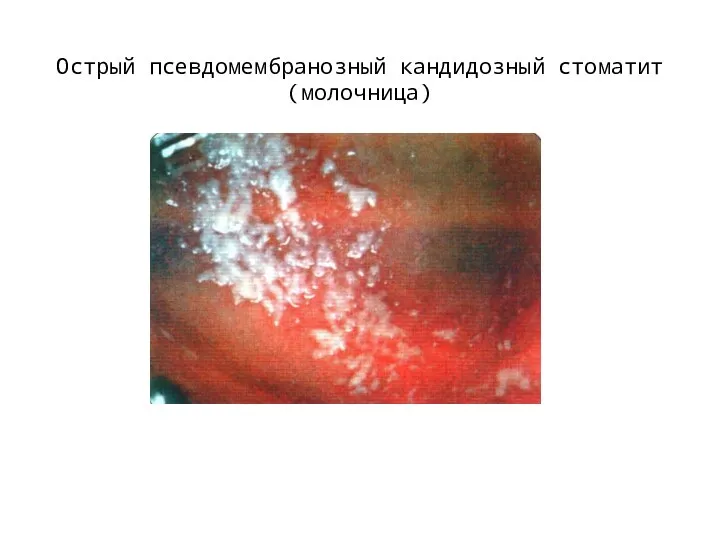 Острый псевдомембранозный кандидозный стоматит (молочница)
Острый псевдомембранозный кандидозный стоматит (молочница) Нейротрансплантация при травмах спинного мозга
Нейротрансплантация при травмах спинного мозга Уход за больным эпидемическим паротитом
Уход за больным эпидемическим паротитом Атеросклероз. Теории этиопатогенеза атеросклероза
Атеросклероз. Теории этиопатогенеза атеросклероза Gelutecministerum für medizinproduktgesetz
Gelutecministerum für medizinproduktgesetz Тактика участкового терапевта при сахарном диабете: факторы риска, раннее выявление заболевания
Тактика участкового терапевта при сахарном диабете: факторы риска, раннее выявление заболевания Ветеринарно-санитарная характеристика полуфабрикатов из мяса цыплят бройлеров
Ветеринарно-санитарная характеристика полуфабрикатов из мяса цыплят бройлеров Ветряная оспа, ветрянка
Ветряная оспа, ветрянка Питание как компонент терапии респираторных инфекций у детей, включая COVID-19. Вопросы лечебного питания при ОКИ
Питание как компонент терапии респираторных инфекций у детей, включая COVID-19. Вопросы лечебного питания при ОКИ prezentatsia_na_zaschitu_kursovoi_774
prezentatsia_na_zaschitu_kursovoi_774 Das britische Unternehmen Steeper
Das britische Unternehmen Steeper Пересадка лица
Пересадка лица Тестирование на ВИЧ представителей ключевых групп населения Томской области
Тестирование на ВИЧ представителей ключевых групп населения Томской области