Содержание
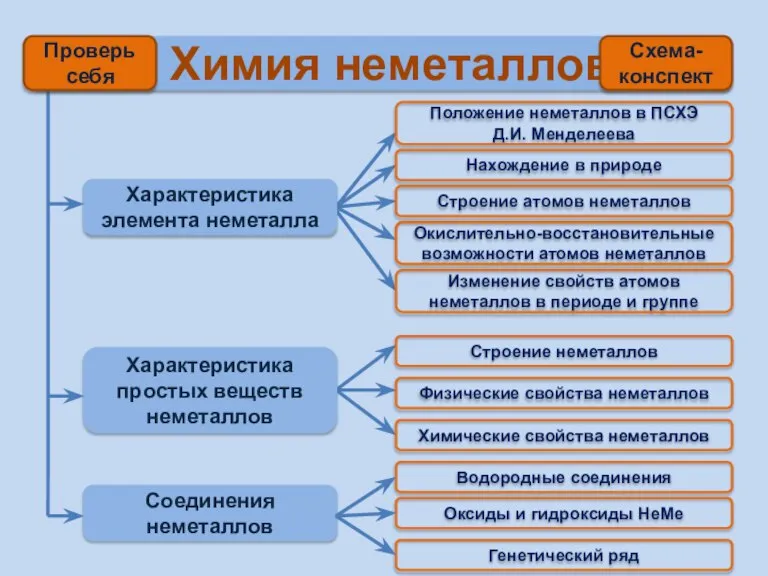
- 2. Химия неметаллов Характеристика элемента неметалла Характеристика простых веществ неметаллов Соединения неметаллов Положение неметаллов в ПСХЭ Д.И.
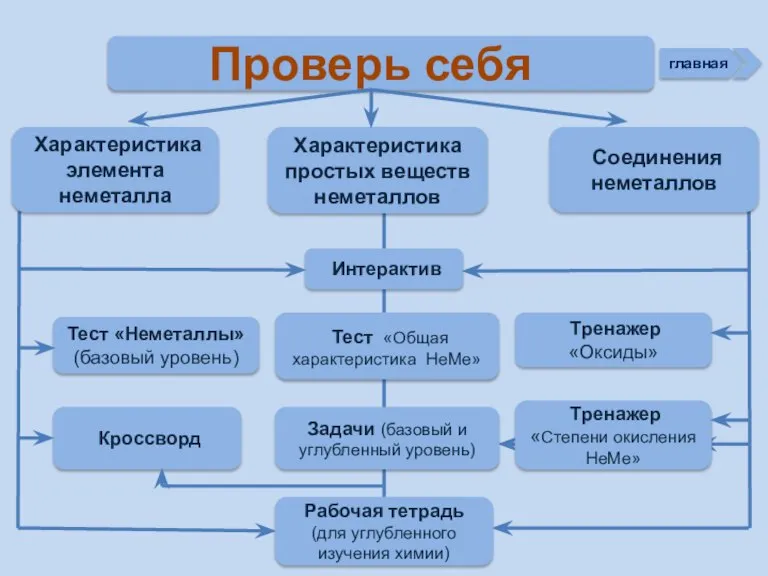
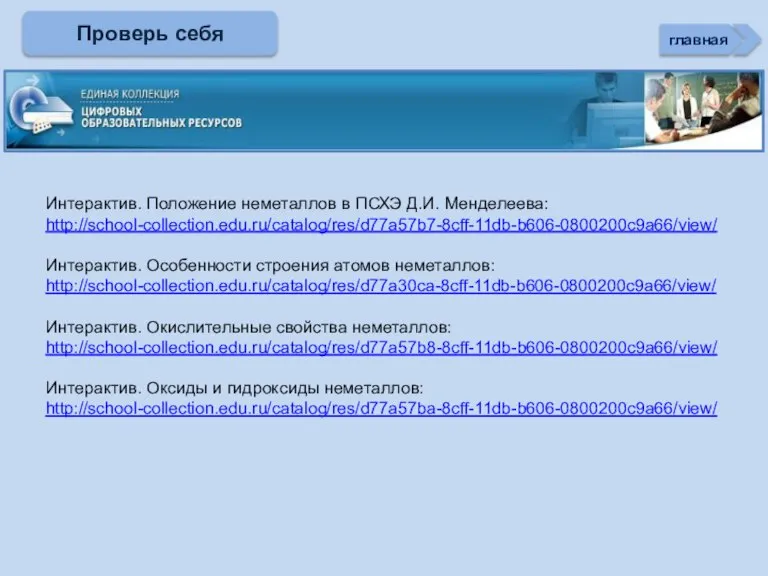
- 3. Проверь себя Характеристика простых веществ неметаллов Характеристика элемента неметалла Тест «Неметаллы» (базовый уровень) Соединения неметаллов Тренажер
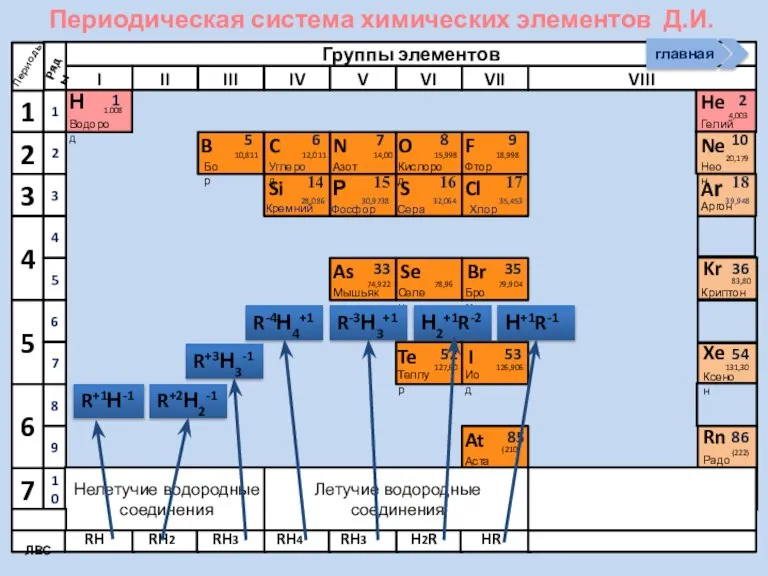
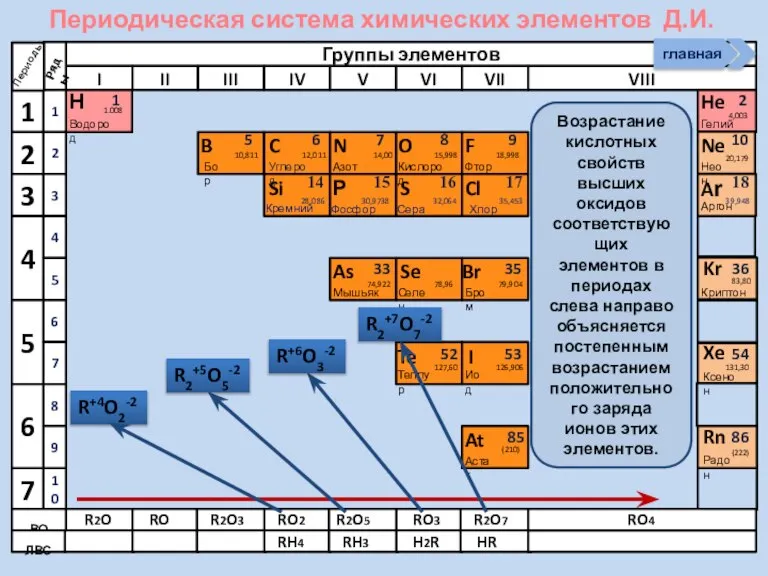
- 4. R2O RO R2O3 RO2 R2O5 RO3 R2O7 RO4 RH4 RH3 H2R HR Высшие оксиды ЛВС Положение
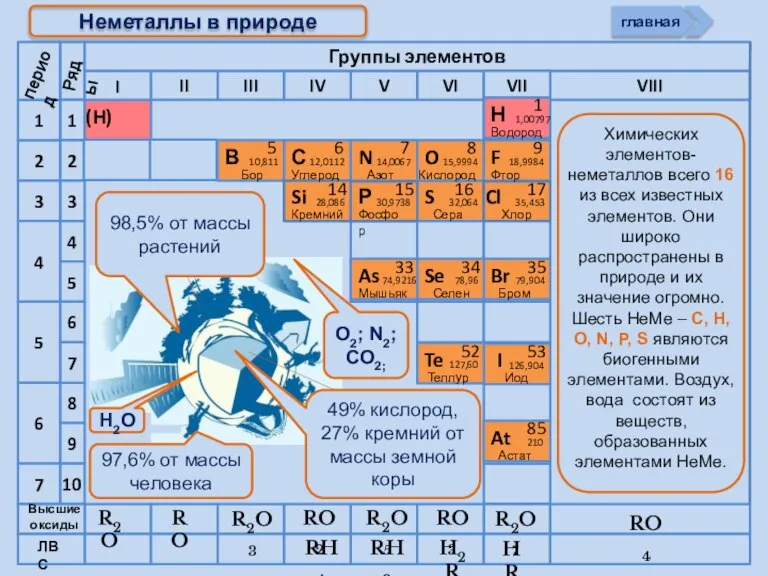
- 5. R2O RO R2O3 RO2 R2O5 RO3 R2O7 RH4 RH3 H2R HR Высшие оксиды ЛВС Неметаллы в
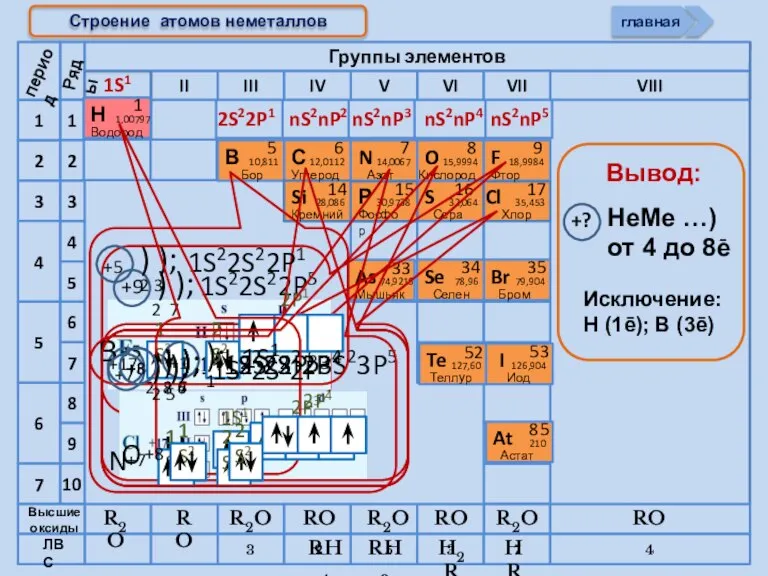
- 6. Cтроение атомов неметаллов 1S1 2S22P1 nS2nP2 nS2nP3 nS2nP4 nS2nP5 период
- 7. Окислительно-восстановительные возможности атомов неметаллов НеМе0 + (8 – n) e НеМе - (8 – n) (восстановление)
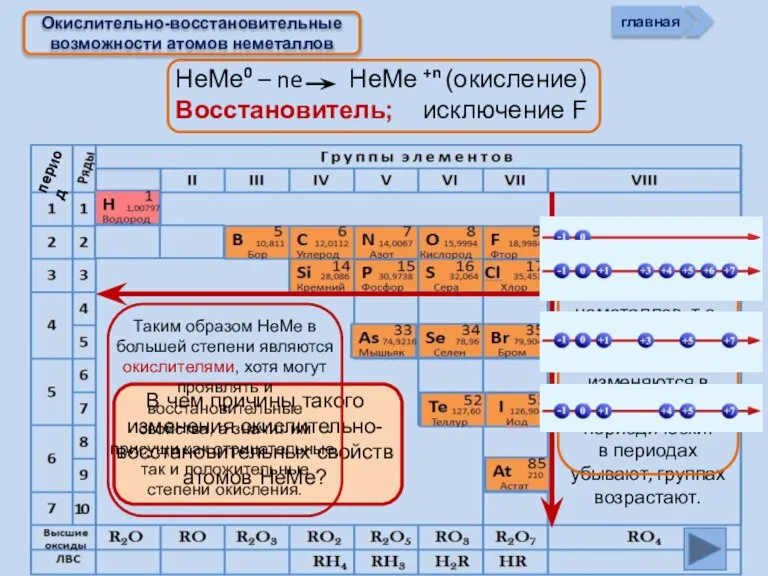
- 8. НеМе0 – ne НеМе +n (окисление) Восстановитель; исключение F Окислительно-восстановительные возможности атомов неметаллов главная период
- 9. главная период
- 10. главная период
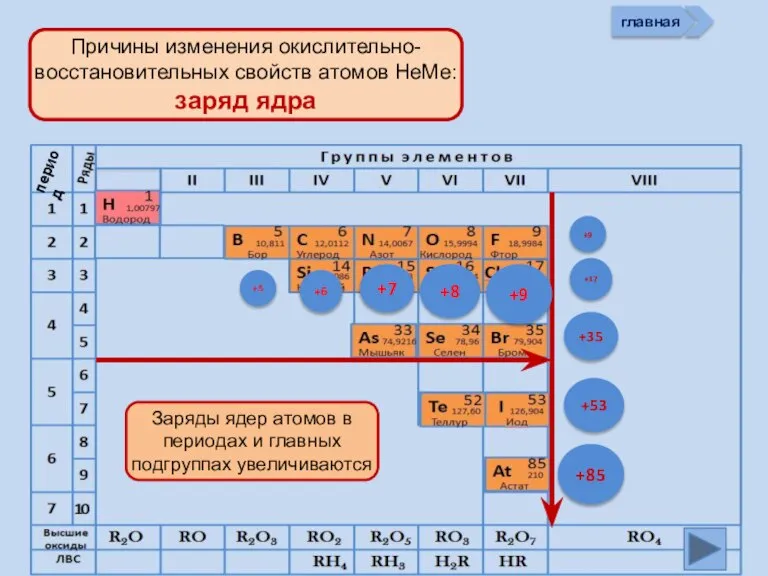
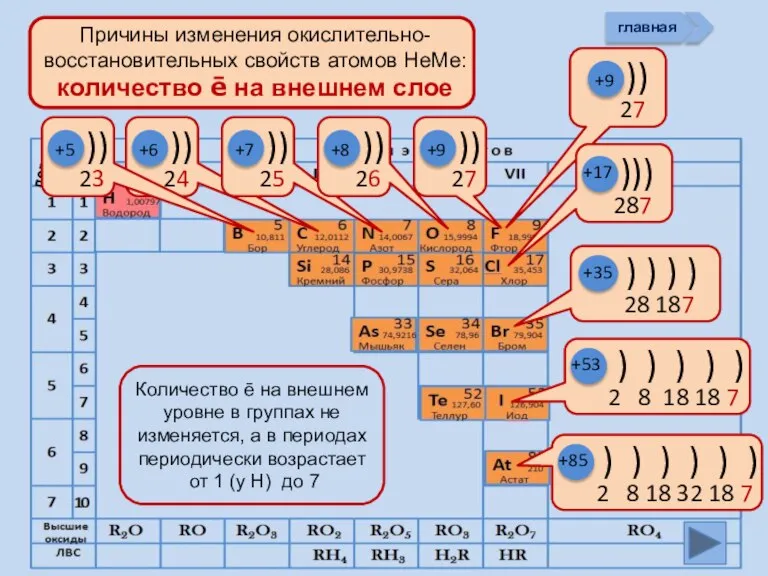
- 11. +5 +6 +7 +8 +9 +85 +17 +9 +53 +35 главная период
- 12. период
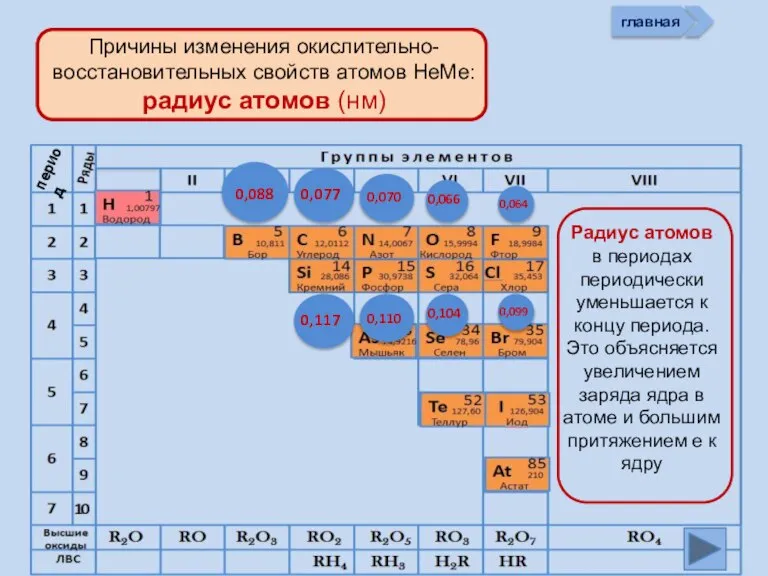
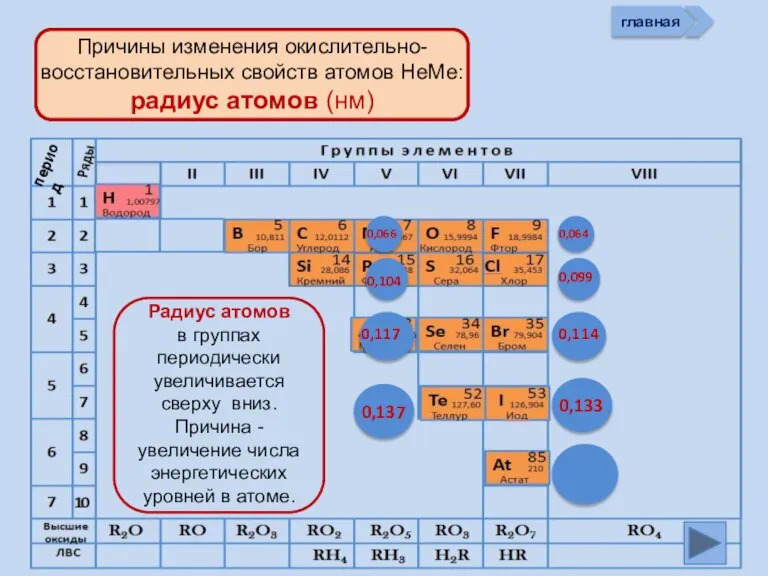
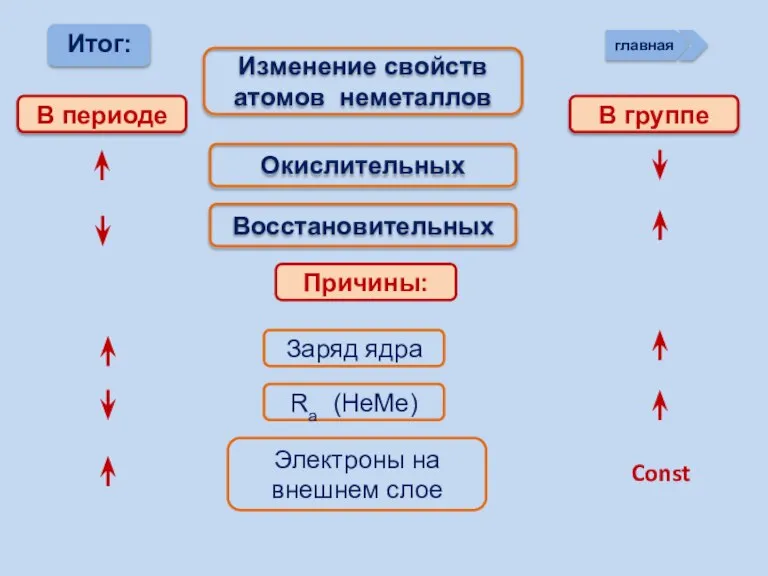
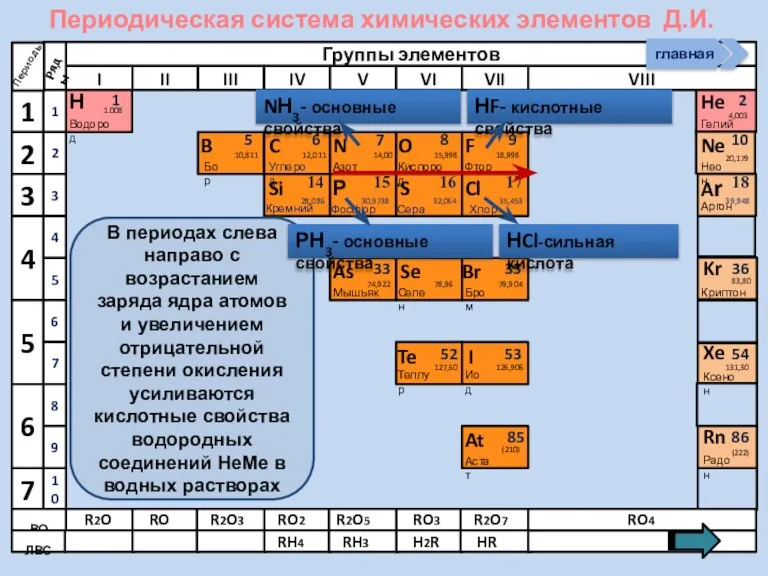
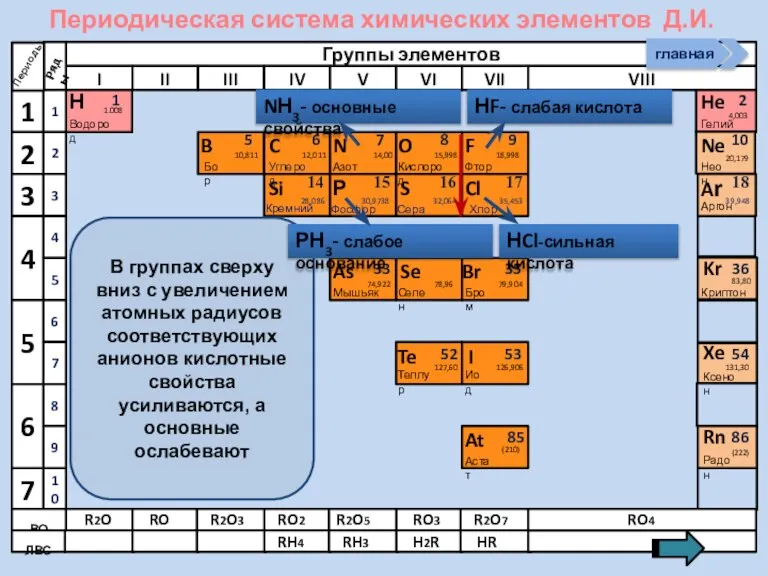
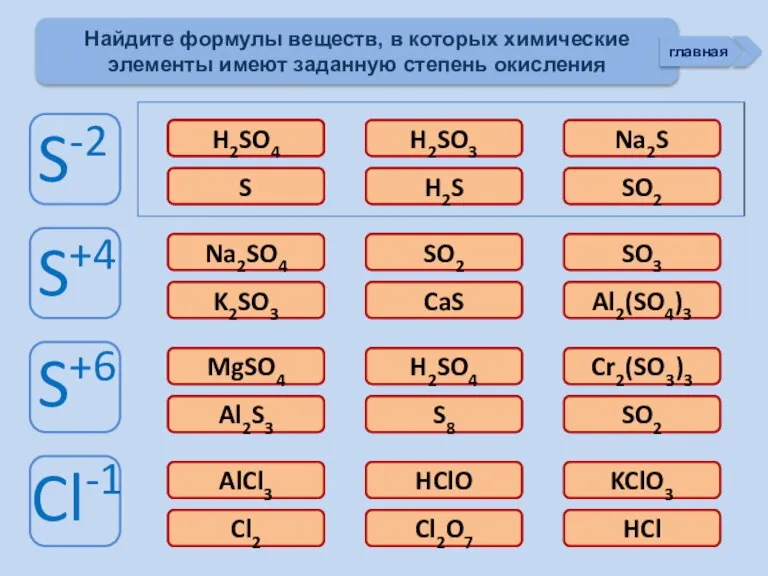
- 13. Изменение свойств атомов неметаллов В периоде В группе Окислительных Восстановительных Причины: Заряд ядра Ra (НеМе) Электроны
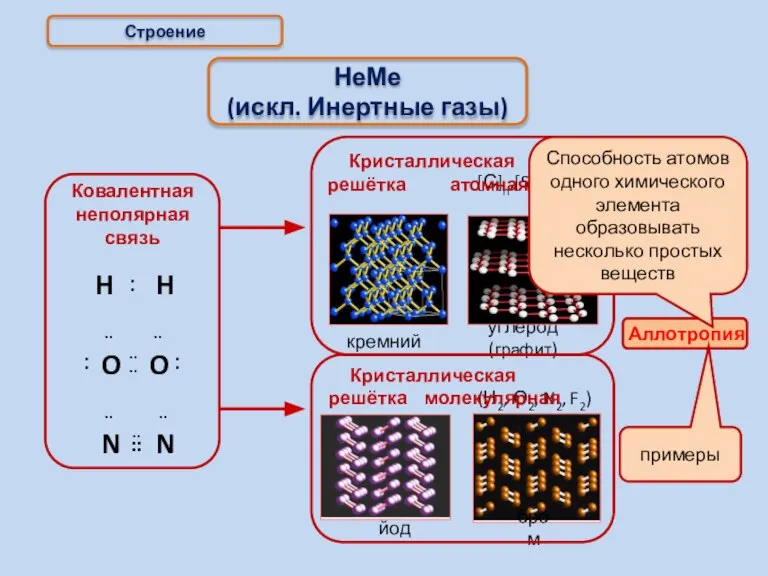
- 14. Строение НеМе (искл. Инертные газы) примеры (Н2, О2, N2, F2) йод бром Способность атомов одного химического
- 15. Аллотропия [Р]n а.кр.р. [Р]4 м.кр.р.
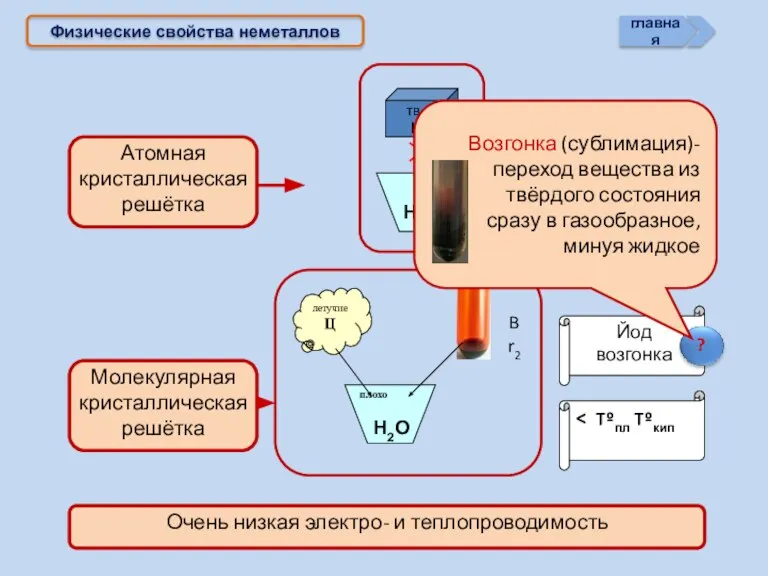
- 16. Физические свойства неметаллов > Tºпл Tºкип Йод возгонка Н2О Н2О
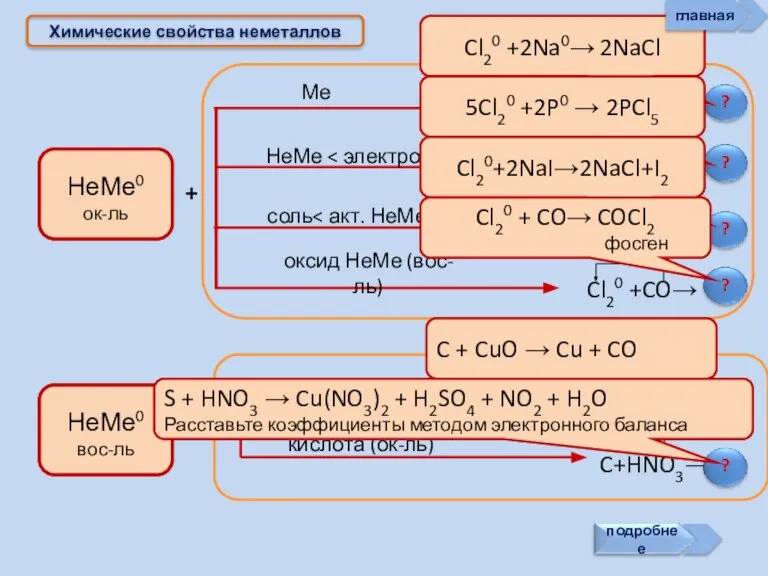
- 17. Химические свойства неметаллов + + Cl20 +2Na0→ 2NaCl 5Cl20 +2P0 → 2PCl5 Cl20+2NaI→2NaCl+I2 Cl20 + CO→
- 18. Химические свойства неметаллов Неметаллы могут: главная
- 19. ? Химические свойства неметаллов Неметаллы способны: Сl2 + Н2О = НСl + НСlO - 25 кДж.
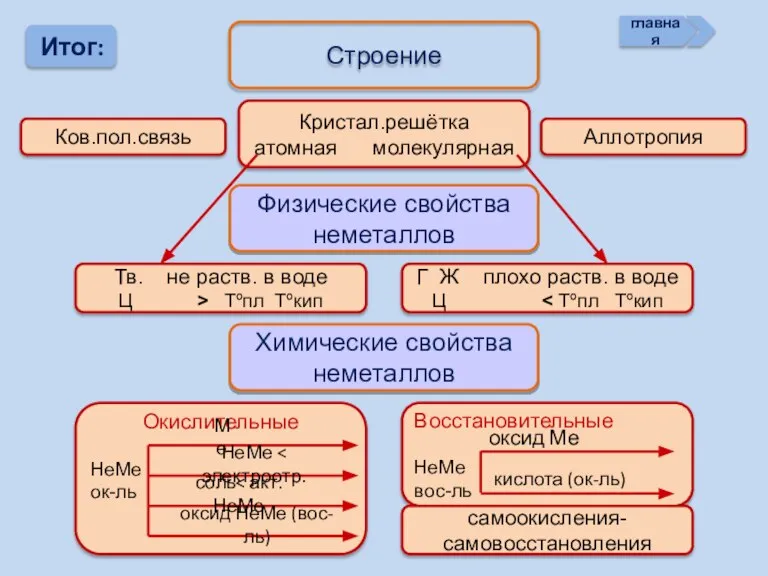
- 20. Итог: Строение Ков.пол.связь Кристал.решётка атомная молекулярная Аллотропия Физические свойства неметаллов Тв. не раств. в воде Ц
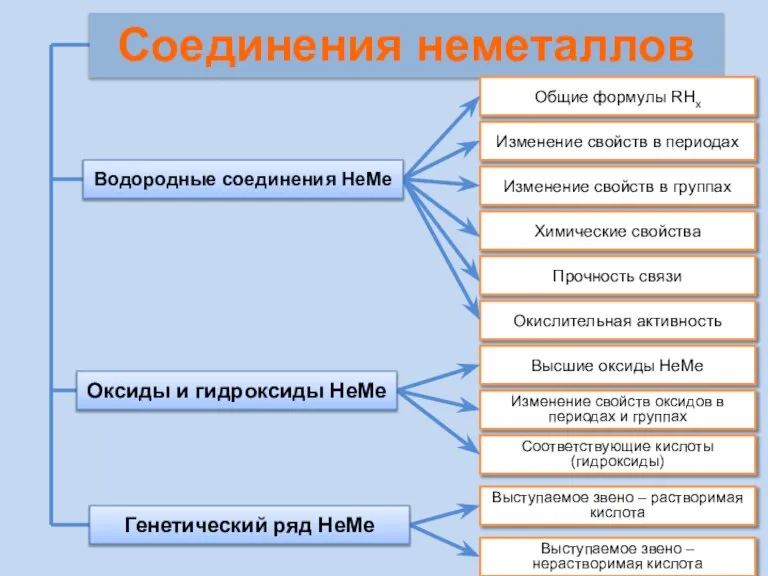
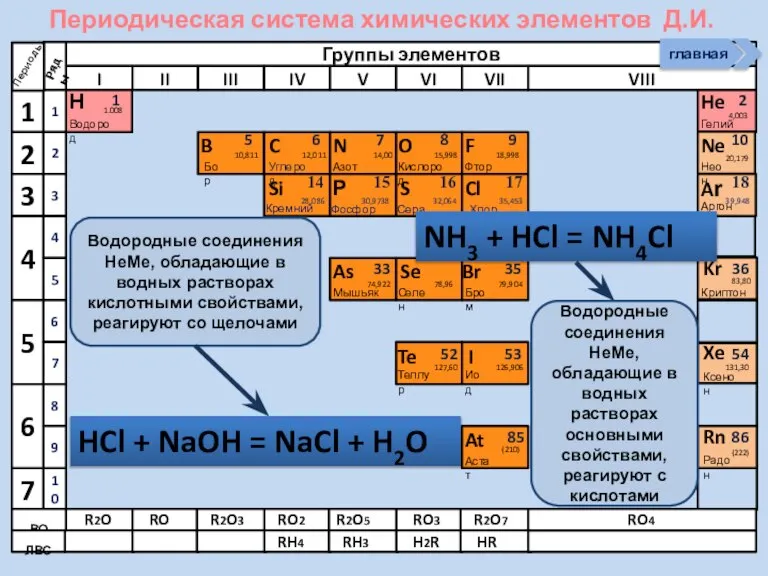
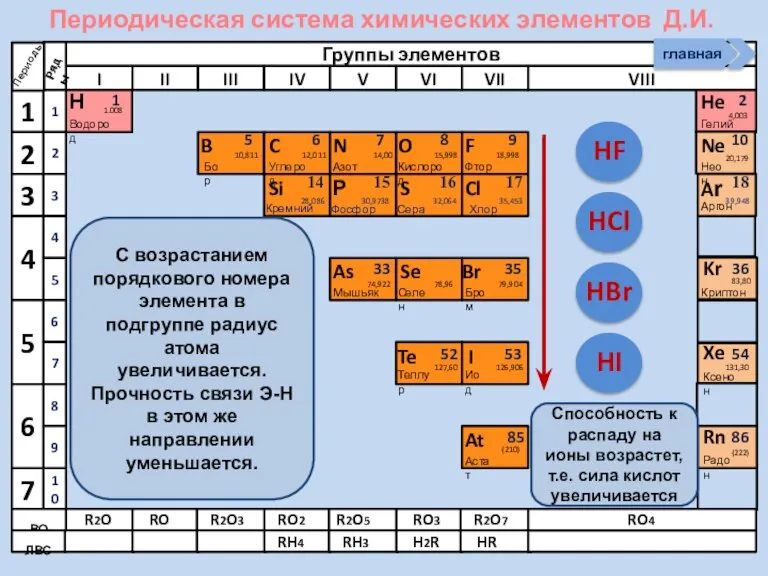
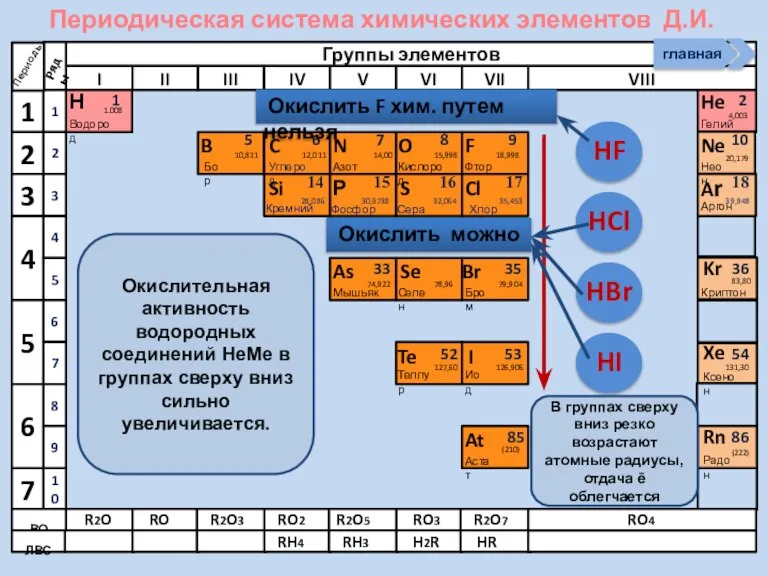
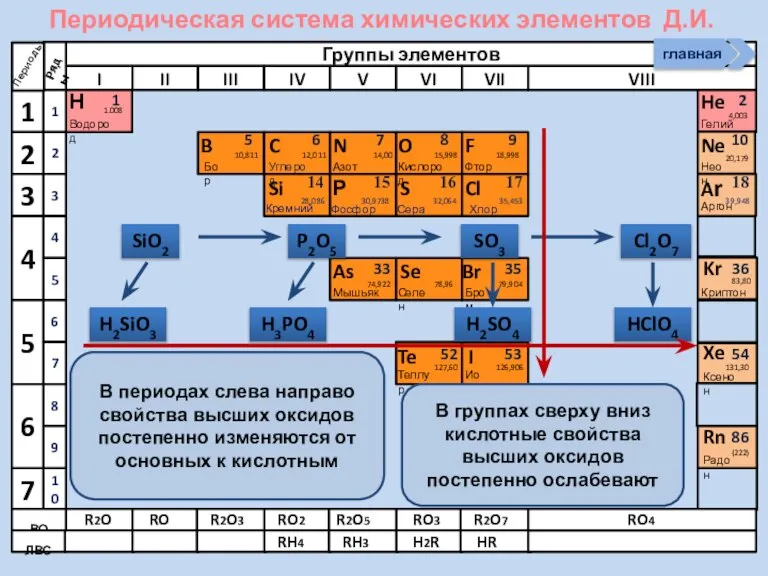
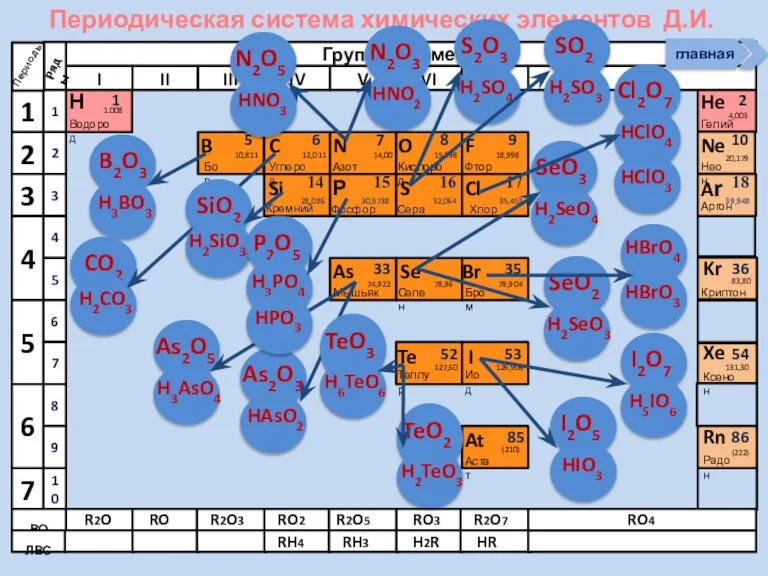
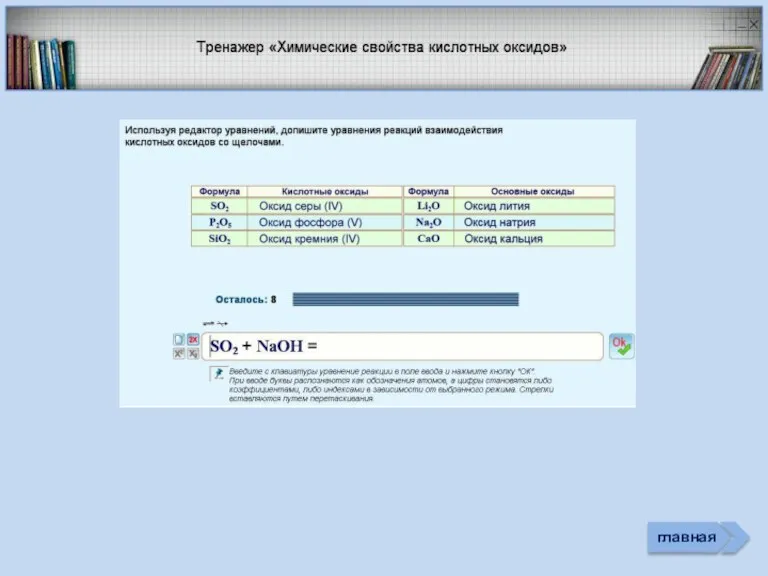
- 21. Соединения неметаллов Изменение свойств в периодах Изменение свойств в группах Общие формулы RHx Химические свойства Прочность
- 22. Периодическая система химических элементов Д.И. Менделеева Н Водород 1 1.008 Периоды B C N As He
- 23. Периодическая система химических элементов Д.И. Менделеева Н Водород 1 1.008 Периоды B C N As He
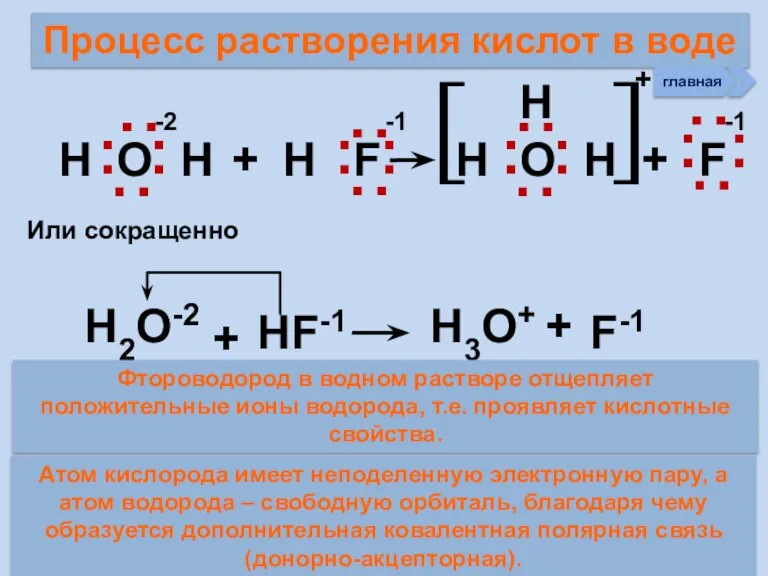
- 24. Процесс растворения кислот в воде Н О Н + Н F Н Н O Н +
- 25. Периодическая система химических элементов Д.И. Менделеева Н Водород 1 1.008 Периоды B C N As He
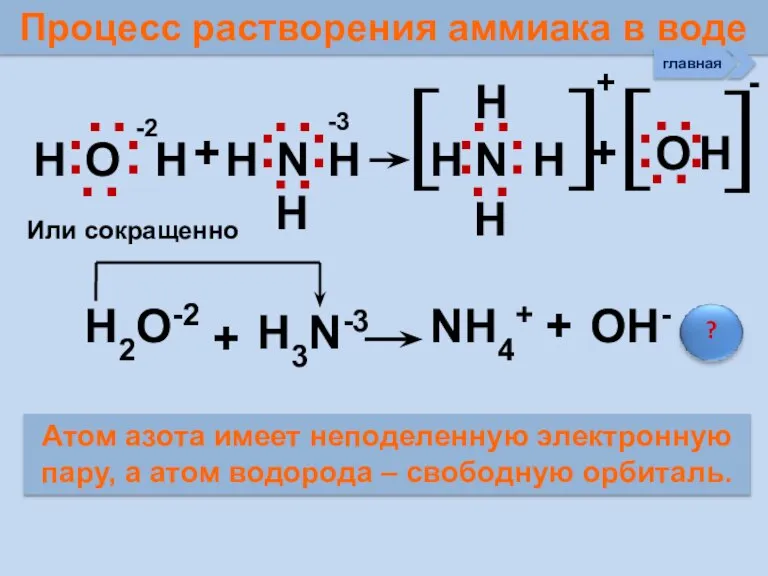
- 26. Процесс растворения аммиака в воде Н О Н + Н N Н Н N Н +
- 27. Периодическая система химических элементов Д.И. Менделеева Н Водород 1 1.008 Периоды B C N As He
- 28. Периодическая система химических элементов Д.И. Менделеева Н Водород 1 1.008 Периоды B C N As He
- 29. Периодическая система химических элементов Д.И. Менделеева Н Водород 1 1.008 Периоды B C N As He
- 30. Периодическая система химических элементов Д.И. Менделеева Н Водород 1 1.008 Периоды B C N As He
- 31. Периодическая система химических элементов Д.И. Менделеева Н Водород 1 1.008 Периоды B C N As He
- 32. Периодическая система химических элементов Д.И. Менделеева Н Водород 1 1.008 Периоды B C N As He
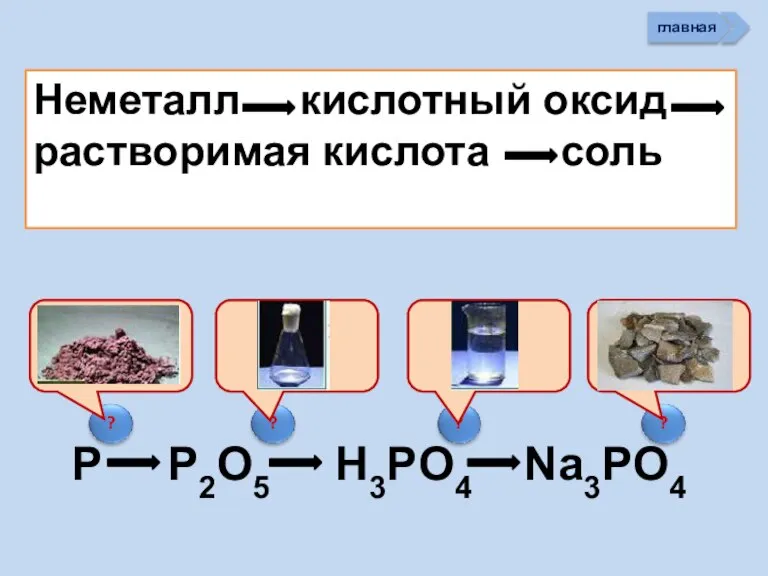
- 33. Неметалл кислотный оксид растворимая кислота cоль P P2O5 H3PO4 Na3PO4
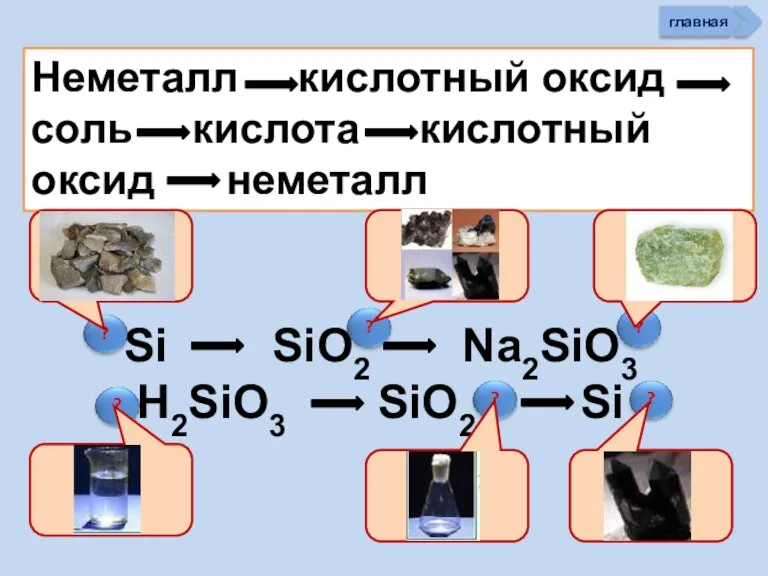
- 34. Неметалл кислотный оксид соль кислота кислотный оксид неметалл Si SiO2 Na2SiO3 H2SiO3 SiO2 Si
- 35. Интерактив. Положение неметаллов в ПСХЭ Д.И. Менделеева: http://school-collection.edu.ru/catalog/res/d77a57b7-8cff-11db-b606-0800200c9a66/view/ Интерактив. Особенности строения атомов неметаллов: http://school-collection.edu.ru/catalog/res/d77a30ca-8cff-11db-b606-0800200c9a66/view/ Интерактив. Окислительные
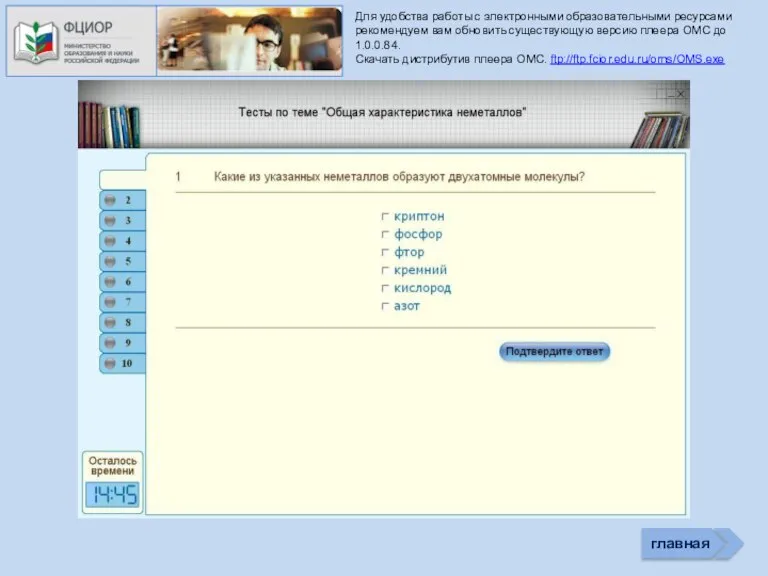
- 36. Для удобства работы с электронными образовательными ресурсами рекомендуем вам обновить существующую версию плеера ОМС до 1.0.0.84.
- 38. ошибка ошибка ошибка молодец молодец ошибка ошибка молодец молодец ошибка ошибка ошибка молодец ошибка молодец ошибка
- 41. Скачать презентацию


![Аллотропия [Р]n а.кр.р. [Р]4 м.кр.р.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/336200/slide-14.jpg)



 Проект Приоритет Семейных Ценностей в г. Риддерчасть 2
Проект Приоритет Семейных Ценностей в г. Риддерчасть 2 Общий физический практикум
Общий физический практикум НАБІР
НАБІР Конструирование фартука
Конструирование фартука Локальные и глобальные компьютерные сети
Локальные и глобальные компьютерные сети Импровизация
Импровизация УЧИСЬ БЫТЬ УСПЕШНЫМ ОРАТОРОМ
УЧИСЬ БЫТЬ УСПЕШНЫМ ОРАТОРОМ  Сулейков А.В.
Сулейков А.В. Железнодорожные перевозки по всей России!
Железнодорожные перевозки по всей России! Мастерская по ремонту мобильных телефонов«ЭЛЕКТРО»
Мастерская по ремонту мобильных телефонов«ЭЛЕКТРО» Olympic Games
Olympic Games История числа
История числа Николай Михайлович Рубцов «Берёзы». Иллюстрирование стихотворения
Николай Михайлович Рубцов «Берёзы». Иллюстрирование стихотворения 2 MegaMix Group 3 людей тратят больше времени на общение в интернете, чем в реальной жизни 57 % крупных компаний США планируют использовать
2 MegaMix Group 3 людей тратят больше времени на общение в интернете, чем в реальной жизни 57 % крупных компаний США планируют использовать  Технологический процесс приготовления блюд из птицы, песочного теста и изделий из него
Технологический процесс приготовления блюд из птицы, песочного теста и изделий из него НДС
НДС Анализ изображений на космических снимках и моделирование пространственной организации растений
Анализ изображений на космических снимках и моделирование пространственной организации растений Такси для бизнеса. Яндекс Такси
Такси для бизнеса. Яндекс Такси Силуэт
Силуэт Оценка качества сервиса в городах России
Оценка качества сервиса в городах России Определенный интеграл
Определенный интеграл Презентация на тему Художественная культура Среднего Востока
Презентация на тему Художественная культура Среднего Востока  The National Bank of Ukraine
The National Bank of Ukraine  St. Valentine’s Day
St. Valentine’s Day Введение в курс истории древнего мира
Введение в курс истории древнего мира Obs studio как незаменимый инструмент для создания видео материалов во время дистанционного обучения
Obs studio как незаменимый инструмент для создания видео материалов во время дистанционного обучения Моделирование как метод познания
Моделирование как метод познания История возникновения и развития систем счисления
История возникновения и развития систем счисления