; Cl20 ; Ca0
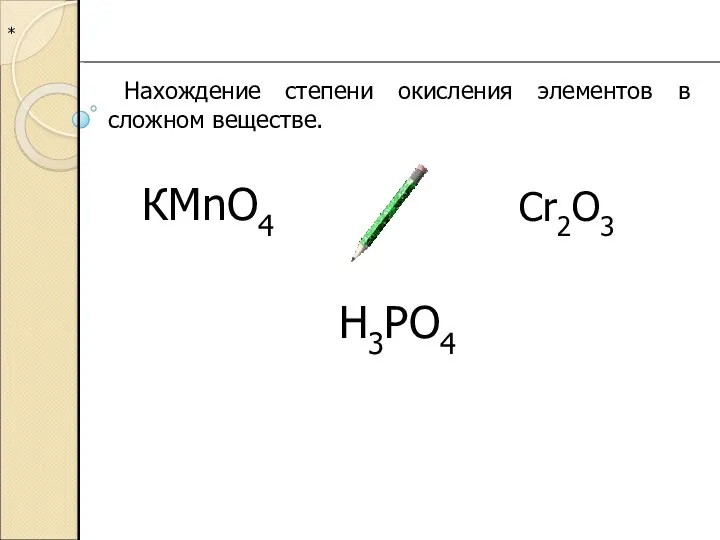
2. Степень окисления некоторых элементов в соединении:
с постоянным значением с. о.:
а) металлы всегда имеют положительное значение с. о.
У металлов главных подгрупп: I группы во всех соединениях с. о. равна +1,
II группы + 2, III группы +3
б) фтор в соединениях всегда имеет с. о.—1.
Элементы с переменным значением с. о.:
а)Все остальные металлы (кроме перечисленных выше металлов)
б)Почт вес неметаллы.
в)Кислород почти всегда имеет с. о. —2.
г)в большинстве соединений водород имеет с. о. +1, но в соединениях с металлами заряжен отрицательно, с. о. равна —
3.Степень окисления металла совпадает с его валентностью: Na+1 , NaI; K+1 , KI; Ca+2 , CaII; ;Al+3 , AlIII.
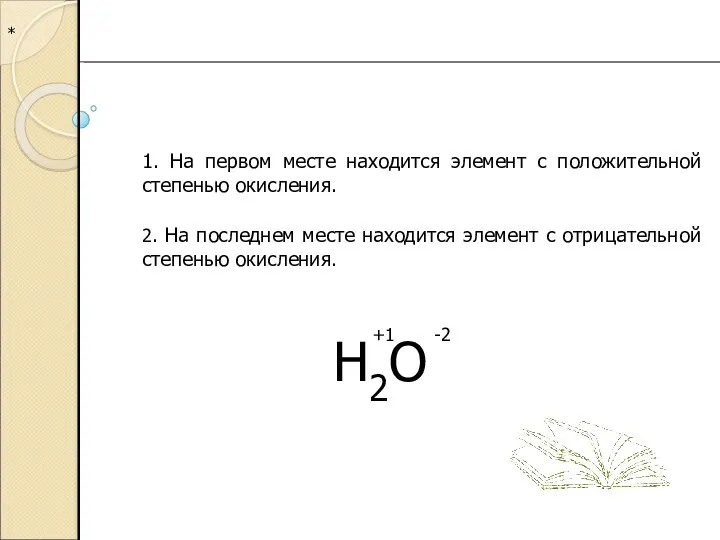
4. Сумма степеней окисления элементов в соединении, с учетом коэффициентов, равна 0.









 Диоды Ганна
Диоды Ганна Презентация на тему Молекулярная физика
Презентация на тему Молекулярная физика  Магнитное поле в веществе. (Лекция 7)
Магнитное поле в веществе. (Лекция 7) Физика – это наука понимать природу…
Физика – это наука понимать природу… Моделирование и экспериментальное исследование разрушения сферической полистироловой микрочастицы в лазерном пучке
Моделирование и экспериментальное исследование разрушения сферической полистироловой микрочастицы в лазерном пучке Эмиссия и катоды
Эмиссия и катоды Презентация на тему Магнитное поле земли
Презентация на тему Магнитное поле земли  Изучение магнитных явлений
Изучение магнитных явлений Закон сохранения импульса
Закон сохранения импульса Процесс механической обработки детали кронштейн
Процесс механической обработки детали кронштейн 04_Магнетизм и трансформатор-1
04_Магнетизм и трансформатор-1 Элементы теории фредгольмовых отображений
Элементы теории фредгольмовых отображений Закон сохранения механической энергии
Закон сохранения механической энергии Червячные передачи
Червячные передачи Тайна воды, которую мы прием
Тайна воды, которую мы прием Распределение Максвелла
Распределение Максвелла Испытательная станция на КЗ согласно требованиям UL
Испытательная станция на КЗ согласно требованиям UL Элементы машиноведения. Составные части машин
Элементы машиноведения. Составные части машин Lect_1
Lect_1 Презентация на тему Перемещение при прямолинейном равноускоренном движении (9 класс)
Презентация на тему Перемещение при прямолинейном равноускоренном движении (9 класс)  Диффузия. 7 класс
Диффузия. 7 класс Методологические основы и структура научного познания. Лекция №1
Методологические основы и структура научного познания. Лекция №1 Исследование зависимостей термодинамических величин
Исследование зависимостей термодинамических величин №1 Практикалық жұмыс. Бейтараптану реакциясының жылу эффектісін есептеу
№1 Практикалық жұмыс. Бейтараптану реакциясының жылу эффектісін есептеу Автоколебания. Транзистор. Генератор незатухающих колебаний
Автоколебания. Транзистор. Генератор незатухающих колебаний Факторы, помогающие определить какие из объектов были ближе, а какие дальше от фотоаппарата в момент съёмки
Факторы, помогающие определить какие из объектов были ближе, а какие дальше от фотоаппарата в момент съёмки Цепные ядерные реакции.
Цепные ядерные реакции. Энергия системы неподвижных точечных зарядов
Энергия системы неподвижных точечных зарядов