Содержание
- 2. Термодинамическая система Основным объектом изучения термодинамики является, термодинамическая система. Термодинамическая система – это совокупность материальных объектов,
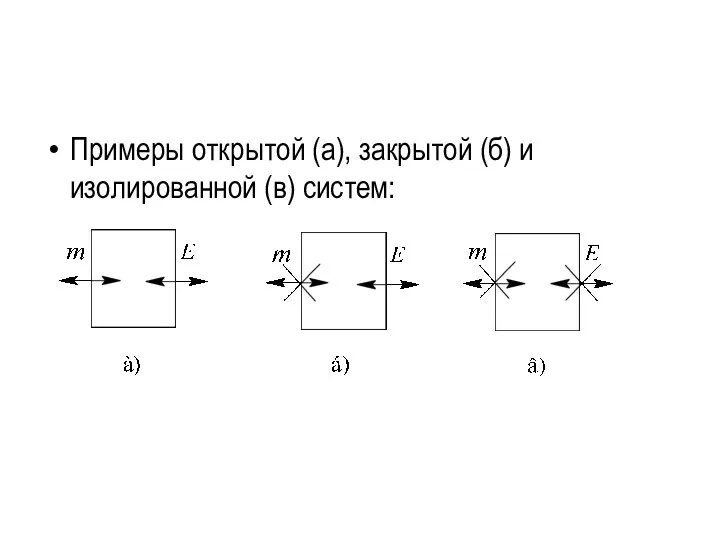
- 3. Система бывает: открытой, если через границу, разделяющую систему и внешнюю среду, может происходить обмен веществом и
- 4. Примеры открытой (а), закрытой (б) и изолированной (в) систем:
- 5. термодинамические параметры системы Состояние системы определяется термодинамическими параметрами системы. Термодинамический параметр состояния – это свойство, численное
- 6. Знать состояние системы – это значит знать численные значения ее термодинамических параметров. Многие параметры зависят друг
- 7. Параметры могут зависеть или нет от количества вещества в системе. Экстенсивные параметры зависят от количества вещества
- 8. Термодинамический процесс Термодинамический процесс – это переход системы из одного состояния в другое или это изменение
- 9. В ходе термодинамических процессов система из одного состояния переходит в другое, характеризующееся иным набором параметров. При
- 10. а) изобарическими (P = const); б) изохорическими (V = const); в) изотермическими (Т = const); г)
- 11. Если термодинамические параметры состояния системы не изменяются во времени, то такая система находится в состоянии термодинамического
- 12. 1.Термодинамически обратимые процессы Это такие процессы, которые можно провести как в прямом, так и в обратном
- 13. 2. Необратимые термодинамические процессы Необратимые термодинамические процессы в прямом направлении протекают не так, как в обратном.
- 14. Функции состояния Состояние системы и происходящие в ней изменения характеризуются функциями состояния. Функцией состояния называется такая
- 15. Bнутренняя энергия Под внутренней энергией системы (U) в термодинамике понимают ее полную энергию, которая складывается из
- 16. Поскольку не определен условный нуль для внутренней энергии, то установить можно лишь ее изменение как разность
- 17. Теплота (Q) и работа (А) – две формы обмена внутренней энергией между системой и окружающей средой
- 18. Теплота Q – неупорядоченная форма обмена энергией между системой и средой, является результатом хаотического движения микрочастиц
- 19. Работа А – это упорядоченная форма передачи энергии от системы среде или наоборот. В процессе совершения
- 20. Если теплота получена системой, она считается положительной величиной (Q > 0), а отданная системой во внешнюю
- 21. Первый закон термодинамики Первый закон термодинамики является формой выражения закона сохранения энергии: энергия не может ни
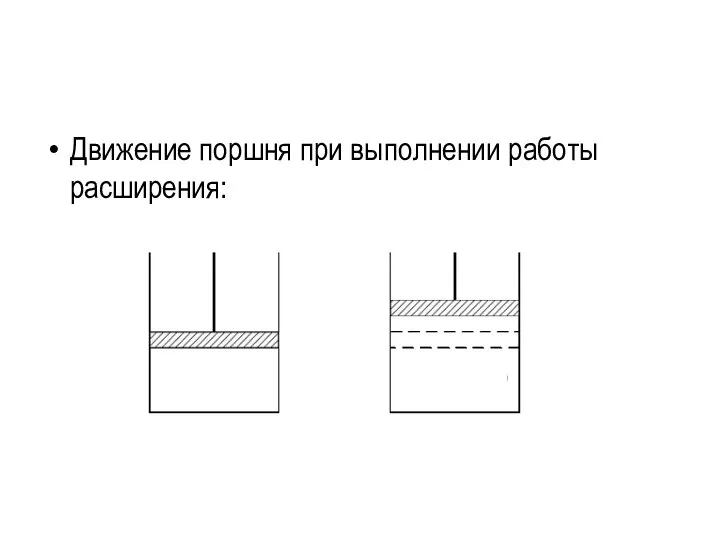
- 22. Применение первого закона термодинамики к различным процессам Изобарический процесс. Энтальпия системы и ее изменение. Работу А
- 23. Движение поршня при выполнении работы расширения:
- 24. Соответственно уравнение (1) при постоянном давлении запишется в виде: Qp = ΔU + А' + PΔV
- 25. Подставив ΔU = U2 – U1, получим: Qp = U2 – U1 + PV2 – PV1
- 26. Абсолютная энтальпия, как и абсолютная внутренняя энергия системы, не может быть определена. Характеристикой химического процесса является
- 27. В случае изобарического процесса (P = const), теплота, подведенная к системе, равна изменению энтальпии системы. Изменение
- 28. Изохорический процесс. Если система находится в изохорических условиях (V = const, ΔV = 0), то из
- 29. Изотермический процесс Т = const и ΔU = 0 Для такого процесса Q = А. Таким
- 30. Адиабатический процесс В адиабатическом процессе система не обменивается с окружающей средой энергией (Q = 0), работа
- 31. Тепловой эффект реакции обозначается ΔН. Если исходные вещества и продукты реакции находятся в стандартном состоянии, то
- 32. Условия стандартного состояния веществ
- 33. Если в результате реакции теплота выделяется, т.е. энтальпия системы понижается (ΔН Реакция, протекающая с поглощением теплоты,
- 34. Термохимическое уравнение Термохимическое уравнение – это уравнение реакции со значением теплового эффекта. Тепловой эффект реакции –
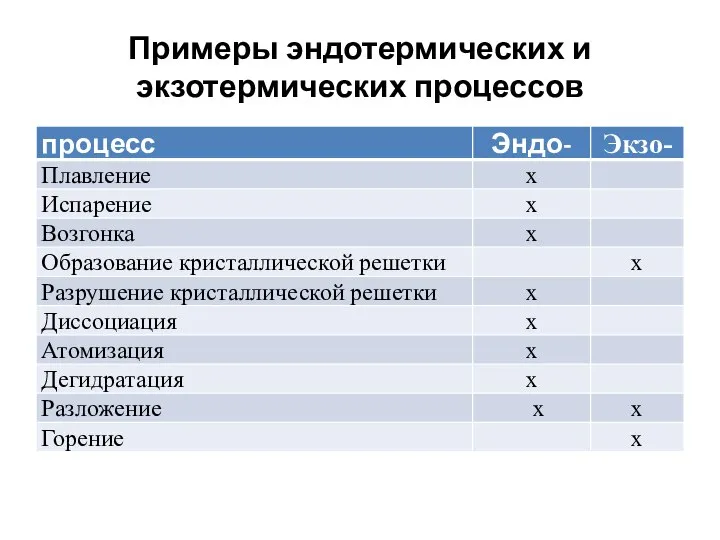
- 35. Примеры эндотермических и экзотермических процессов
- 36. Тепловой эффект реакции зависит от температуры; поэтому в индексе обычно указывается температура ΔН оT или ΔНо298
- 37. Например, тепловой эффект реакции окисления графита: (С + СО2 = 2СО) при увеличении температуры с 500
- 38. Влияние давления на тепловой эффект можно не учитывать, так как в пределах давлений, используемых в практике,
- 39. Стандартная энтальпия (теплота) образования. Тепловой эффект образования 1 моля вещества из простых веществ, устойчивых при 298
- 40. Стандартную энтальпию образования простых веществ, устойчивых при 298 К и давлении 101,325 кПа, принимают равной нулю.
- 41. Величины стандартных энтальпий образования ΔН0f,298 определены с той или иной степенью точности для большого числа веществ
- 42. Если ΔН0f,298
- 43. Стандартная молярная энтальпия сгорания вещества (ΔН0сгор., 298 ) соответствует изменению энтальпии при сгорании в кислороде 1
- 44. Стандартная энтальпия растворения – это изменение энтальпии при растворении 1 моля вещества с образованием бесконечно разбавленного
- 45. Разрушение кристаллической решетки – эндотермический процесс (ΔHореш > 0), а гидратация ионов – экзотермический (ΔHогидр
- 46. При расчете изменения энтальпий химических реакций, протекающих в растворах, используют значения стандартных энтальпий образования ионов для
- 47. Стандартная молярная энтальпия нейтрализации – изменение энтальпии при образовании 1 моля воды в результате нейтрализации каких-либо
- 48. Калориметрия Для измерения количества энергии, высвобождаемой или поглощаемой в результате химической реакции или физического превращения используют
- 49. ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ Раздел химии, изучающий тепловые эффекты химических реакций и фазовых превращений, называется термохимией. Термохимические уравнения
- 50. В термохимических уравнениях указываются агрегатные состояния и модификации исходных веществ и продуктов реакции: (СО2) + [Cграфит]
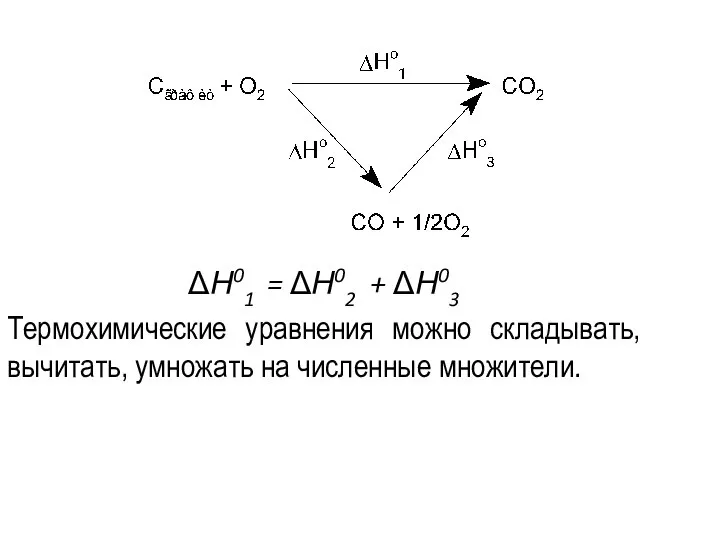
- 51. Закон Гесса Термохимические расчеты основаны на законе Гесса: тепловой эффект реакции при постоянных температуре и давлении
- 52. ΔН01 = ΔН02 + ΔН03 Термохимические уравнения можно складывать, вычитать, умножать на численные множители.
- 53. Пример 1. Вычислить теплоту образования СО, если известны тепловые эффекты реакций: Сграфит + О2 → СО2,
- 54. 1-е следствие из закона Гесса Применяют в термохимических расчетах : тепловой эффект реакции ( ) равен
- 55. При вычислении тепловых эффектов различных процессов необходимо: 1) записать соответствующий процесс, указав агрегатные состояния веществ, участвующих
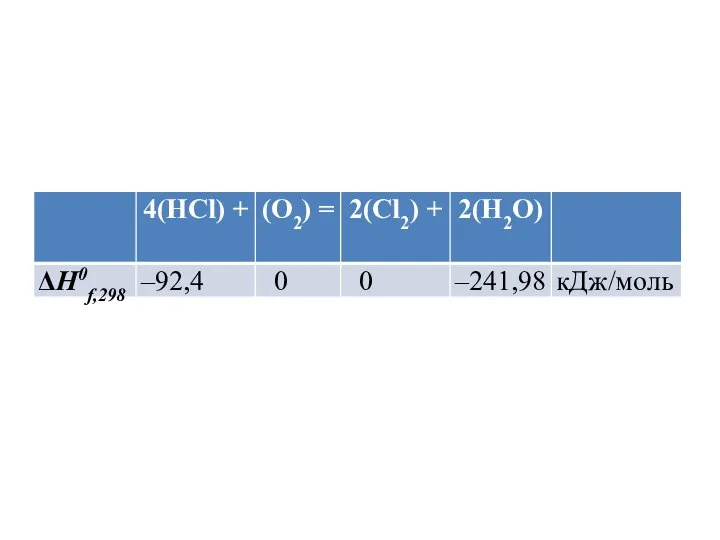
- 56. Пример 2. Рассчитать тепловой эффект (изменение энтальпии) реакции 4(HCl) + (O2) = 2(Cl2) + 2(H2O) в
- 58. 4(HCl) + (O2) = 2(Cl2) + 2(H2O) Используя следствие из закона Гесса, рассчитываем тепловой эффект реакции:
- 59. Пример 3. Рассчитать тепловой эффект процесса испарения воды. Решение. {H2O} = (H2O) ΔH0f,298 –285,84 –241,98 кДж/моль;
- 60. Пример 4. Рассчитать тепловой эффект реакции нейтрализации 1 моля соляной кислоты 1 молем гидроксида калия в
- 61. Пример 5. Рассчитать тепловой эффект растворения 1 моля нитрата калия. Решение. При растворении нитрат калия диссоциирует
- 62. Рассчитать тепловой эффект ионизации 1 моль атомов хлора. Запишем процесс ионизации хлора: Cl г + e–
- 63. Расчет энергиии связи Под энергией (энтальпией) связи А–В в молекуле АВ понимают энергию (энтальпию) разрыва 1
- 64. Под средней энергией связи А–В в молекуле АВn, понимают 1/n часть энтальпии разрыва всех связей в
- 65. 2-е следствие из закона Гесса применимо к процессам с участием органических веществ: тепловой эффект реакции равен
- 67. Скачать презентацию



























































 Применение достижений современной химии в гуманитарной сфере деятельности общества
Применение достижений современной химии в гуманитарной сфере деятельности общества Презентация на тему Теория строения органических соединений А.М. Бутлерова
Презентация на тему Теория строения органических соединений А.М. Бутлерова  Конкурс юных химиков
Конкурс юных химиков Спирты
Спирты Презентация на тему Химия вокруг нас
Презентация на тему Химия вокруг нас  Сера
Сера Химические уравнения. 8 класс
Химические уравнения. 8 класс Процестер және аппараттар курсының пәні (1 дәріс)
Процестер және аппараттар курсының пәні (1 дәріс) Оксид марганца
Оксид марганца Порядок в жидкостях
Порядок в жидкостях Полимерные материалы и изделия
Полимерные материалы и изделия Путешествие по городу химиков
Путешествие по городу химиков Чистячі засоби для ванної кімнати та кафелю
Чистячі засоби для ванної кімнати та кафелю Валентность. Порядок действий при составлении химической формулы
Валентность. Порядок действий при составлении химической формулы Дизельное топливо
Дизельное топливо bb85cf00b0d84614b17e8a6aa4be54a0
bb85cf00b0d84614b17e8a6aa4be54a0 Масс-спектрометрия – аналитический метод определения молекулярной массы свободных ионов в высоком вакууме
Масс-спектрометрия – аналитический метод определения молекулярной массы свободных ионов в высоком вакууме Окисли́тельно-восстанови́тельные реа́кции
Окисли́тельно-восстанови́тельные реа́кции Закономерности процессов тепло- и газообмена на пожаре
Закономерности процессов тепло- и газообмена на пожаре Роль химии в решении экологических проблем
Роль химии в решении экологических проблем Общая характеристика аргона
Общая характеристика аргона Что такое углеволокно (карбон) и как оно может спасти нас от нефтяного кризиса
Что такое углеволокно (карбон) и как оно может спасти нас от нефтяного кризиса Как вырастить кристалл
Как вырастить кристалл Сера и ее соединения
Сера и ее соединения Строение атома
Строение атома Көмірдің оптикалық қасиеттері
Көмірдің оптикалық қасиеттері Дисперсные системы
Дисперсные системы Вода. Классы неорганических соединений. 8 класс
Вода. Классы неорганических соединений. 8 класс