Слайд 2ЦЕЛИ УРОКА:
ОЗНАКОМИТЬСЯ С О СТРОЕНИЕМ МОЛЕКУЛЫ ВОДЫ
РАССМОТРЕТЬ ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ
РАССМОТРЕТЬ

ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ
Слайд 3СТРОЕНИЕ МОЛЕКУЛЫ ВОДЫ:
ФОРМУЛА - Н2О
2 атома водорода и 1 атом
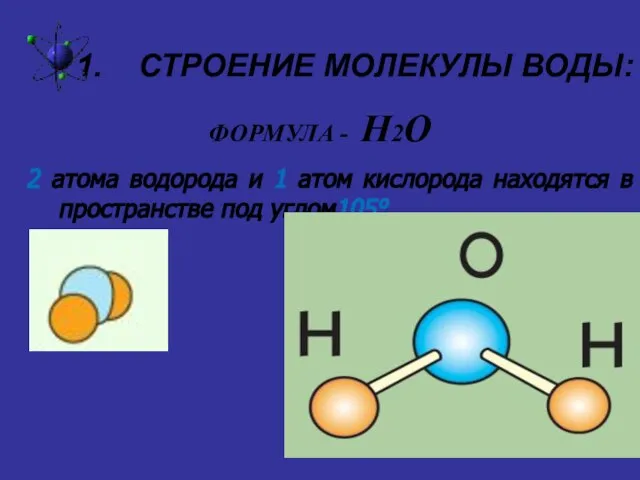
кислорода находятся в пространстве под углом105°
Слайд 52. ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ:
ЖИДКОСТЬ - БЕЗ ЦВЕТА, ВКУСА И ЗАПАХА
СУЩЕСТВУЕТ В

ТРЕХ АГРЕГАТНЫХ СОСТОЯНИЯХ
КИПИТ ПРИ 100°С
ЗАМЕРЗАЕТ (ПЛАВИТСЯ) ПРИ 0°С
ПЛОТНОСТЬ 1 Г/МЛ
ОБЛАДАЕТ САМОЙ БОЛЬШОЙ ТЕПЛОЁМКОСТЬЮ
НЕ ПРОВОДИТ ЭЛЕКТРИЧЕСКИЙ ТОК
ПЛОТНОСТЬ ЛЬДА МЕНЬШЕ ПЛОТНОСТИ ВОДЫ
УНИВЕРСАЛЬНЫЙ РАСТВОРИТЕЛЬ
Слайд 73. ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ
1. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ:
а) очень активные металлы при взаимодействии
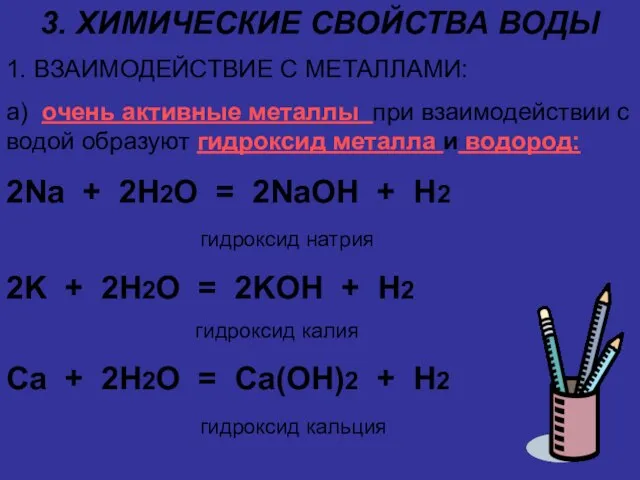
с водой образуют гидроксид металла и водород:
2Na + 2H2O = 2NaOH + H2
гидроксид натрия
2K + 2H2O = 2KOH + H2
гидроксид калия
Ca + 2H2O = Ca(OH)2 + H2
гидроксид кальция
Слайд 8Взаимодействие воды с кальцием

Слайд 9Вопрос:
Почему вода мутнеет от гидроксида кальция и не мутнеет от гидроксидов натрия,

калия и лития?
Слайд 10б) металлы средней активности взаимодействуют с водой при нагревании, образуя оксид металла

и водород:
Zn + H2O = ZnO + H2
оксид цинка
3Fe + 4H2O = Fe3O4 + 4H2
железная окалина
в) малоактивные металлы с водой
не реагируют:
Cu + H2O =
Слайд 112. ВЗАИМОДЕЙСТВИЕ ВОДЫ С ОКСИДАМИ:
а) оксиды активных металлов при взаимодействии с водой

образуют гидроксиды:
CaO + H2O = Ca(OH)2
гидроксид кальция
K2O + H2O = 2 KOH
гидроксид калия
Слайд 12Взаимодействие оксида серы (IV) с водой

Слайд 13б) оксиды неметаллов при взаимодействии с водой образуют кислоты:
SO2 + H2O

= H2SO3
cернистая кислота
SO3 + H2O = H2SO4
серная кислота
Слайд 14P2O5 + 3H2O = 2H3PO4
ортофосфорная кислота

Слайд 153. Разложение воды под действием электрического тока (электролиз):
2H2O = 2H2 ↑ +

O2 ↑
Слайд 16Рефлексия:
Я узнал, что…
Я научился…
Я понял…

Слайд 17ДОМАШНЕЕ ЗАДАНИЕ:
§ 29, упр.№ 5 (письм.) стр. 87, задача на стр.88, учить

записи в тетради.

















 Формы существования химических элементов. Формы существования химических элементов
Формы существования химических элементов. Формы существования химических элементов Валентность. Составление формул по валентности
Валентность. Составление формул по валентности Калифорний Cf
Калифорний Cf Итоговая консультация. Формульный диктант
Итоговая консультация. Формульный диктант Биологические буферные системы
Биологические буферные системы Причины многообразия веществ. 11 класс
Причины многообразия веществ. 11 класс Ионные уравнения реакций
Ионные уравнения реакций Сложные реакции
Сложные реакции Melatonin. Краткий экскурс
Melatonin. Краткий экскурс Сера. Немного истории
Сера. Немного истории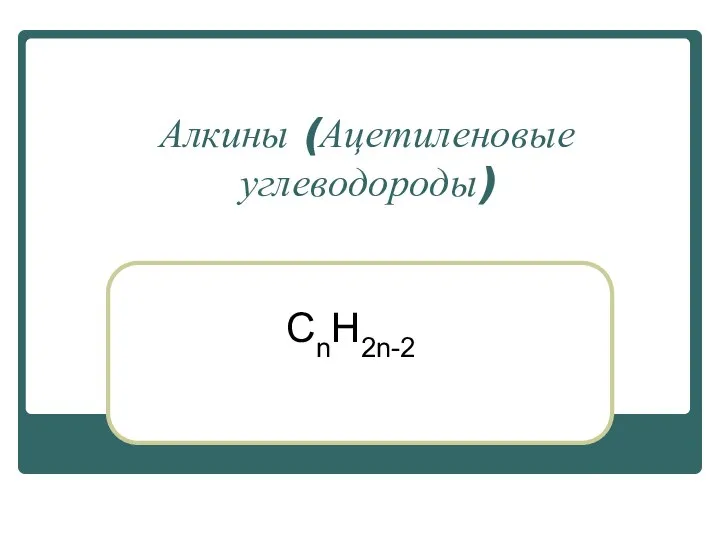 Алкины (Ацетиленовые углеводороды)
Алкины (Ацетиленовые углеводороды) Нефть
Нефть Виды химических связей
Виды химических связей Кислоты. Оксиды
Кислоты. Оксиды Растворы. 11 класс
Растворы. 11 класс Повторение классов соединений. Составление формул по названиям
Повторение классов соединений. Составление формул по названиям Основной государственный экзамен. Химия 2021. Задание 17
Основной государственный экзамен. Химия 2021. Задание 17 Составление химических формул методом нулевой суммы
Составление химических формул методом нулевой суммы Заманауи косметика биотехнологиясы
Заманауи косметика биотехнологиясы Алкены
Алкены Галогены – химические элементы
Галогены – химические элементы Уравнения диссоциации
Уравнения диссоциации Осаждение нитрида кремния
Осаждение нитрида кремния Химический состав клетки
Химический состав клетки Химически опасные объекты Аварии, связанные с выбросом АХОВ
Химически опасные объекты Аварии, связанные с выбросом АХОВ Иттрий-алюминиевый гранат и иттрий-алюминиевый перовскит
Иттрий-алюминиевый гранат и иттрий-алюминиевый перовскит Нуклеиновые кислоты
Нуклеиновые кислоты Железо – элемент побочной подгруппы YIII группы ПСХЭ Д.И.Менделеева. (по материалам ЕГЭ)
Железо – элемент побочной подгруппы YIII группы ПСХЭ Д.И.Менделеева. (по материалам ЕГЭ)