Содержание
- 2. Учебная цель: 10.2.1.5 объяснять закономерности изменения физических и химических свойств галогенов в группе
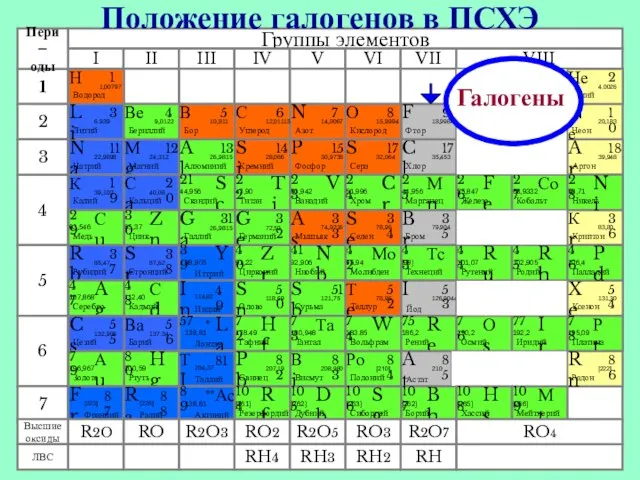
- 3. Галогены Положение галогенов в ПСХЭ
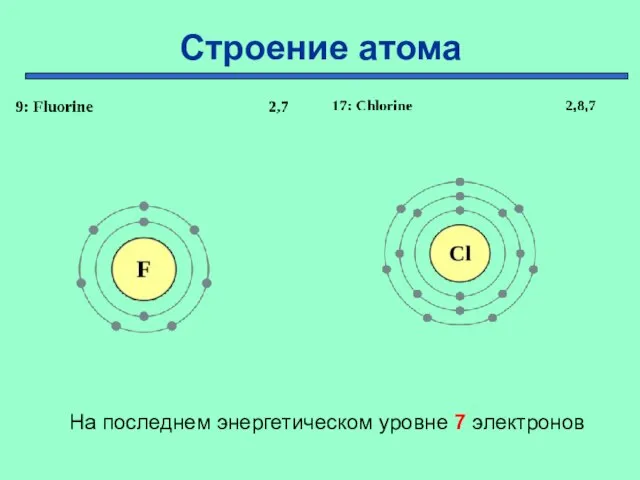
- 4. Строение атома На последнем энергетическом уровне 7 электронов
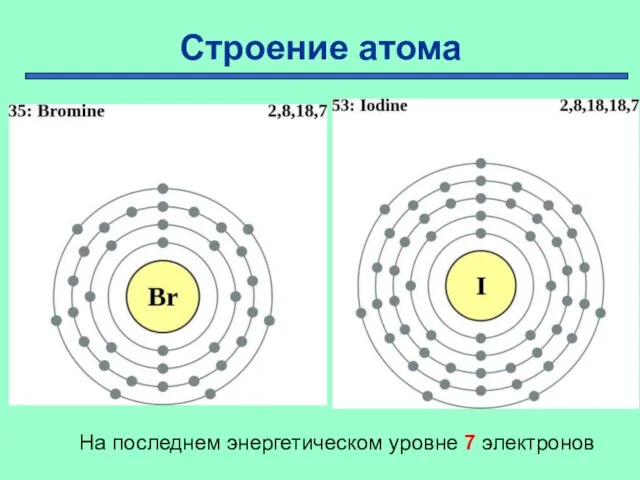
- 5. Строение атома На последнем энергетическом уровне 7 электронов
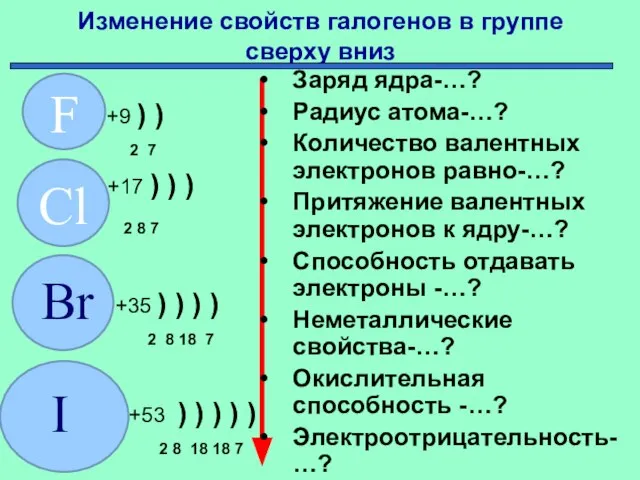
- 6. Изменение свойств галогенов в группе сверху вниз +9 ) ) 2 7 +17 ) ) )
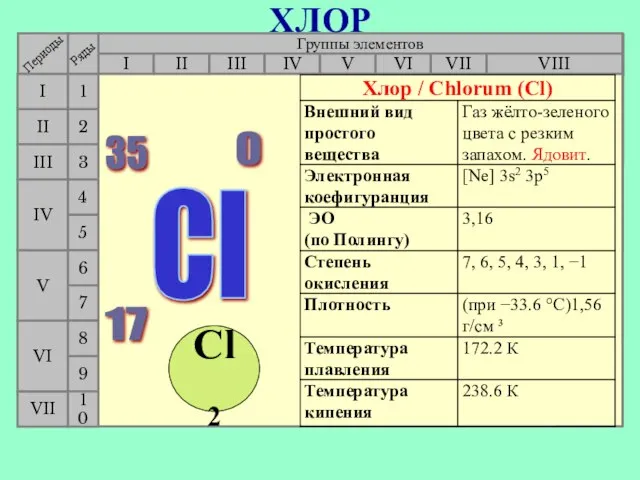
- 7. ФТОР Группы элементов I III II VIII IV V VI VII II I III VII VI
- 8. Группы элементов I III II VIII IV V VI VII II I III VII VI V
- 9. Группы элементов I III II VIII IV V VI VII II I III VII VI V
- 10. Группы элементов I III II VIII IV V VI VII II I III VII VI V
- 11. Группы элементов I III II VIII IV V VI VII II I III VII VI V
- 12. Галогены
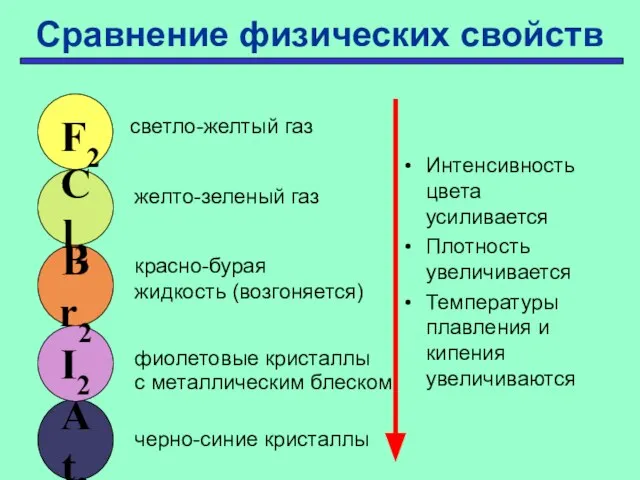
- 13. Сравнение физических свойств Интенсивность цвета усиливается Плотность увеличивается Температуры плавления и кипения увеличиваются At2 I2 Br2
- 14. Возгонка йода Кристаллический йод обладает способностью при нагревании переходить из твердого состояния в газообразное, минуя жидкое
- 15. Химические свойства галогенов
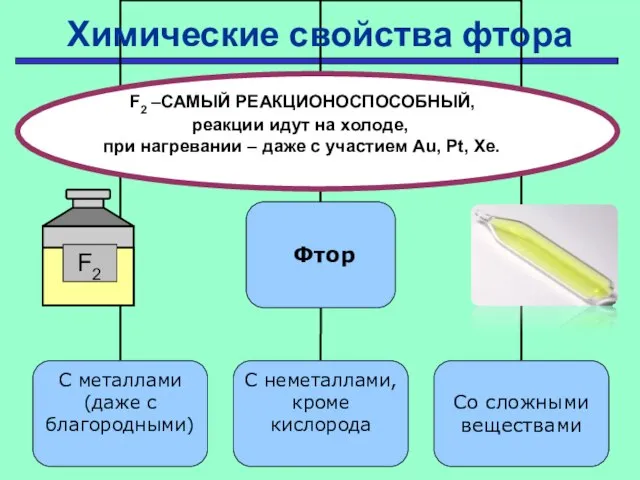
- 16. Проверить F2 –САМЫЙ РЕАКЦИОНОСПОСОБНЫЙ, реакции идут на холоде, при нагревании – даже с участием Au, Pt,
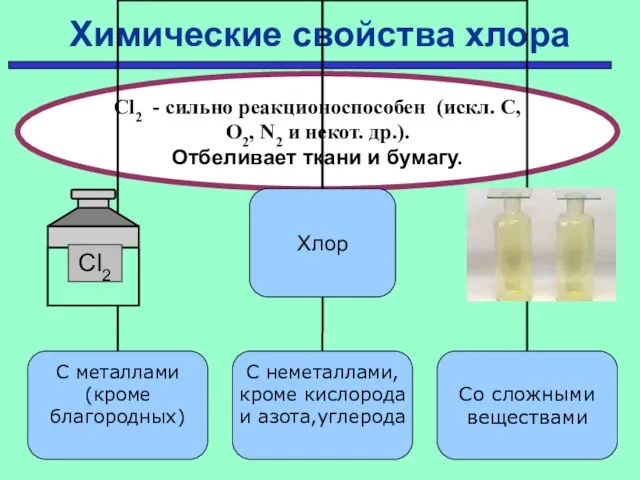
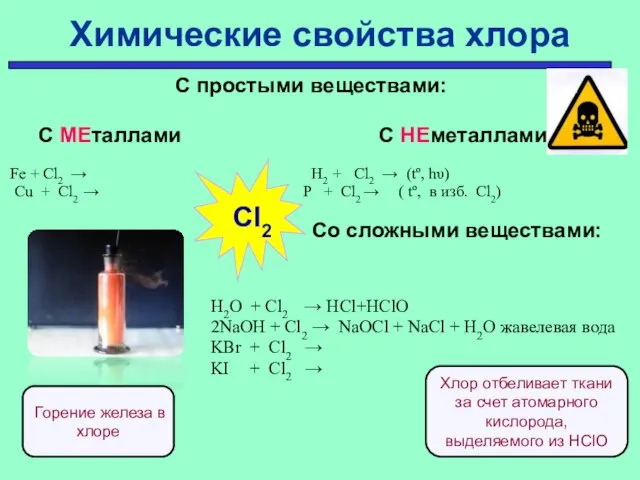
- 17. Химические свойства хлора Cl2 - сильно реакционоспособен (искл. C, O2, N2 и некот. др.). Отбеливает ткани
- 18. С простыми веществами: С МЕталлами С НЕметаллами Fe + Cl2 → H2 + Cl2 → (tº,
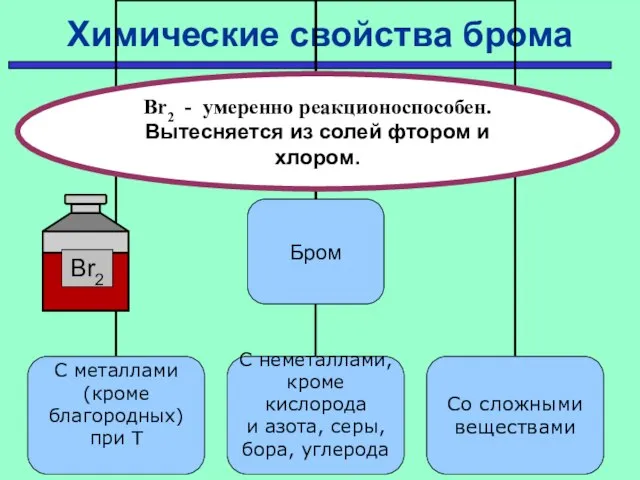
- 19. Химические свойства брома Br2 - умеренно реакционоспособен. Вытесняется из солей фтором и хлором.
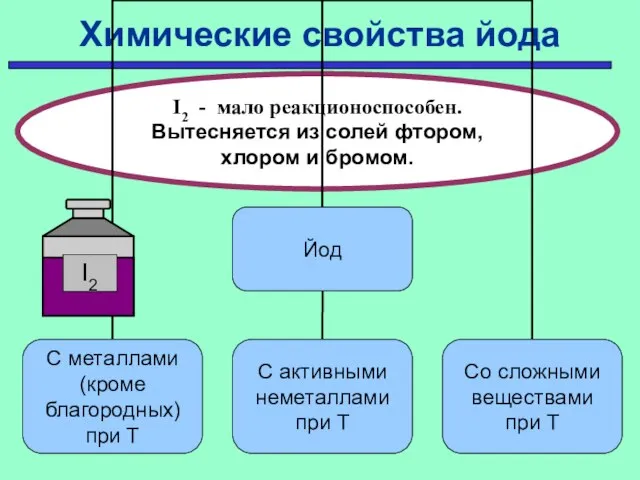
- 20. Химические свойства йода I2 - мало реакционоспособен. Вытесняется из солей фтором, хлором и бромом.
- 21. Закрепление. Тест. 1. Наиболее ярко выражены восстановительные свойства у А) фтора Б) хлора В) брома Г)
- 22. 2. Сила галогеноводородных кислот возрастает в ряду А) НСl, НВr, НI; Б) НI, НВr, НСl; В)
- 23. 3. Наиболее ярко выражены окислительные свойства у А) фтора Б) хлора В) брома Г) иода.
- 24. 4. С какими из перечисленных веществ хлор не взаимодействует? А) Водой; Б) раствором хлорида натрия; В)
- 25. 5. Электронную формулу внешнего энергетического уровня, общую для всех атомов галогенов, можно записать в виде А)
- 26. 6. Среди галогенов – простых веществ - жидким является А) фтор Б) хлор В) бром Г)
- 27. 7. Раствор фтора в воде получить нельзя, так как А) фтор не растворяется в воде; Б)
- 28. 8. Среди галогенов – простых веществ - твердым является А) фтор Б) хлор В) бром Г)
- 29. 9. Хлор взаимодействует с водой по уравнению _____________________ 10. Хлор взаимодействует с холодным раствором гидроксида калия
- 30. 1.Г 2.А 3.А 4.Б 5.Г 6.В 7.Б 8.Г 9. Cl2 + H2O = HCl + HClO
- 32. Скачать презентацию


















 Способы разделения нефти. Ректификация
Способы разделения нефти. Ректификация Лучший тест для подготовки к ЕГЭ по химии
Лучший тест для подготовки к ЕГЭ по химии Пример выполнения проверочной работы по теме углеводороды
Пример выполнения проверочной работы по теме углеводороды Химия, химия, химия!
Химия, химия, химия! Биохимия статическая, динамическая, функциональная
Биохимия статическая, динамическая, функциональная Сплавы на основе меди, титана, никеля
Сплавы на основе меди, титана, никеля Срез знаний по химии
Срез знаний по химии Общая характеристика галогенов. 9 класс
Общая характеристика галогенов. 9 класс Химическая связь
Химическая связь Решение турнира. 9 класс
Решение турнира. 9 класс Vielu īpašības
Vielu īpašības Аналитический подход к моделированию. Физико-химическое моделирование
Аналитический подход к моделированию. Физико-химическое моделирование Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов
Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов Физико-химические основы получения лекарственных препаратов
Физико-химические основы получения лекарственных препаратов Что объединяет вкус яблока, киви, садовой земляники?
Что объединяет вкус яблока, киви, садовой земляники? Серная кислота
Серная кислота Практика по химии
Практика по химии Призер муниципального єтапа всероссийской олимпиады школьников по химии Карасева Светлана
Призер муниципального єтапа всероссийской олимпиады школьников по химии Карасева Светлана Щелочные металлы
Щелочные металлы Свойства кальция и магния. Жёсткость воды. Лекция №7
Свойства кальция и магния. Жёсткость воды. Лекция №7 Химическое вещество золото
Химическое вещество золото Сложные реакции
Сложные реакции Очистка различных поверхностей от нефтяных загрязнений
Очистка различных поверхностей от нефтяных загрязнений Изомерия, её виды
Изомерия, её виды Химия - наука чудес и превращений
Химия - наука чудес и превращений Ароматические углеводороды - Арены
Ароматические углеводороды - Арены Алканы. Строение, номенклатура, изомерия, физические свойства
Алканы. Строение, номенклатура, изомерия, физические свойства Презентация на тему Сплавы металлов (9 класс)
Презентация на тему Сплавы металлов (9 класс)