Слайд 2Химический словарь:
оксид, гидроксид, кислота, соль, химическая реакция, химическое уравнение, условия протекания

реакций, признаки течения химических реакций, алгоритм составления химической реакции, экзо- и эндотермическая реакция, закон сохранения массы веществ
Слайд 3Укажите тип реакции
Преобразуйте схемы в уравнения реакций:
А) S + F2 →

SF6 ,
Б) Fe2O3 + H2 → Fe + H2O,
В) CO + O2 → CO2,
Г) Fe(OH)3 → Fe2O3 + ?,
Д) AgNO3 + KCl → AgCl + KNO3.
Слайд 4Закончите уравнения реакций:
А) соединения B +F2 → ? Sb + O2 →?
Б)

разложения H2O2 → H2O +?
В) замещения Al + H2SO4 → ?
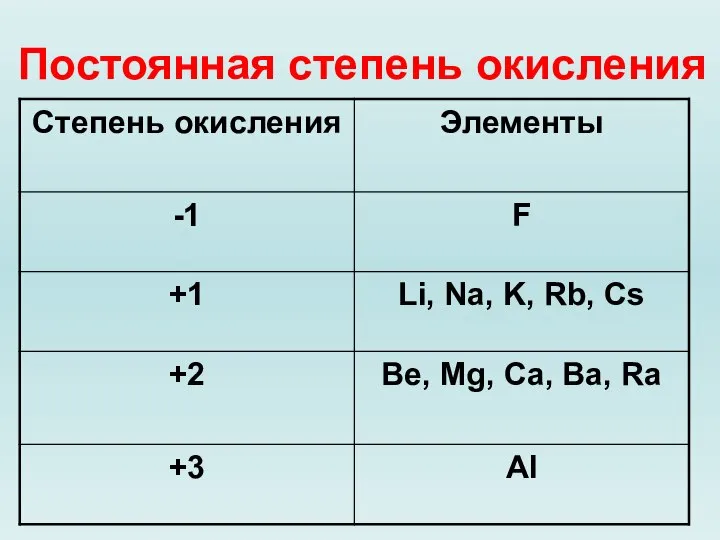
Слайд 6Степень окисления – условный заряд атомов химического элемента в соединении, вычисленный на

основе предположения, что все соединения только ионные.
Слайд 7Степень окисления неметаллов – окислителей.

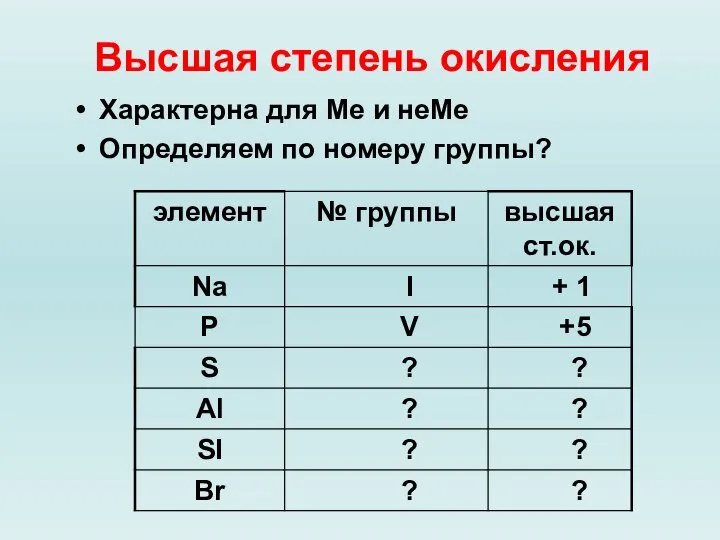
Слайд 8Высшая степень окисления
Характерна для Ме и неМе
Определяем по номеру группы?
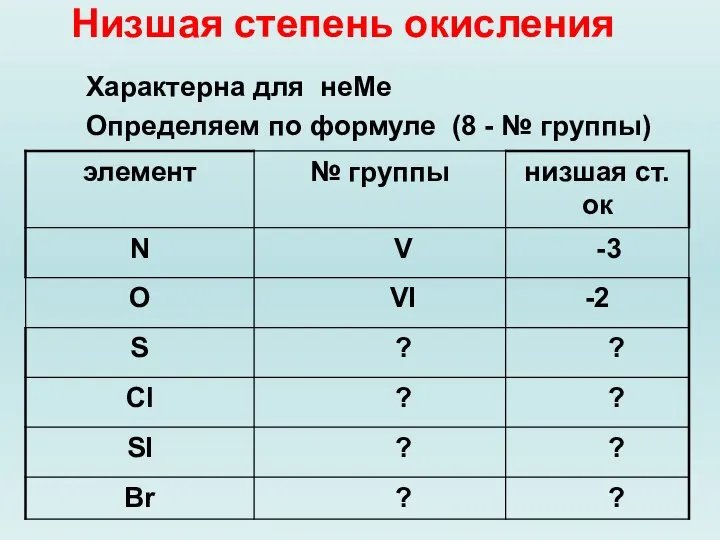
Слайд 9Низшая степень окисления
Характерна для неМе
Определяем по формуле (8 - № группы)
Слайд 11Химические реакции
с изменением степени окисления
2Н20 + О20 = 2Н2 +1О-2
без изменения

степени окисления
СаО + СО2 = СаСО3
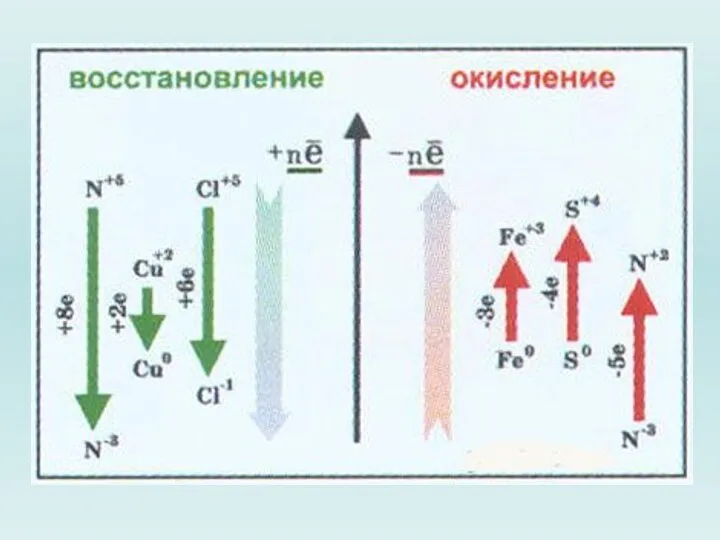
Слайд 12 Вещества, содержащие атомы, которые понижают свою степень окисления и присоединяют электроны,

называются окислителями.
Вещества, содержащие атомы, которые повышают степень окисления и отдают электроны – восстановителями.
Еще есть такое шутливое правило: окислитель - грабитель, восстановитель - потерпевший.
Слайд 14Алгоритм подбора коэффициентов
(метод электронного баланса):
1. Написать схему уравнения без коэффициентов, то

есть указать исходные вещества и продукты реакций.
2. Найти элементы, изменяющие степень окисления, и цифрами над символами этих элементов указать степень окисления.
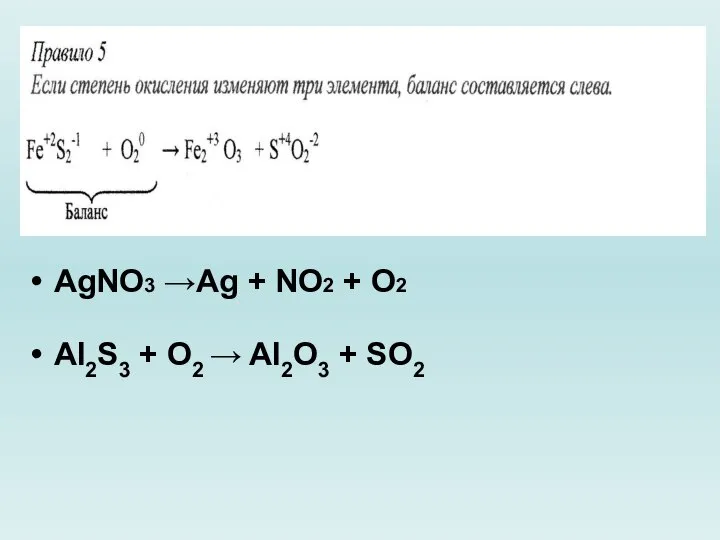
Слайд 19AgNO3 →Ag + NO2 + O2
Al2S3 + O2 → Al2O3 + SO2
Слайд 21Значение окислительно - восстановительных процессов


















 Алканы: состав, строение, изомерия, номенклатура, получение
Алканы: состав, строение, изомерия, номенклатура, получение Взаимодействие цинка с разбавленной соляной кислотой. Лабораторный опыт. Шаблон
Взаимодействие цинка с разбавленной соляной кислотой. Лабораторный опыт. Шаблон Ogļūdeņražu karboksilatvasinājumi
Ogļūdeņražu karboksilatvasinājumi Соль и ее свойства. Добыча соли
Соль и ее свойства. Добыча соли Органическая химия
Органическая химия Процессы массопередачи в гомогенных средах
Процессы массопередачи в гомогенных средах Арены. 10 класс
Арены. 10 класс Жиры
Жиры Cкорость химических реакций
Cкорость химических реакций Химия элементов VIA группы
Химия элементов VIA группы Бромистый этил
Бромистый этил Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Опыты по теме Свойства основных классов неорганических соединений
Опыты по теме Свойства основных классов неорганических соединений Ортофосфорная кислота
Ортофосфорная кислота Соединения железа в природе
Соединения железа в природе Кинетика химических реакций
Кинетика химических реакций Физическая и коллоидная химия
Физическая и коллоидная химия Строение вещества
Строение вещества Алкены-3
Алкены-3 Знаки химических элементов. 8 класс
Знаки химических элементов. 8 класс Природные источники углеводорода
Природные источники углеводорода Изготовление индикаторной бумаги
Изготовление индикаторной бумаги Щелочные металлы
Щелочные металлы Свойства солёной воды. Море у меня в стакане
Свойства солёной воды. Море у меня в стакане Физико-химические методы получения порошков металлов
Физико-химические методы получения порошков металлов Альдегиды, их химические и физические свойства. Получение и применение альдегидов
Альдегиды, их химические и физические свойства. Получение и применение альдегидов Химия. Контроль знаний
Химия. Контроль знаний Анализ процесса гальванического нанесения рения. Поиск альтернативных способов нанесения рения
Анализ процесса гальванического нанесения рения. Поиск альтернативных способов нанесения рения