Слайд 2Определение.Общая формула
Алкены – непредельные углеводороды, в молекулах которых помимо одинарных связей содержится

между атомами углерода одна двойная связь
Общая формула
Слайд 4Физические свойства
По физическим свойствам этиленовые углеводороды близки к алканам. При нормальных условиях

углеводороды
C2–C4 – газы, C5–C17 – жидкости, высшие представители – твердые вещества. Температура их плавления и кипения, а также плотность увеличиваются с ростом молекулярной массы. Все алкены легче воды, плохо растворимы в ней, однако растворимы в органических растворителях.
Слайд 5Особенности строения алкенов
Двойная связь:
σ-связь+π-связь
Тип гибридизации: sp²
Валентный угол: 120°
Форма молекулы:
плоскостная (треугольная)

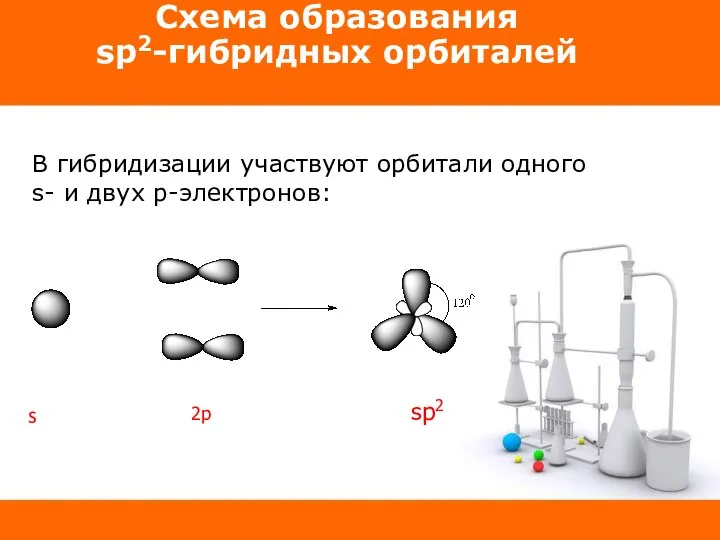
Слайд 6Схема образования
sp2-гибридных орбиталей
В гибридизации участвуют орбитали одного s- и двух p-электронов:
sp2
2p
s
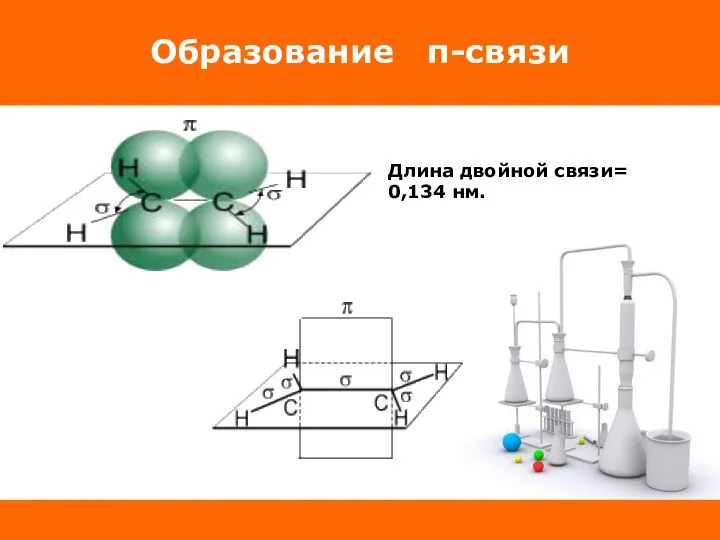
Слайд 7Образование π-связи
У каждого атома С есть ещё по одному облаку, которые в

гибридизации не участвуют и сохраняют форму правильных восьмерок. Перекрываясь над и под плоскостью, они образуют π- связь, которая располагается перпендикулярно к плоскости σ- связей. Двойная связь алкенов представляет собой сочетание σ- и π- связей.
Слайд 8Образование π-связи
Длина двойной связи= 0,134 нм.
Слайд 9Особенности химической связи
Простая (одинарная) связь – это всегда
σ-связь.
В кратных (двойных

или тройных) связях
одна σ-связь, а остальные π-связи.
σ-связи всегда образованы гибридными орбиталями (неправильными восьмерками).
π-связи образованы негибридными
p – орбиталями (правильными восьмерками).
Слайд 10Особенности химической связи
π- связь менее прочна, чем σ- связь.
В связи с

этим, π- связь легко разрывается и переходит в две новые σ- связи в результате присоединения по месту двойной связи двух атомов или групп атомов реагирующих веществ. Для алкенов наиболее типичными являются реакции присоединения.
Слайд 12Номенклатура алкенов
Название алкенов по систематической номенклатуре образуют из названий алканов, заменяя суффикс

–ан на –ен, цифрой указывается номер того атома углерода, от которого начинается двойная связь.
Главная цепь атомов углерода должна обязательно включать двойную связь, и ее нумерацию проводят с того конца главной цепи, к которому она ближе.
В начале названия перечисляют радикалы с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле присутствует несколько одинаковых радикалов, то цифрой указывается место каждого из них в главной цепи и перед их названием ставят соответственно приставки: ди-, три-, тетра- и т.д.
Слайд 13Номенклатура алкенов
Для простейших алкенов применяются также исторически сложившиеся названия: этилен (этен), пропилен

(пропен), бутилен (бутен-1), изобутилен (2-метилпропен) и т.п.
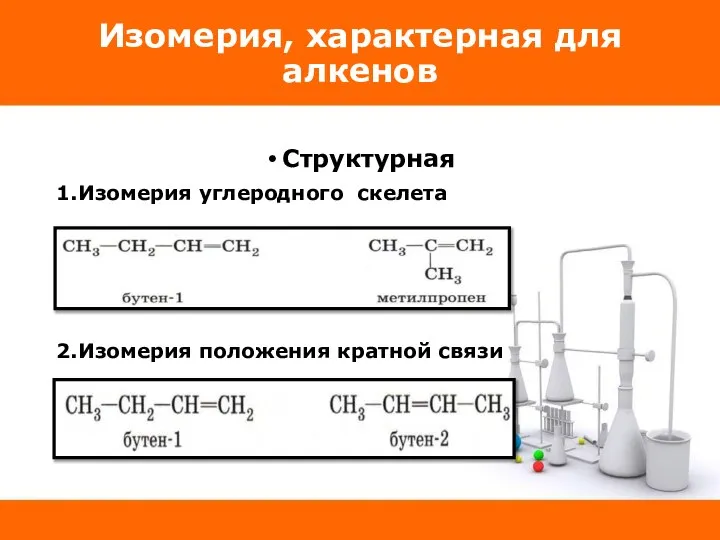
Слайд 14Изомерия, характерная для алкенов
Структурная
1.Изомерия углеродного скелета
2.Изомерия положения кратной связи
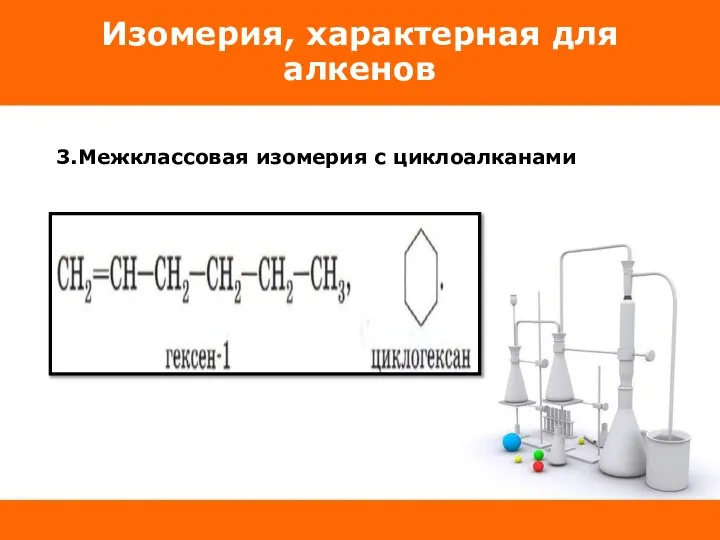
Слайд 15Изомерия, характерная для алкенов
3.Межклассовая изомерия с циклоалканами
Слайд 16Изомерия, характерная для алкенов
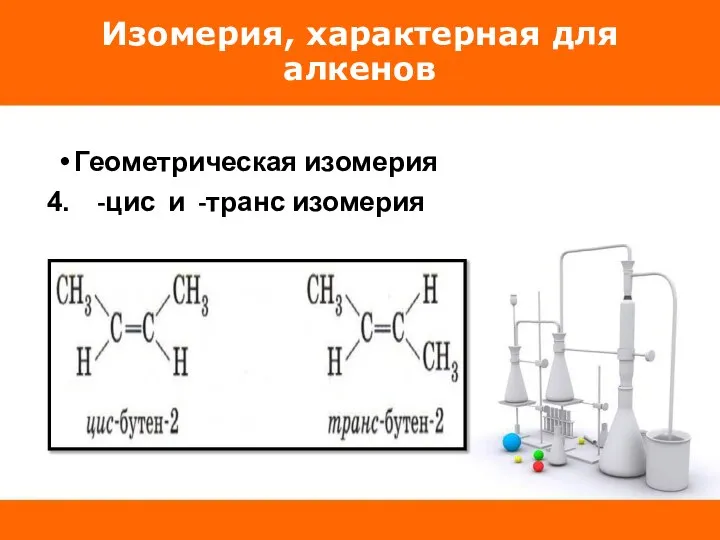
Геометрическая изомерия
-цис и -транс изомерия
Слайд 17Тестирование
1. Алкены – это __________ углеводороды, содержащие в молекуле, помимо одинарных связей,

одну двойную связь
А) ароматические
Б) циклические
В) ациклические
Г) непредельные
2. Какой общей формуле соответствуют алкены
А) CnH2n-6
Б) CnH2n+2
В) CnH2n-2
Г) CnH2n
3.Алкены – это непредельные углеводороды, содержащие в молекуле, помимо одинарных связей, одну ________ связь
А) тройную
Б) двойную
В) две двойных
Г) все одинарные
Слайд 18Тестирование
4.Изомерами являются:
А)пентан и пентадиен; В) этан и ацетилен;
Б)бутан и циклобутан; Г)

бутен и циклобутан.
5. Изомерами являются
А) циклопропан и циклогексан
Б) бутен-1 и бутен-2
В) метан и пропан
Г) гексен-1 и гептен-2
6. В виде цис- и транс-изомеров может существовать:
А)этилен Б) пропилен
В) бутен-1 Г) бутен-2 .
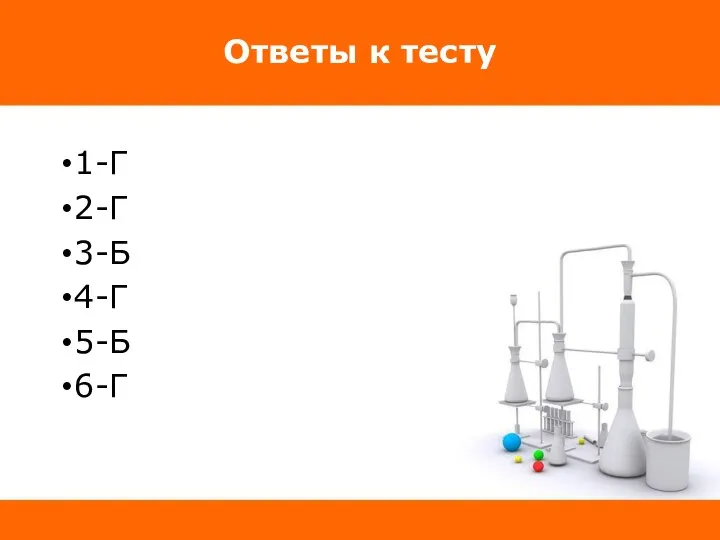
Слайд 19Ответы к тесту
1-Г
2-Г
3-Б
4-Г
5-Б
6-Г

















 Упражнения. Масс-спектрометрия
Упражнения. Масс-спектрометрия Строение вещества. Виды химической связи
Строение вещества. Виды химической связи Турнир знатоков химии
Турнир знатоков химии Химические формулы
Химические формулы Хром
Хром Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок
Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок Способы выражения концентраций растворов
Способы выражения концентраций растворов Интерактивная интеллектуальная игра. Юный химик
Интерактивная интеллектуальная игра. Юный химик Определение степеней окисления и расстановка коэффициентов в ОВР
Определение степеней окисления и расстановка коэффициентов в ОВР Презентация на тему Природный и попутный нефтяной газы, их состав, использование
Презентация на тему Природный и попутный нефтяной газы, их состав, использование  Синтез.Малахит
Синтез.Малахит Гидролиз солей
Гидролиз солей Степень окисления. Составление формул бинарных соединений
Степень окисления. Составление формул бинарных соединений Презентация на тему Виды химической связи
Презентация на тему Виды химической связи  Fyzikálne a chemické deje
Fyzikálne a chemické deje Ліпіди
Ліпіди Непредельные углеводороды
Непредельные углеводороды Йод. Свойства
Йод. Свойства Промышленный метод получения ацетилена
Промышленный метод получения ацетилена Средства ухода за кожей
Средства ухода за кожей Исследовательская работа по химии на тему: Интегративные проблемные ситуации
Исследовательская работа по химии на тему: Интегративные проблемные ситуации Презентация на тему Валентность и степень окисления (8 класс)
Презентация на тему Валентность и степень окисления (8 класс)  Использование информационных технологий в образовательном процессе на примере химии
Использование информационных технологий в образовательном процессе на примере химии Ароматические и гетероциклические соединения. Электронная спектроскопия
Ароматические и гетероциклические соединения. Электронная спектроскопия Методы очистки воды от тяжелых металлов Выполнила: студентка 4 курса 41 группы естественно-географического факультета Кузнецова
Методы очистки воды от тяжелых металлов Выполнила: студентка 4 курса 41 группы естественно-географического факультета Кузнецова Основания. Номенклатура
Основания. Номенклатура Скорость химической реакции и химическое равновесие. Задание 20 в ЕГЭ
Скорость химической реакции и химическое равновесие. Задание 20 в ЕГЭ Природный и попутный газы, их состав и использование
Природный и попутный газы, их состав и использование