Тема: Химические формулы. Относительная атомная и относительная молекулярная массы. I. Химическая формула – это условная запись с
Содержание
- 2. Тема: Химические формулы. Относительная атомная и относительная молекулярная массы. II. Чтение химических формул. * Примеры: NH3
- 3. Тема: Относительная атомная и относительная молекулярная массы. * I. Ar – относительная атомная масса. 1 а.е.м.
- 4. Тема: Химические формулы. Относительная атомная и относительная молекулярная массы. * II. Нахождение Ar с помощью периодической
- 5. Тема: Химические формулы. Относительная атомная и относительная молекулярная массы. * III. Mr – относительная молекулярная масса
- 6. * Определить относительную молекулярную массу. PbSiO3 AlCl3 AgNO3 ZnMnO4 C8H18 ВЕРНУТЬСЯ К ТЕМЕ УРОКА
- 7. IV. Массовая доля элемента в веществе. * I. Массовая доля - w w(Э) = n Ar(Э)
- 8. * Знаки химических элементов. - название - произношение Al Ba Ca Na K Cl S F
- 10. Скачать презентацию







 Кислотно-основное равновесие
Кислотно-основное равновесие Строение атома
Строение атома Тема_6б_химическая_кинетика
Тема_6б_химическая_кинетика Соединения алюминия
Соединения алюминия Предмет химии. Вещества
Предмет химии. Вещества Природные источники углеводородов. Нефть и природный газ, их применение. Полимеры
Природные источники углеводородов. Нефть и природный газ, их применение. Полимеры Применение алканов
Применение алканов Теория строения органических соединений
Теория строения органических соединений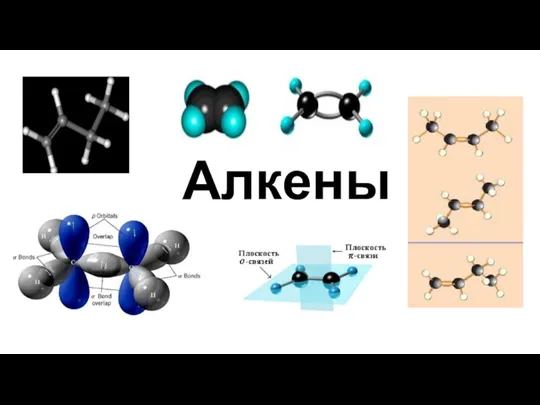 Алкены. Гомологический ряд алкенов. Изомерия алкенов. Химические свойства алкенов
Алкены. Гомологический ряд алкенов. Изомерия алкенов. Химические свойства алкенов Расчет физических свойств нефтепродуктов. Практическая работа 1
Расчет физических свойств нефтепродуктов. Практическая работа 1 Курс химии для основных академических направлений подготовки специалистов НИЯУ МИФИ
Курс химии для основных академических направлений подготовки специалистов НИЯУ МИФИ Юный химик. Интерактивная интеллектуальная игра
Юный химик. Интерактивная интеллектуальная игра Изомерия. Виды изомерии
Изомерия. Виды изомерии Добыча золота в России По теме «Внешние эффекты и права собственности»
Добыча золота в России По теме «Внешние эффекты и права собственности» Презентация на тему Изомерия
Презентация на тему Изомерия  Основные сведения о строении атома
Основные сведения о строении атома Теория строения вещества. Межмолекулярные взаимодействия. Водородная связь. Специфические взаимодействия
Теория строения вещества. Межмолекулярные взаимодействия. Водородная связь. Специфические взаимодействия Потенциометрический анализ, титрование
Потенциометрический анализ, титрование Пропи́н (метилацетилен, аллилен)
Пропи́н (метилацетилен, аллилен) Вазелин и вазелиновое масло
Вазелин и вазелиновое масло Строение атома
Строение атома Органическая химия
Органическая химия Амины (продолжение). 10 класс
Амины (продолжение). 10 класс Стирол - важнейшее производное бензола
Стирол - важнейшее производное бензола Презентация на тему Каучуки
Презентация на тему Каучуки  Cиликат кальция
Cиликат кальция Цветные опыты
Цветные опыты Полимеры и сополимеры акриловой и метакриловой кислот и их производных
Полимеры и сополимеры акриловой и метакриловой кислот и их производных