Содержание
- 3. получение и свойства кислорода
- 4. Общая характеристика Химический знак – ? Относительная атомная масса Ar (O) – ? Химическая формула –
- 5. Общая характеристика Химический знак – О Относительная атомная масса Ar (O) – 16 Химическая формула –
- 6. Открытие кислорода В 1774 году английский ученый Джозеф Пристли открыл кислород. Он нагрел оксид ртути (II)
- 7. Получение кислорода HgO пос. токHg+O2 KMnO4 t K2MnO4+MnO2+O2 H2O2 MnO2 H2O+O2 KCIO3 t KCI+O2
- 8. Получение кислорода 2HgO пос. ток 2Hg+O2 2KMnO4 t K2MnO4+MnO2+O2 2H2O2 MnO2 2H2O+O2 2KCIO3 t 2KCI+3O2
- 9. Веществами, которые ускоряют химические реакции, но сами при этом не расходуются, называются катализаторами. MnO2
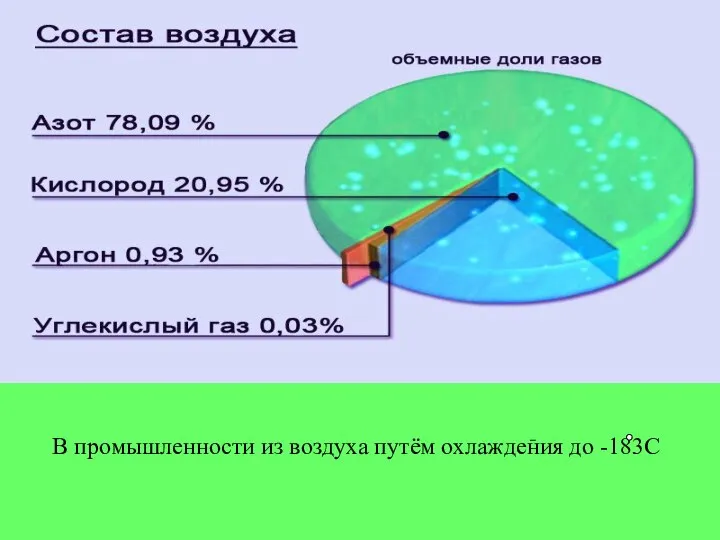
- 10. В промышленности из воздуха путём охлаждения до -183С
- 11. Физические свойства Кислород –бесцветный газ, без вкуса и запаха, относительно малорастворим в воде. Кислород немного тяжелее
- 12. Химические свойства кислорода 2Mg+O2=2MgO C+O2=CO2 S+O2=SO2
- 13. Горение – это химическая реакция, при которой происходит окисление веществ с выделением теплоты и света. MgO,
- 15. Скачать презентацию











 Золото
Золото ZnS и ZnSe как оптические материалы,люминофоры, лазерные матрицы
ZnS и ZnSe как оптические материалы,люминофоры, лазерные матрицы Великие ученые общей и неорганической химии
Великие ученые общей и неорганической химии Строение атома
Строение атома Техника безопасности (3)
Техника безопасности (3) Первые попытки классификации химических элементов
Первые попытки классификации химических элементов Планирование экспериментов предметной области кандидатской диссертации
Планирование экспериментов предметной области кандидатской диссертации Презентация на тему Гормоны
Презентация на тему Гормоны  Презентация на тему Электронное и пространственное строение молекулы метана
Презентация на тему Электронное и пространственное строение молекулы метана  Скорость химической реакции
Скорость химической реакции Соли в свете теории электролитической диссоциации
Соли в свете теории электролитической диссоциации Презентация на тему Типы химических реакций
Презентация на тему Типы химических реакций  Презентация на тему Ионные уравнения
Презентация на тему Ионные уравнения  Гомологи и изомеры
Гомологи и изомеры Основные особенности процессов растворения твёрдых веществ
Основные особенности процессов растворения твёрдых веществ Основные классы неорганических соединений
Основные классы неорганических соединений Обмен жиров в организме млекопитающего
Обмен жиров в организме млекопитающего Химическая связь и строение вещества
Химическая связь и строение вещества Как решить задания тестов ЕГЭ по химии, если знания на базовом уровне. Метод исключения
Как решить задания тестов ЕГЭ по химии, если знания на базовом уровне. Метод исключения Химические средства защиты растений
Химические средства защиты растений каталитический крекинг
каталитический крекинг Обобщение знаний по курсу органической химии
Обобщение знаний по курсу органической химии Технологии получения и преобразования текстильных материалов. Синтетические волокна (9 класс)
Технологии получения и преобразования текстильных материалов. Синтетические волокна (9 класс) Презентация на тему Подготовка к ЕГЭ. Полезно знать
Презентация на тему Подготовка к ЕГЭ. Полезно знать  Алканы, предельные, насыщенные углеводороды (парафины)
Алканы, предельные, насыщенные углеводороды (парафины) Материалы к уроку «Значение растворов» Автор: учитель СОШ № 4 Чурбакова Елена Васильевна
Материалы к уроку «Значение растворов» Автор: учитель СОШ № 4 Чурбакова Елена Васильевна Жидкое состояние вещества
Жидкое состояние вещества Свойства глюкозы
Свойства глюкозы