Содержание
- 2. Электролиз — это окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через раствор или
- 3. Электролиз водных растворов электролитов. Катодные процессы в водных растворах электролитов :катионы или молекулы воды принимают электронов
- 4. 1. Катионы металлов со стандартным электродным потенциалом, большим, чем у ВОДОРОДА, расположены в ряду напряжений после
- 5. 2. Катионы металлов с малой величиной стандартного электродного потенциала (катионы металлов начала ряда напряжений Li+, Na+,
- 6. 3. Катионы металлов со стандартным электродным потенциалом меньшим, чем у ВОДОРОДА, но большим, чем у алюминия
- 7. 4. На катоде легче всего разряжаются катионы того металла, которому отвечает наиболее положительный потенциал. Так, например,
- 8. Анодные процессы На аноде происходит окисление анионов или молекул воды ( частицы отдают электронов - окисляются)
- 9. Правила процессов электролиза При электролизе водного раствора соли из активного металла и кислородосодержащей кислоты на катоде
- 10. При электролизе водного раствора соли из малоактивного металла и кислородосодержащей кислоты на катоде выделяется металл, а
- 11. При электролизе катиона аммония NH4+ восстанавливается вода. При электролизе солей органических кислот на катоде восстанавливается вода,
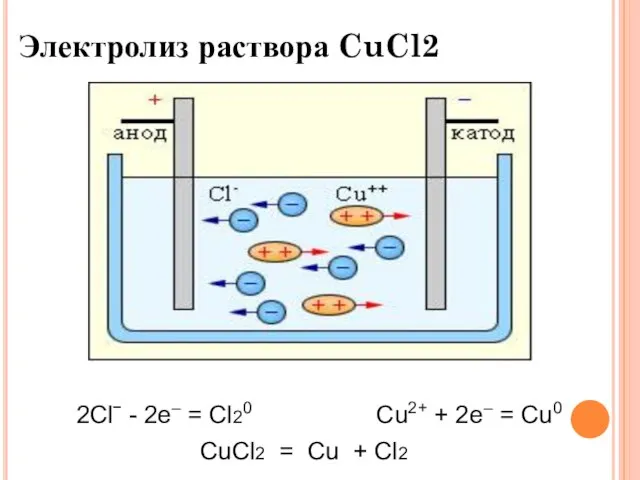
- 12. Электролиз раствора CuCl2 2Clˉ - 2e– = Cl20 Cu2+ + 2e– = Cu0 CuCl2 = Cu
- 14. Скачать презентацию










 Презентация на тему Использование Икт в преподавании химии
Презентация на тему Использование Икт в преподавании химии  Кислород. Применение и круговорот в природе. 8 класс
Кислород. Применение и круговорот в природе. 8 класс Типичные ошибки выпускников при решении задач ЕГЭ по органической химии
Типичные ошибки выпускников при решении задач ЕГЭ по органической химии Основные положения качественного анализа. Лекция №7
Основные положения качественного анализа. Лекция №7 Радон (222Rn)
Радон (222Rn) Сера. Характеристика химического элемента и простого вещества
Сера. Характеристика химического элемента и простого вещества Что такое углеволокно (карбон) и как оно может спасти нас от нефтяного кризиса
Что такое углеволокно (карбон) и как оно может спасти нас от нефтяного кризиса Лазерное формирование цветного изображения на металлической поверхности методом локального окисления
Лазерное формирование цветного изображения на металлической поверхности методом локального окисления Изготовление индикаторной бумаги
Изготовление индикаторной бумаги Элементы принадлежащие к VII группе периодической таблицы - галогены
Элементы принадлежащие к VII группе периодической таблицы - галогены Жиры. Открытие жиров
Жиры. Открытие жиров Функциональные свойства и анализ каротиноидов в пищевых продуктах
Функциональные свойства и анализ каротиноидов в пищевых продуктах Кремнийорганические мономеры: Органохлорсиланы
Кремнийорганические мономеры: Органохлорсиланы Сероводород. Соединения серы
Сероводород. Соединения серы Презентация на тему Переработка нефти
Презентация на тему Переработка нефти  ТБ_1 (1)
ТБ_1 (1) Хлорорганические соединения
Хлорорганические соединения Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома
Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома Chemia kosmetyczna
Chemia kosmetyczna Виды кератоликов для маникюра. Основные свойства
Виды кератоликов для маникюра. Основные свойства Звездный час по химии
Звездный час по химии Валентность. Определение валентности элемента в оксиде
Валентность. Определение валентности элемента в оксиде Презентация на тему Химия в медицине
Презентация на тему Химия в медицине  Fyzikálne a chemické deje
Fyzikálne a chemické deje Башня плотности
Башня плотности Электролитическая диссоциация
Электролитическая диссоциация Игра Самый умный химик
Игра Самый умный химик Классификация химических реакций. 11 класс
Классификация химических реакций. 11 класс