Содержание
- 2. Улучшить здоровье детей - задача для школы непосильная. Целью работы школьного коллектива может быть только охрана
- 3. Вопросы здоровьесбережения на уроках химии Задачи учителя: Помочь ученику сохранить свое здоровье Помочь приобрести знания об
- 4. Формы работы Введение вопросов здоровьесбережения в содержание урока: Уроки здоровья «Питание и здоровье», о наркотических веществах,
- 5. Задачи на основные понятия и законы химии Из приведенного ниже перечня выпишите отдельно названия веществ и
- 6. Задачи на основные понятия и законы химии Запишите русские названия химических элементов: Ba, Al, Ni, N,
- 7. Задачи на основные понятия и законы химии Определить в каком количестве вещества меди содержится 31• 10²³
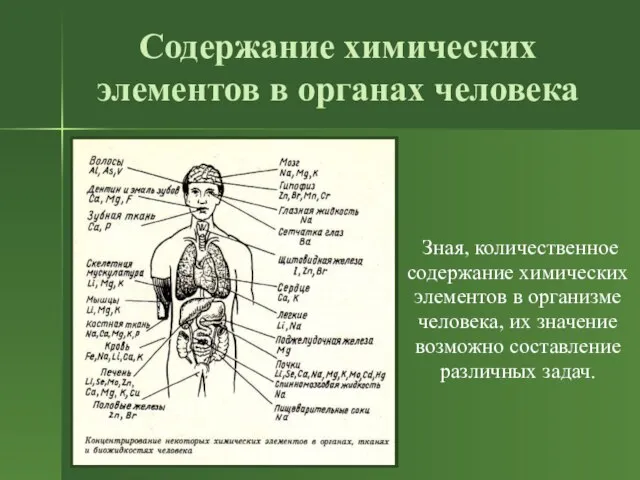
- 8. Содержание химических элементов в органах человека Зная, количественное содержание химических элементов в организме человека, их значение
- 9. Задачи на основные понятия и законы химии Какое количество вещества составляет углекислый газ, занимающий объем 134,4
- 10. Задачи на основные понятия и законы химии Величину шума в децибелах, ведущего к полной глухоте, если
- 11. Задачи на основные понятия и законы химии Вычислите, какое количество вещества составляет: а) вода массой 162
- 12. Многовариантные задачи Вычислите какое количество вещества составляет а) оксид кальция массой 5,6г б) оксид калия массой
- 13. Многовариантные задачи Вычислив массовые доли химических элементов в молекуле этилового спирта, вы узнаете, какие заболевания возникают
- 14. Многовариантные задачи Составьте уравнения химических реакций, и по количеству веществ, участвующих в реакции, вы сможете определить
- 15. Многовариантные задачи Запишите уравнения химических реакции и по числу электронов, участвующих в процессе окисления, определите, как
- 16. Многовариантные задачи Запишите уравнения химических реакции: а) окисления фосфора (V) б) горения аммиака в отсутствии катализатора
- 17. Эвристические задачи Сульфат бария используют в медицине как рентгено- контрастное средство, но в нем недопустима примесь
- 18. Задачи на растворы Для рентгеновского исследования желудка больному дают выпить суспензию сульфата бария. Почему используют именно
- 19. Задачи на растворы Глюкозу в медицине используют в виде растворов различной концентрации, которые служат источником жидкости
- 20. Задачи, возникающие из жизнедеятельности школы. ГО и ЧС В случае загрязнения атмосферы хлором, можно защититься марлевыми
- 21. Правила техники безопасности Простейшим способом удаления пролившейся ртути является обработка загрязненного места йодной настойкой. Какую массу
- 22. « Домашние » задачи Плохой уход за зубами, особенно несвоевременное удаление остатков пищи, - одна из
- 23. « Домашние » задачи При неправильном уходе за ротовой полостью зубы становятся очень чувствительны к горячей
- 24. « Домашние » задачи В составе желудочного сока содержится соляная кислота. Избыток ее (повышенная кислотность) вызывает
- 25. « Домашние » задачи Перманганат калия –KMnO4 используется в медицине в виде 5% раствора для смазывания
- 26. « Домашние » задачи Какие вещества, находящиеся в домашней аптечке, как дезинфицирующие препараты, можно использовать для
- 27. « Домашние » задачи В домашней аптечке хранятся такие вещества как перманганат калия, нашатырный спирт, этиловый
- 28. « Домашние » задачи Используя вещества из домашней аптечки, ученик попытался провести химические реакции. Какие вещества
- 29. « Домашние » задачи Пурген (фенолфталеин) применяют как слабительное средство. Какую окраску приобретет пурген в растворах
- 30. Задачи можно: предложить учащимся как химическую разминку в начале урока при закреплении нового материала как дополнительное
- 32. Скачать презентацию




























 Презентация на тему Переработка нефти
Презентация на тему Переработка нефти  Аммиак
Аммиак Алканы 10-класс
Алканы 10-класс Структура неорганических ионных соединений. Лекция 12
Структура неорганических ионных соединений. Лекция 12 Судьба углеродного скелета аминокислот
Судьба углеродного скелета аминокислот Л1.3. Фазы в металлических сплавах
Л1.3. Фазы в металлических сплавах Гидролиз солей – частный случай РИО
Гидролиз солей – частный случай РИО Вода - самое удивительное вещество в природе. (8 класс)
Вода - самое удивительное вещество в природе. (8 класс) Предельные углеводороды насыщенные, парафины, алканы
Предельные углеводороды насыщенные, парафины, алканы Кислород
Кислород Природные источники углеводородов
Природные источники углеводородов Введение Химия. Вещество. Свойства вещества
Введение Химия. Вещество. Свойства вещества Минералы
Минералы Химия. Ребусы
Химия. Ребусы Типы химических реакций. Решение примеров
Типы химических реакций. Решение примеров Интеллектуальная игра По страницам истории химии
Интеллектуальная игра По страницам истории химии Применение ЦОР на уроках биологии и химии
Применение ЦОР на уроках биологии и химии Методика измерений массовой концентрации ионов аммония в природных и сточных водах фотометрическим методом с реактивом Несслера
Методика измерений массовой концентрации ионов аммония в природных и сточных водах фотометрическим методом с реактивом Несслера Элемент астат
Элемент астат Ароматические гетероциклические соединения
Ароматические гетероциклические соединения бирюза
бирюза Спирты (10 класс)
Спирты (10 класс) Игра Самый умный химик
Игра Самый умный химик Л-1-4
Л-1-4 Влияние бытовой химии на здоровье человека
Влияние бытовой химии на здоровье человека Арены. Бензол
Арены. Бензол Карбоцепные полимеры
Карбоцепные полимеры Молибден. Получение молибдена
Молибден. Получение молибдена