Содержание
- 2. Карбоновыми кислотами называются соединения, в которых функциональной группой является карбоксильная группа: –COOH
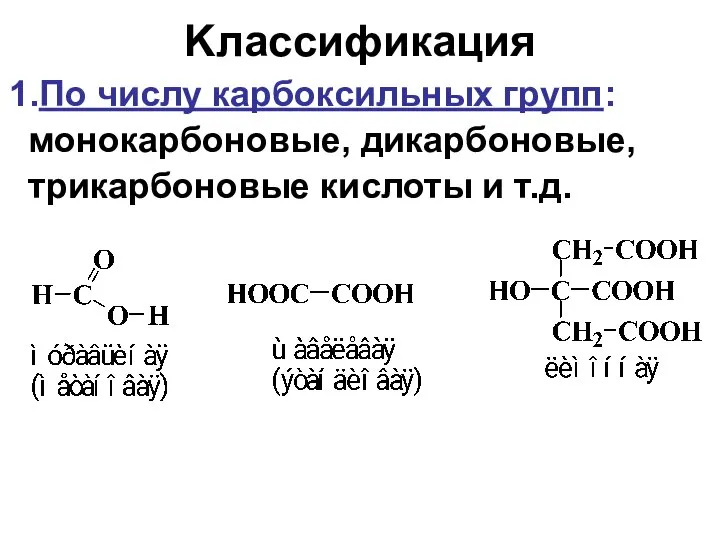
- 3. Kлассификация По числу карбоксильных групп: монокарбоновые, дикарбоновые, трикарбоновые кислоты и т.д.
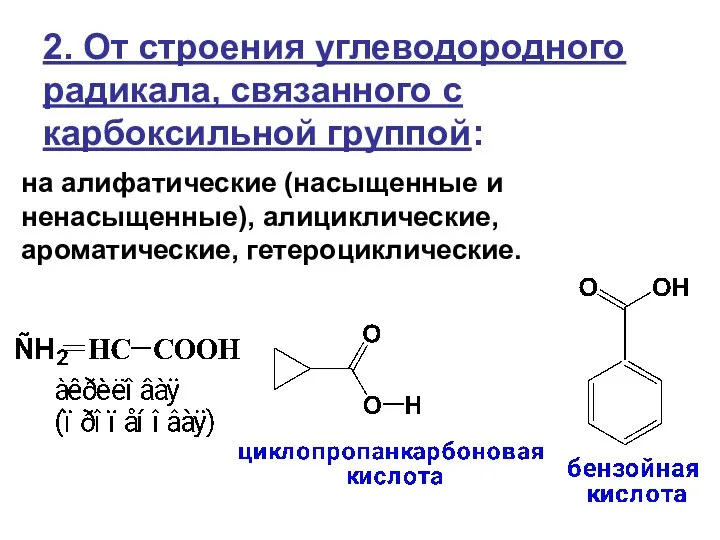
- 4. 2. От строения углеводородного радикала, связанного с карбоксильной группой: на алифатические (насыщенные и ненасыщенные), алициклические, ароматические,
- 5. НОМЕНКЛАТУРА В систематических названиях карбоновых кислот карбоксильная группа обозначается сочетанием: Если группа СООН не входит в
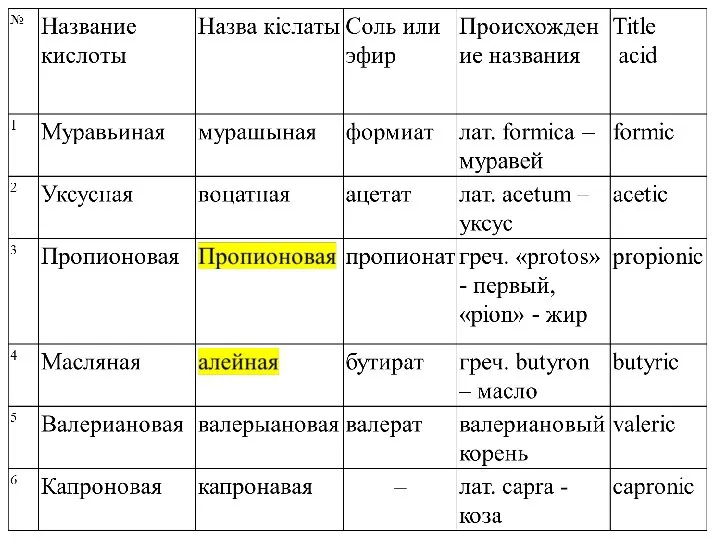
- 6. Для первых пяти представителей насыщенных алифатических моно- и дикарбоновых кислот правилами ИЮПАК рекомендуется использование тривиальных названий,
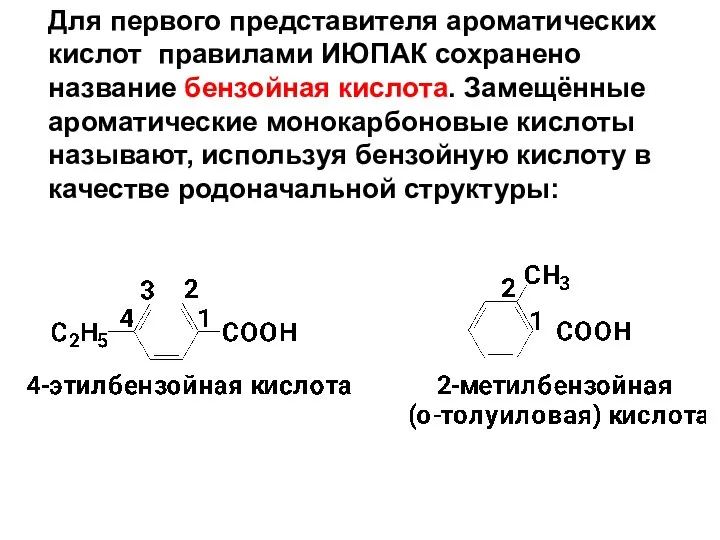
- 7. Для первого представителя ароматических кислот правилами ИЮПАК сохранено название бензойная кислота. Замещённые ароматические монокарбоновые кислоты называют,
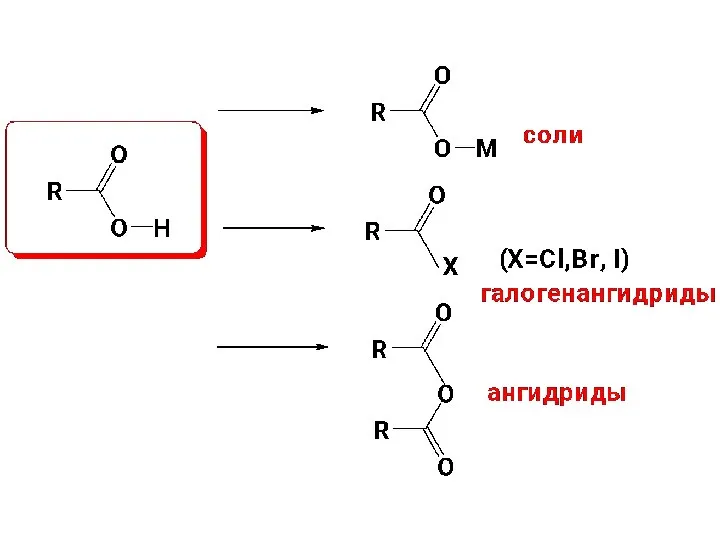
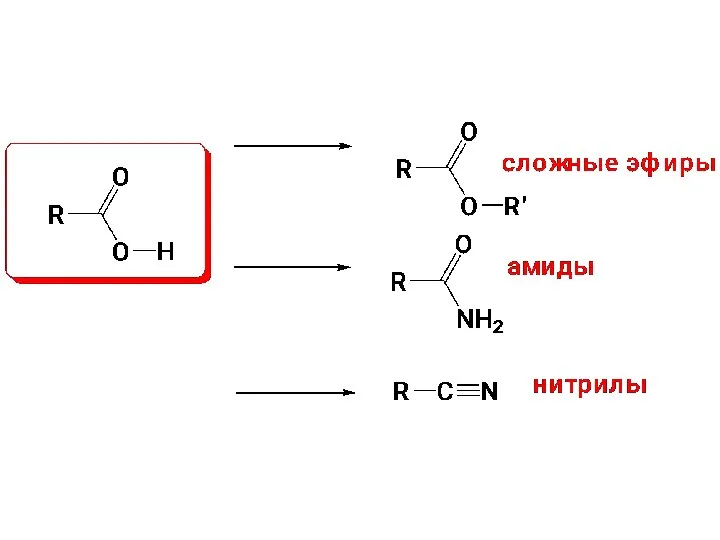
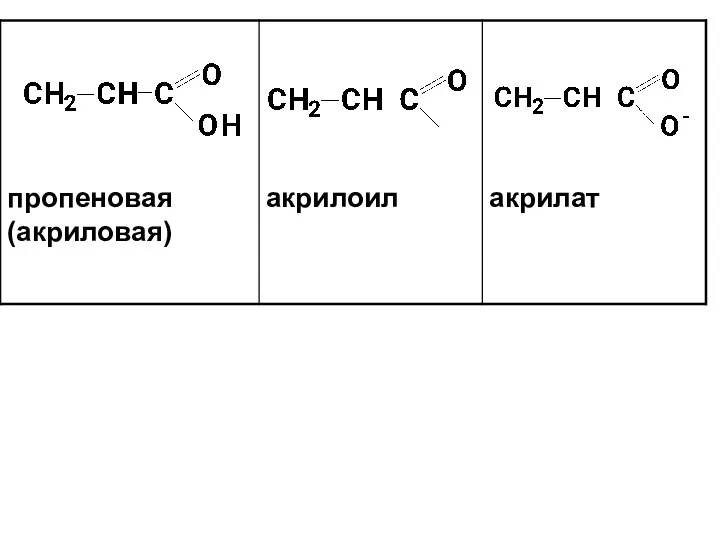
- 9. Все соединения, которые могут быть произведены от кислот в результате химических превращений по карбоксильной группе, называют
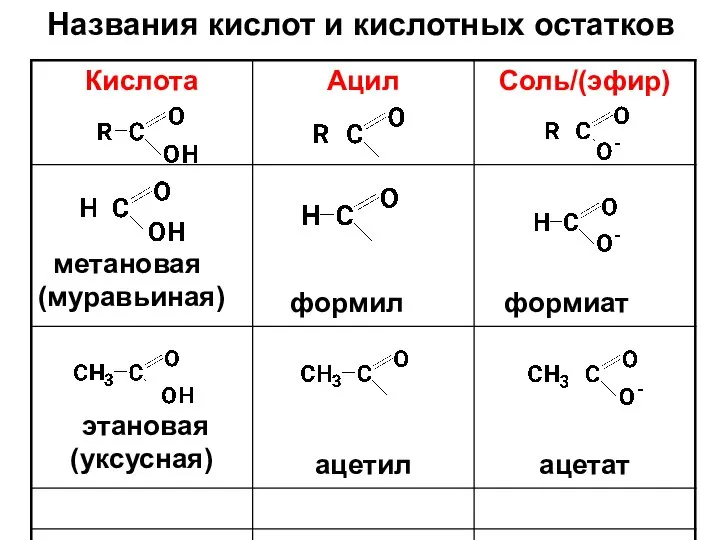
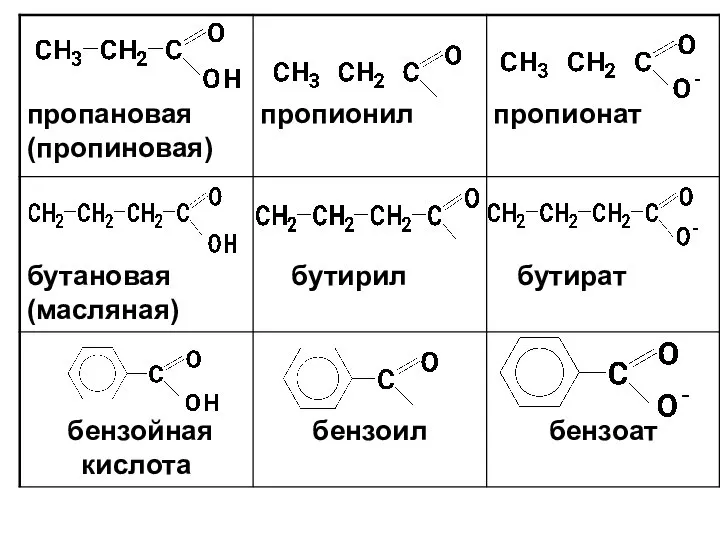
- 12. Названия кислот и кислотных остатков
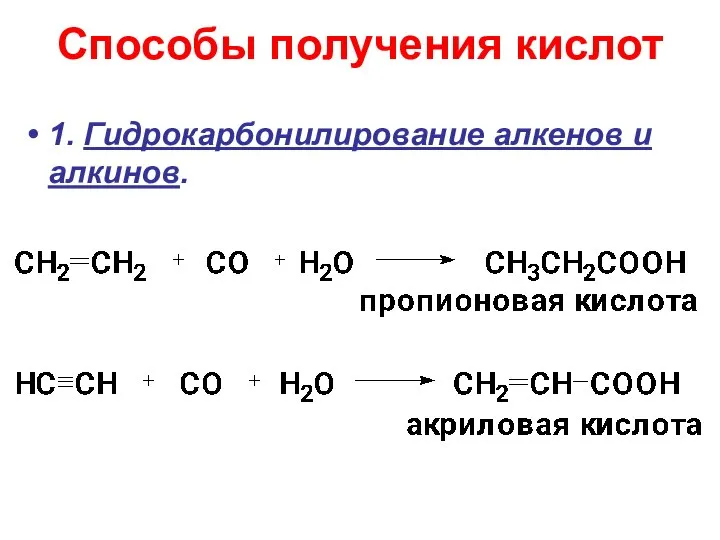
- 15. Способы получения кислот 1. Гидрокарбонилирование алкенов и алкинов.
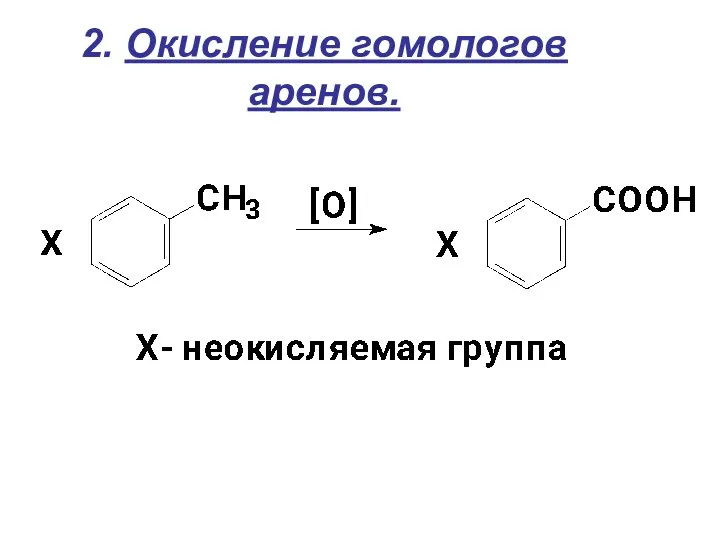
- 16. 2. Окисление гомологов аренов.
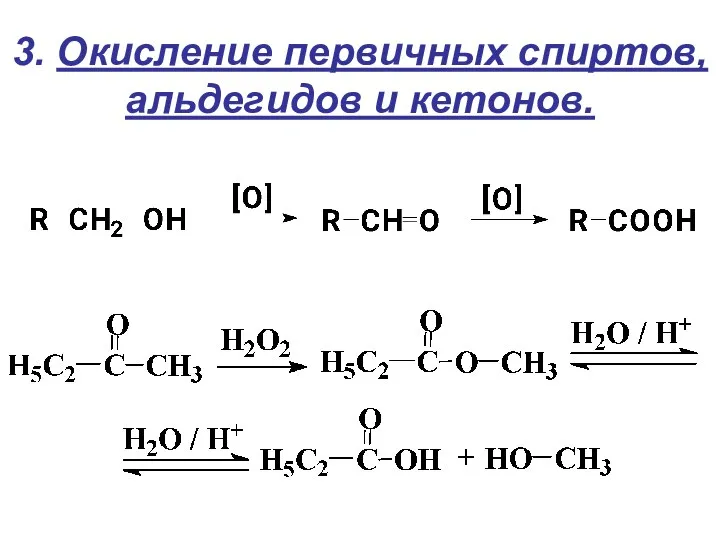
- 17. 3. Окисление первичных спиртов, альдегидов и кетонов.
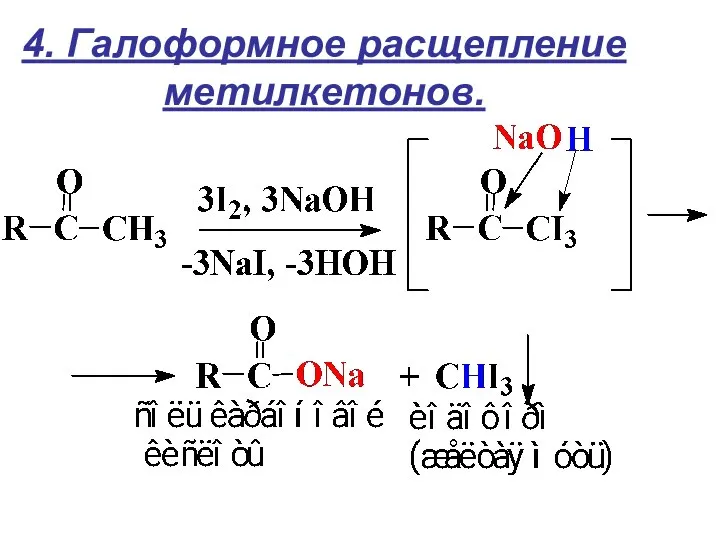
- 18. 4. Галоформное расщепление метилкетонов.
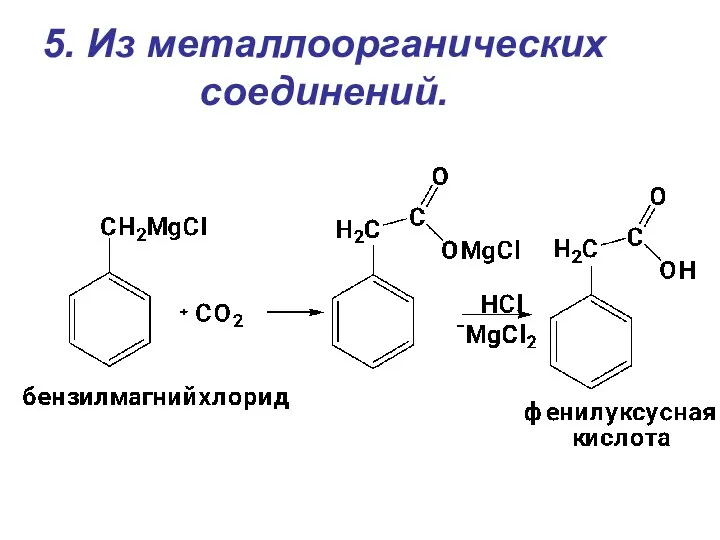
- 19. 5. Из металлоорганических соединений.
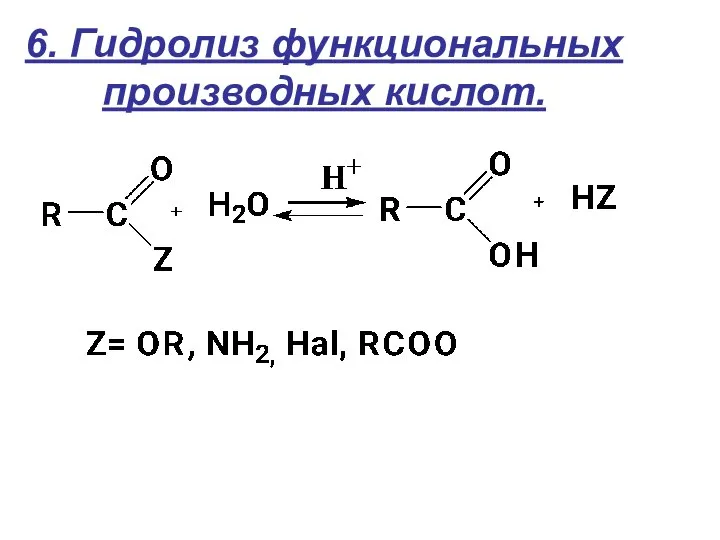
- 20. 6. Гидролиз функциональных производных кислот.
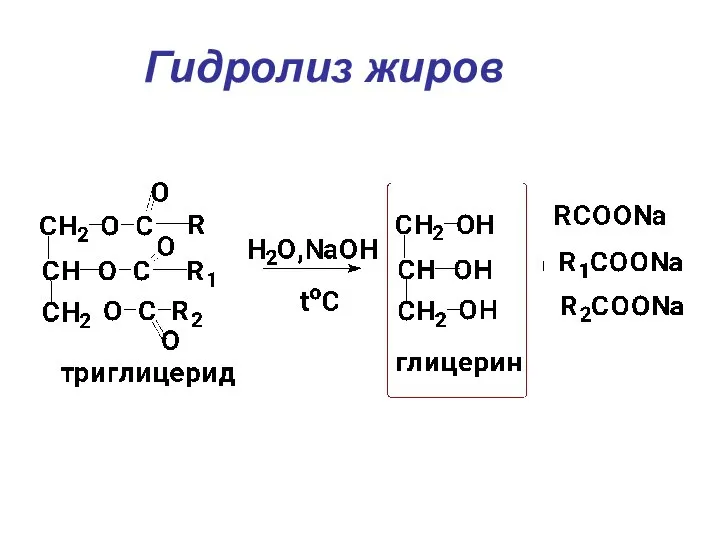
- 21. Гидролиз жиров
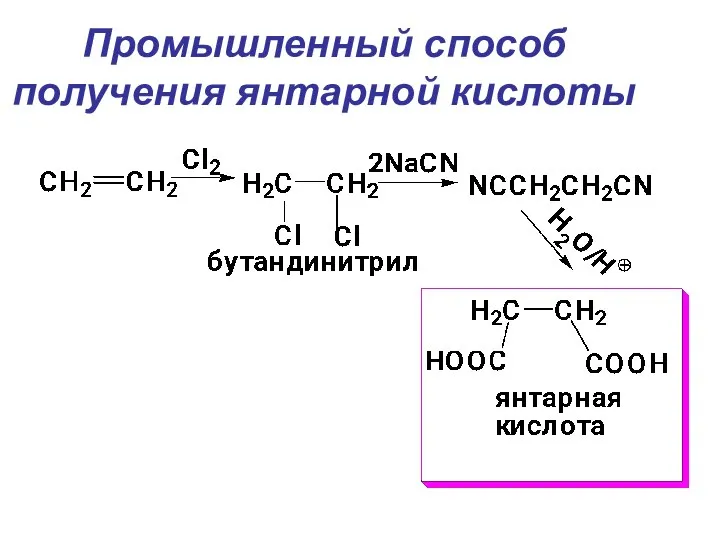
- 22. Промышленный способ получения янтарной кислоты
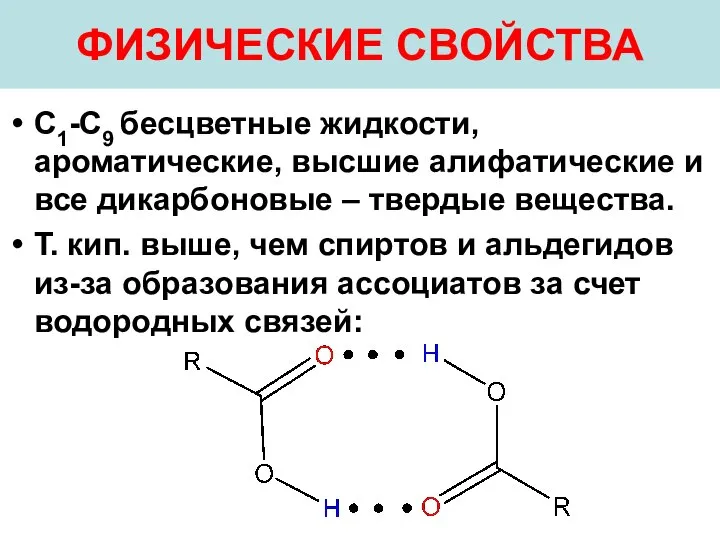
- 23. ФИЗИЧЕСКИЕ СВОЙСТВА С1-С9 бесцветные жидкости, ароматические, высшие алифатические и все дикарбоновые – твердые вещества. Т. кип.
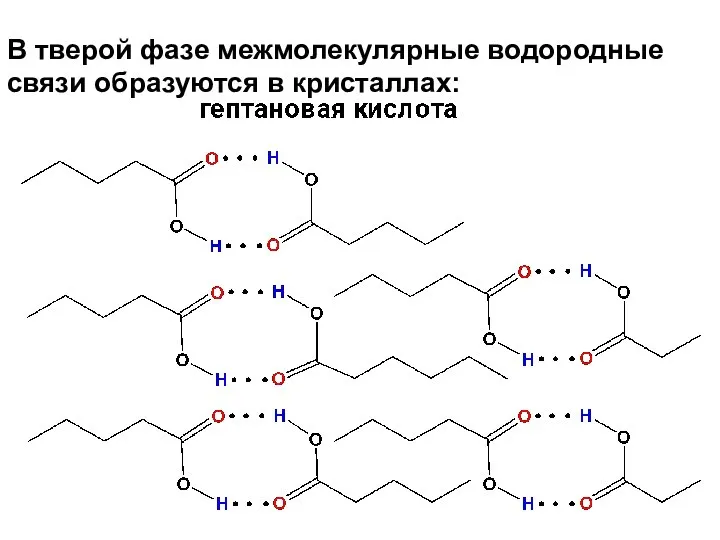
- 24. В тверой фазе межмолекулярные водородные связи образуются в кристаллах:
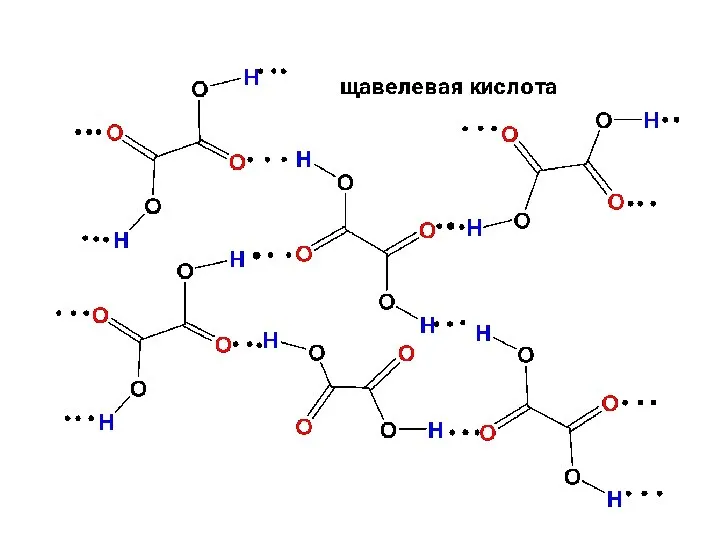
- 26. Водородные связи в карбоновых кислотах относятся к числу самых сильных: 29 кДж/моль. Низшие члены гомологического ряда
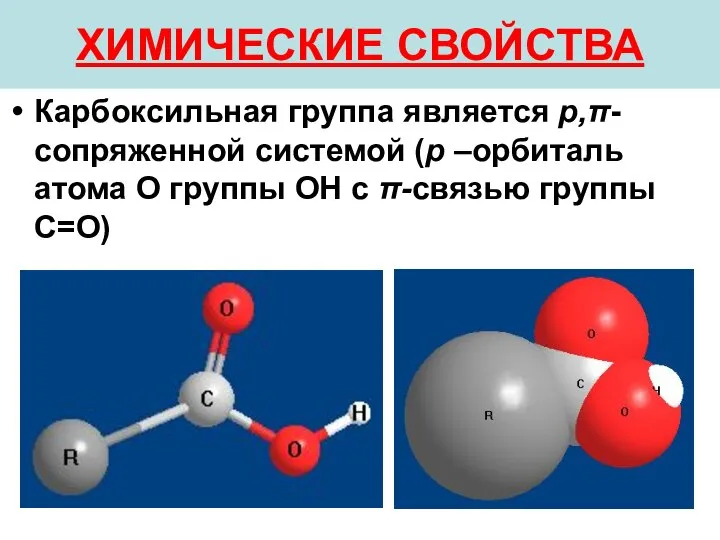
- 27. ХИМИЧЕСКИЕ СВОЙСТВА Карбоксильная группа является p,π-сопряженной системой (p –орбиталь атома О группы ОН с π-связью группы
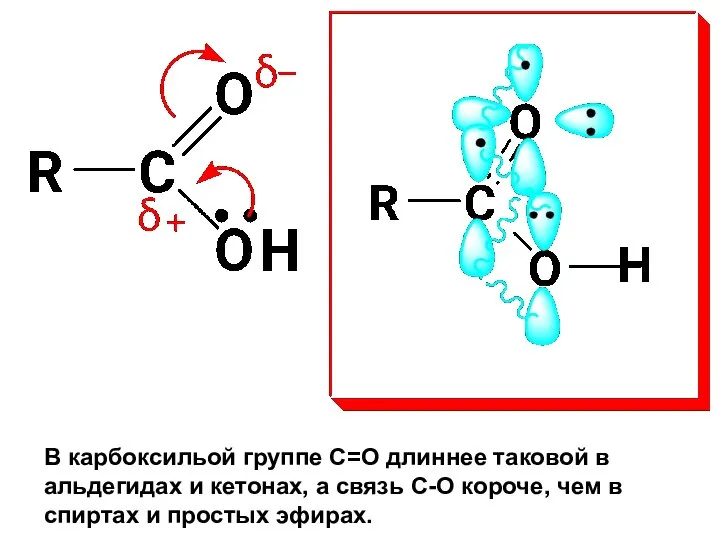
- 28. В карбоксильой группе С=О длиннее таковой в альдегидах и кетонах, а связь С-О короче, чем в
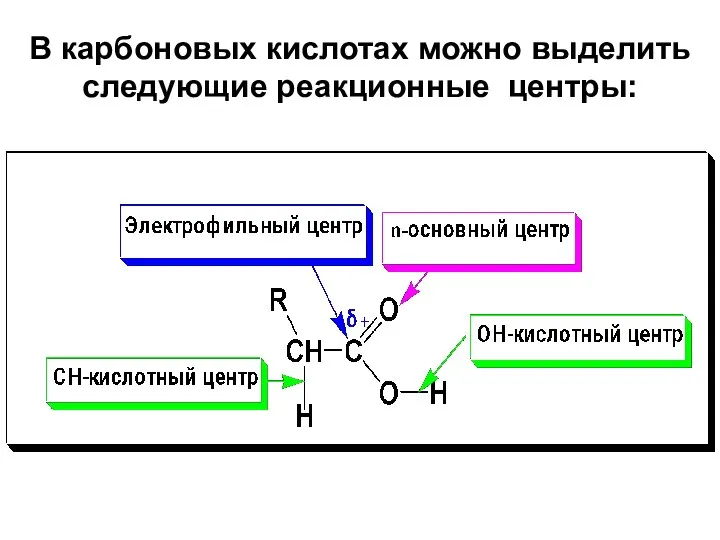
- 29. В карбоновых кислотах можно выделить следующие реакционные центры:
- 30. ОН-кислотный центр, за счет которого карбоновые кислоты проявляют кислотные свойства в реакция с основаниями; Электрофильный центр
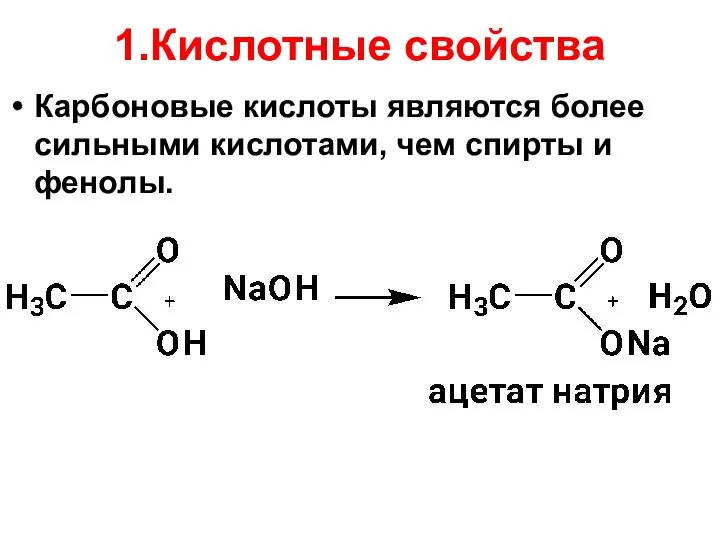
- 31. 1.Кислотные свойства Карбоновые кислоты являются более сильными кислотами, чем спирты и фенолы.
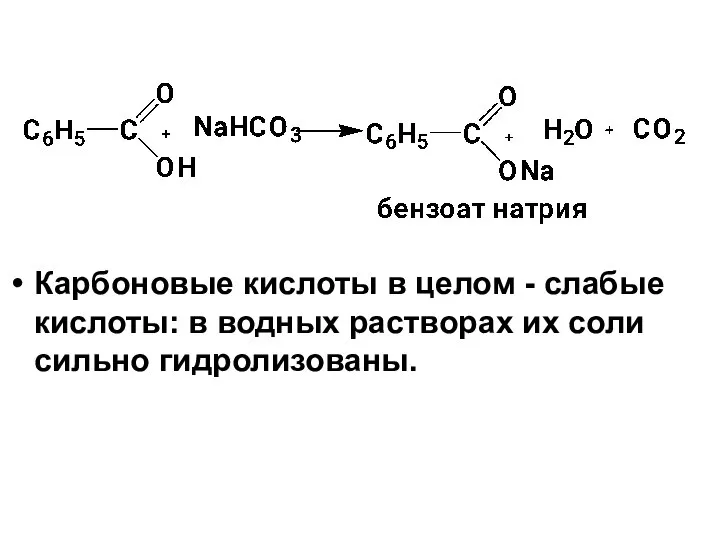
- 32. Карбоновые кислоты в целом - слабые кислоты: в водных растворах их соли сильно гидролизованы.
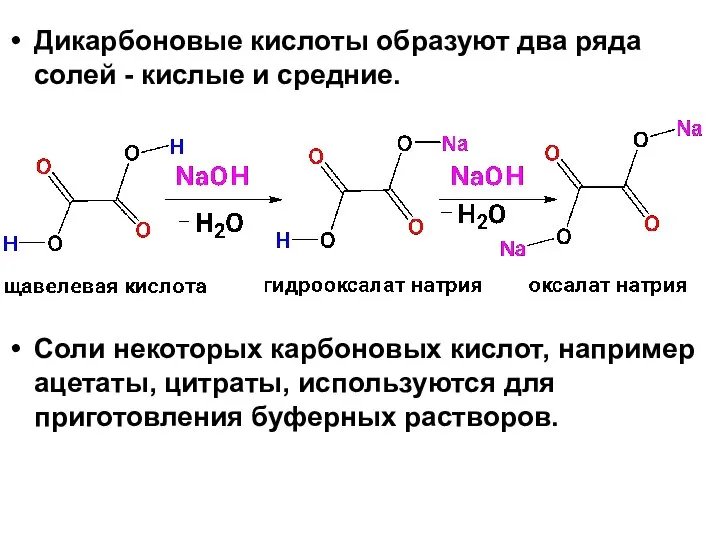
- 33. Дикарбоновые кислоты образуют два ряда солей - кислые и средние. Соли некоторых карбоновых кислот, например ацетаты,
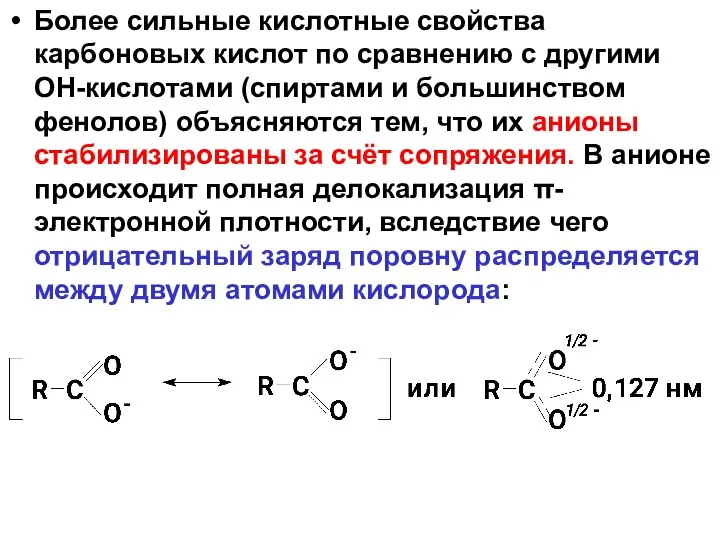
- 34. Более сильные кислотные свойства карбоновых кислот по сравнению с другими ОН-кислотами (спиртами и большинством фенолов) объясняются
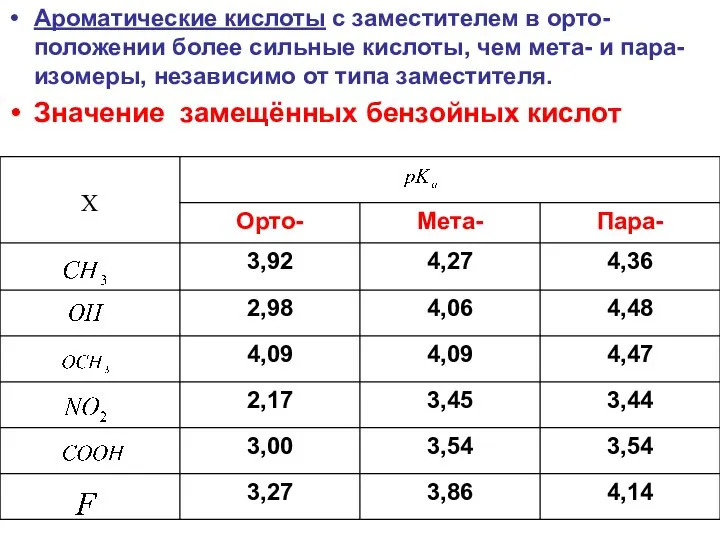
- 35. Ароматические кислоты с заместителем в орто-положении более сильные кислоты, чем мета- и пара-изомеры, независимо от типа
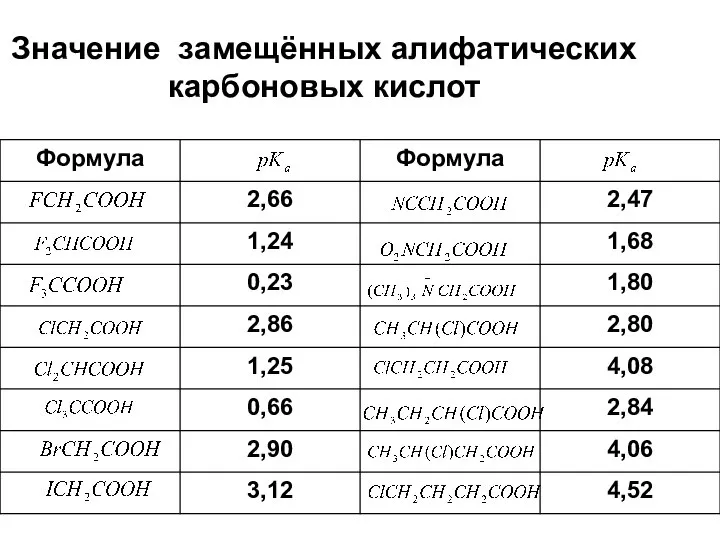
- 36. Влияние электроноакцепторных заместителей на кислотные свойства карбоновых кислот в алифатическом ряду подчиняется закономерностям как по числу
- 37. Значение замещённых алифатических карбоновых кислот
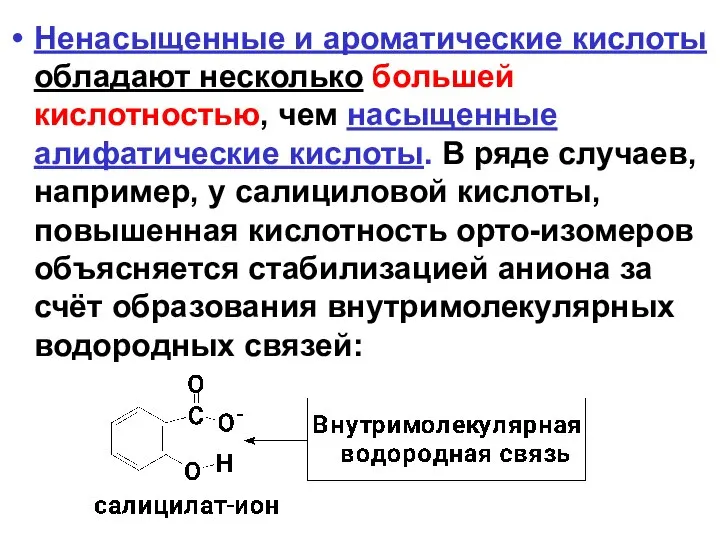
- 38. Ненасыщенные и ароматические кислоты обладают несколько большей кислотностью, чем насыщенные алифатические кислоты. В ряде случаев, например,
- 39. Вследствие затухания индуктивного эффекта второй карбоксильной группы кислотные свойства дикарбоновых кислот (по первой ступени диссоциации) уменьшаются
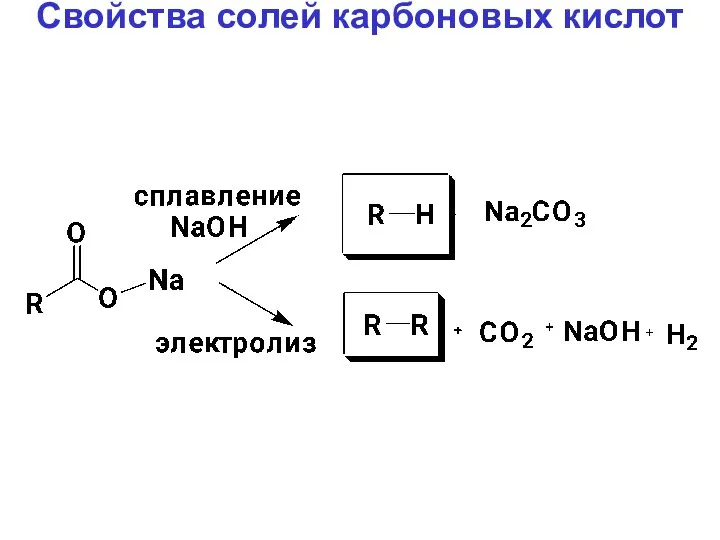
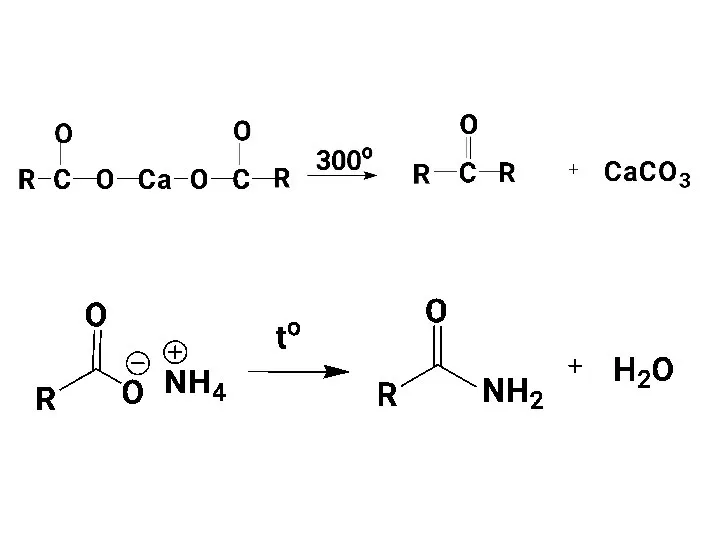
- 40. Свойства солей карбоновых кислот
- 42. 2. Реакции SN Это реакции нуклеофильного замещения у sp2-гибридизованного атома С карбоксильной группы, в результате которых
- 43. По своему результату относительно участвующего во взаимодействии нуклеофильного реагента эти реакции могут рассматриваться как реакции –
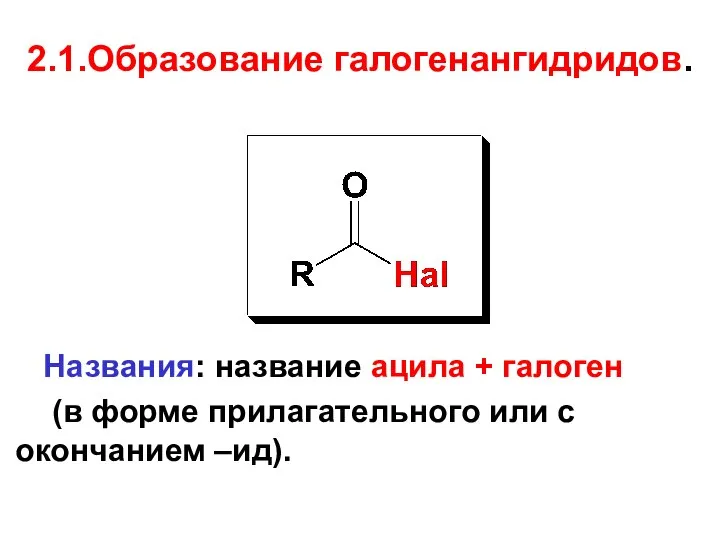
- 44. 2.1.Образование галогенангидридов. Названия: название ацила + галоген (в форме прилагательного или с окончанием –ид).
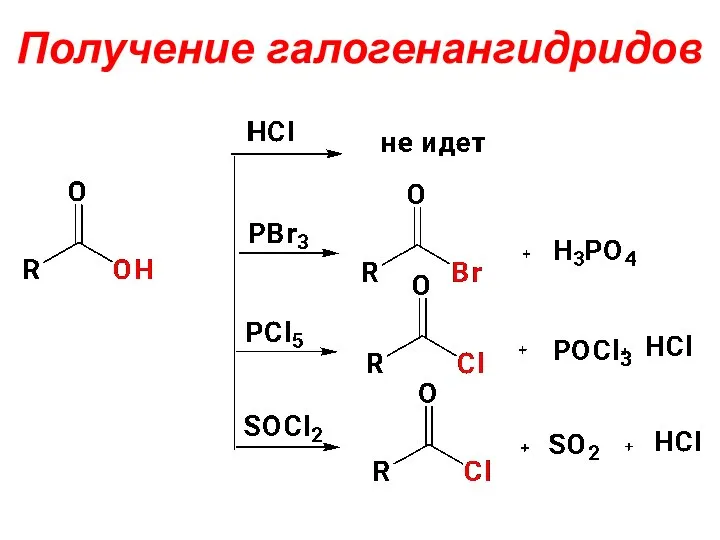
- 45. Получение галогенангидридов
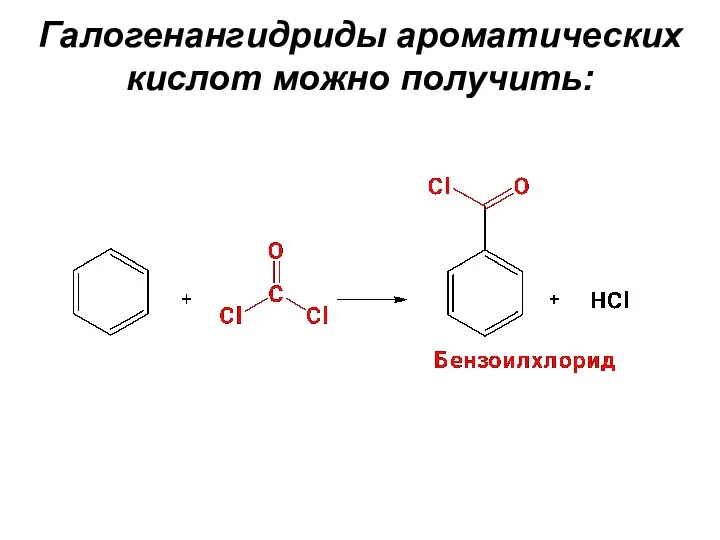
- 46. Галогенангидриды ароматических кислот можно получить:
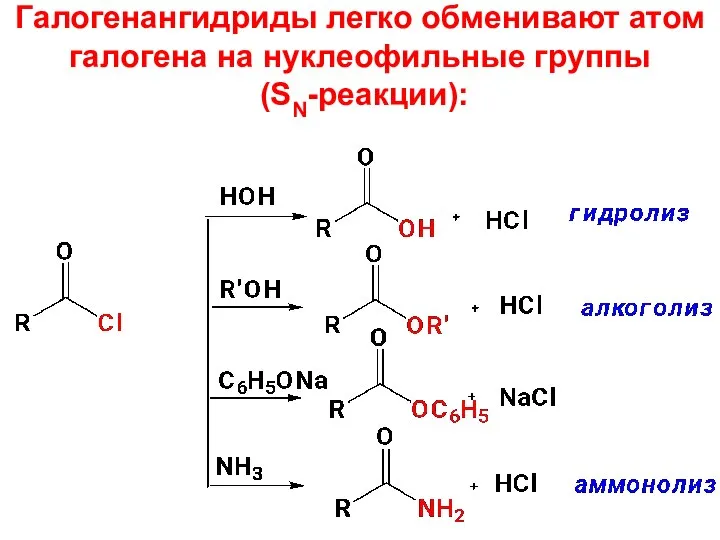
- 47. Галогенангидриды легко обменивают атом галогена на нуклеофильные группы (SN-реакции):
- 48. В этих реакциях происходит замена атома водорода или металла на ацильный остаток, поэтому эти реакции называют
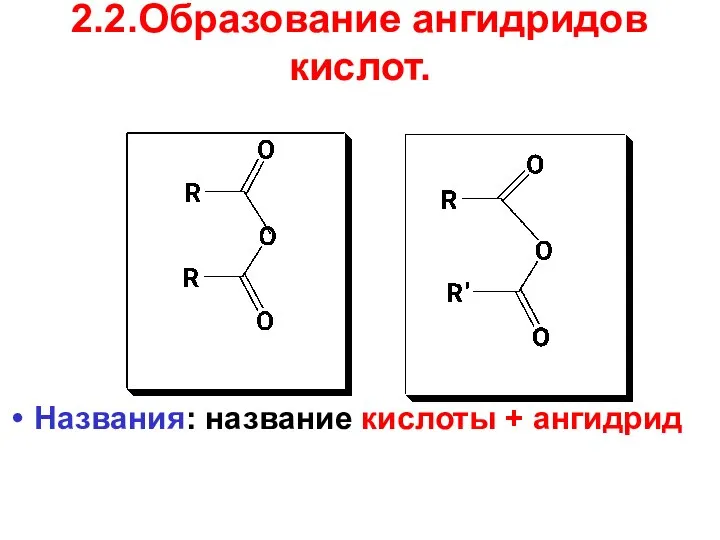
- 49. 2.2.Образование ангидридов кислот. Названия: название кислоты + ангидрид
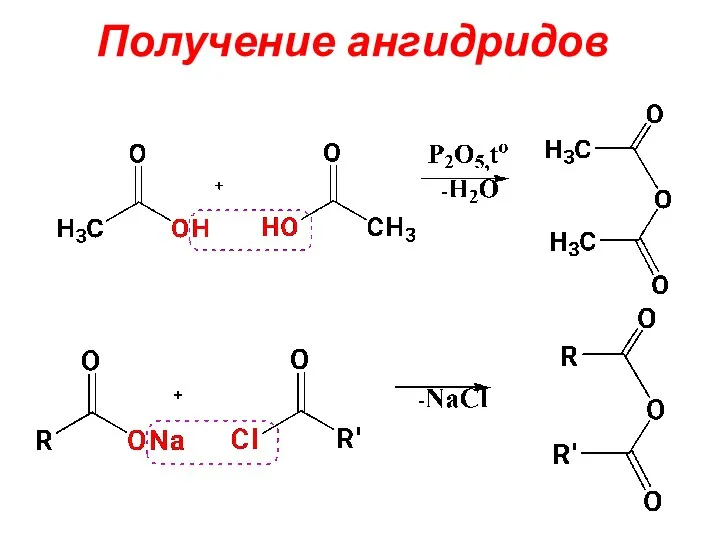
- 50. Получение ангидридов
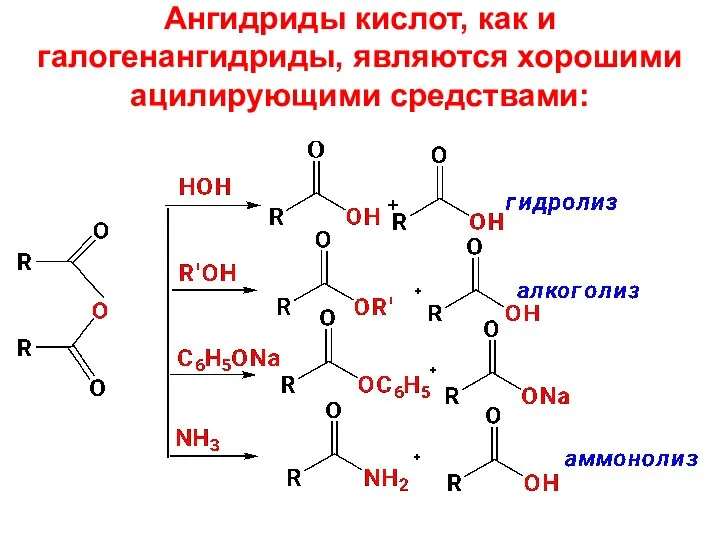
- 51. Ангидриды кислот, как и галогенангидриды, являются хорошими ацилирующими средствами:
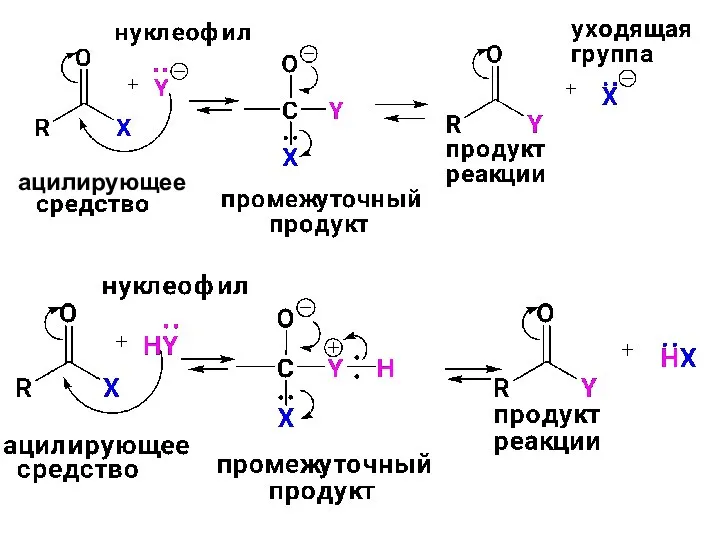
- 52. МЕХАНИЗМ РЕАКЦИЙ АЦИЛИРОВАНИЯ Реакция протекает в 2 стадии: 1. AN присоединение нуклеофила по С=О группе ацилирующего
- 53. ацилирующее
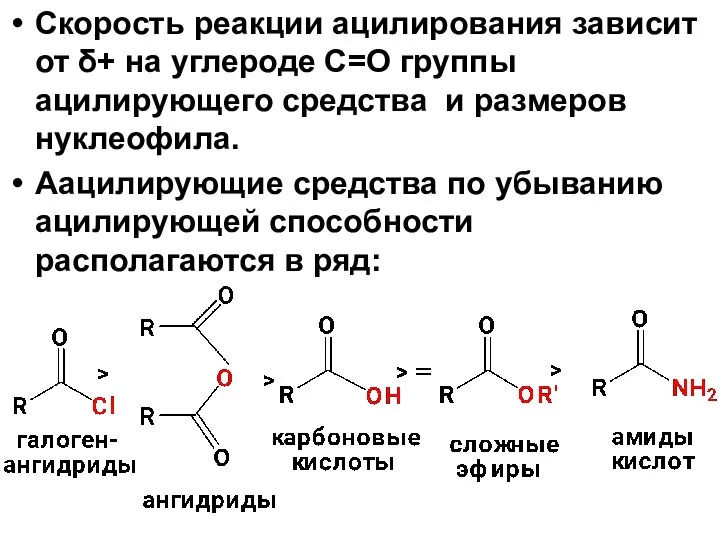
- 54. Скорость реакции ацилирования зависит от δ+ на углероде С=О группы ацилирующего средства и размеров нуклеофила. Аацилирующие
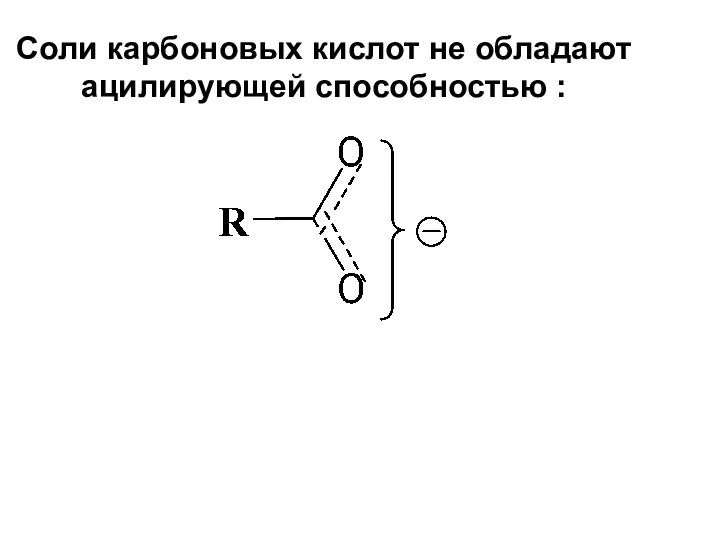
- 55. Соли карбоновых кислот не обладают ацилирующей способностью :
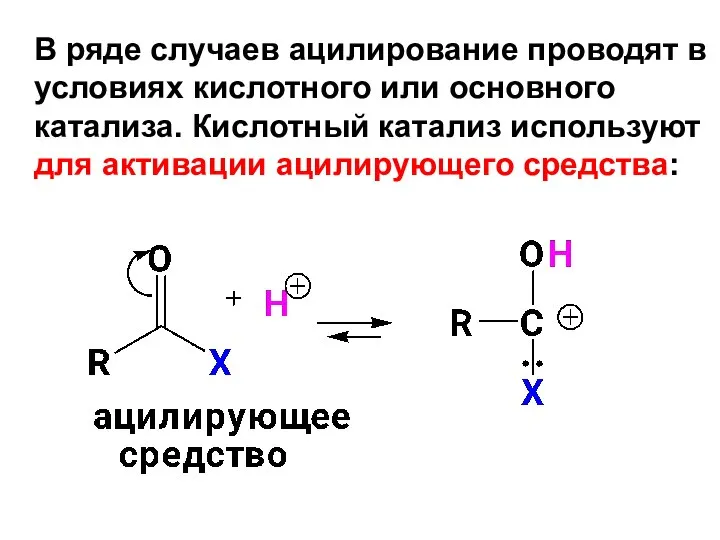
- 56. В ряде случаев ацилирование проводят в условиях кислотного или основного катализа. Кислотный катализ используют для активации
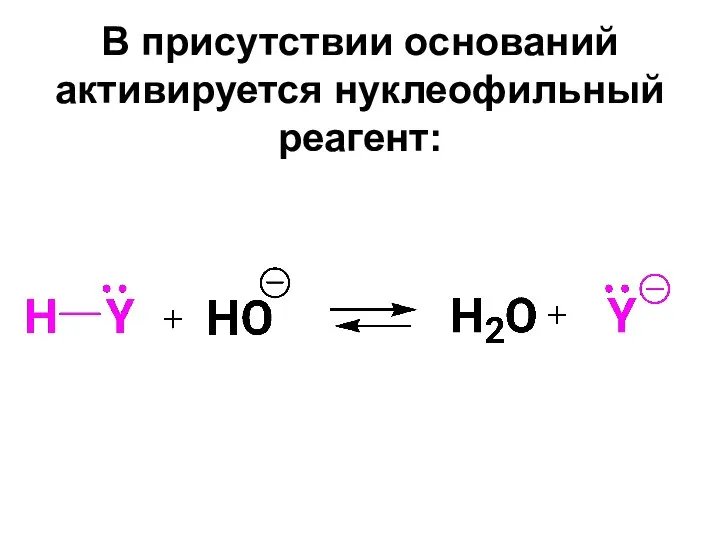
- 57. В присутствии оснований активируется нуклеофильный реагент:
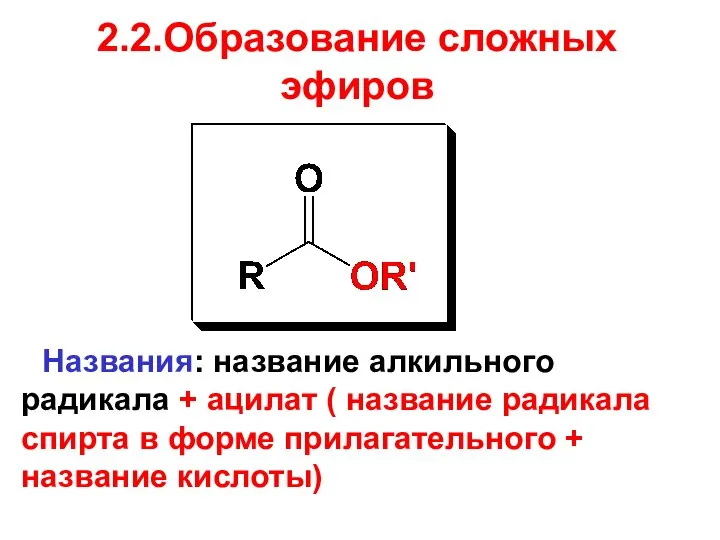
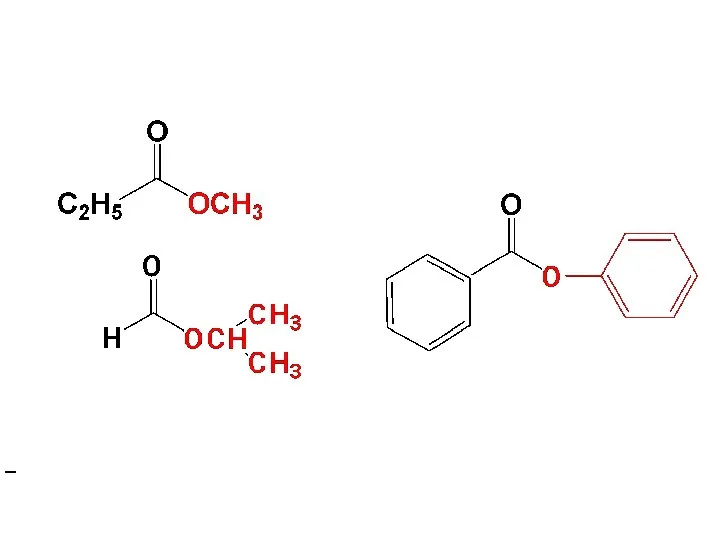
- 58. 2.2.Образование сложных эфиров Названия: название алкильного радикала + ацилат ( название радикала спирта в форме прилагательного
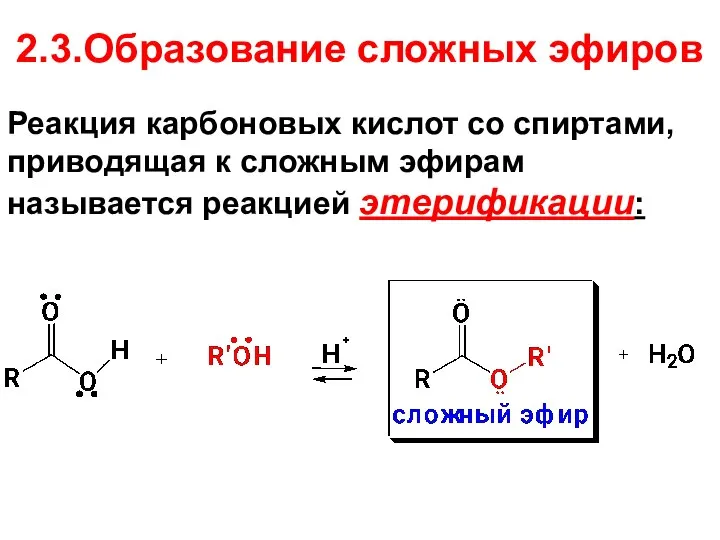
- 60. 2.3.Образование сложных эфиров Реакция карбоновых кислот со спиртами, приводящая к сложным эфирам называется реакцией этерификации:
- 61. Реакция этерификации – частный случай р-ции ацилирования. Р-ция обратима, поскольку КК и сложный эфир близки по
- 62. КК – слабое ацилирующее средство, а спирт –слабый нуклеофил, поэтому реакция этерификации идет медленно и для
- 63. В случае сильных карбоновых кислот (щавелевая, муравьиная, трифторуксусная) катализаторы не нужны. Избыток минеральной к-ты в реакции
- 64. Реакция этерификации проекает по механизму, обозначаемому ААС2 (кислотнокатализируемая ацильная бимолекулярная реакция).
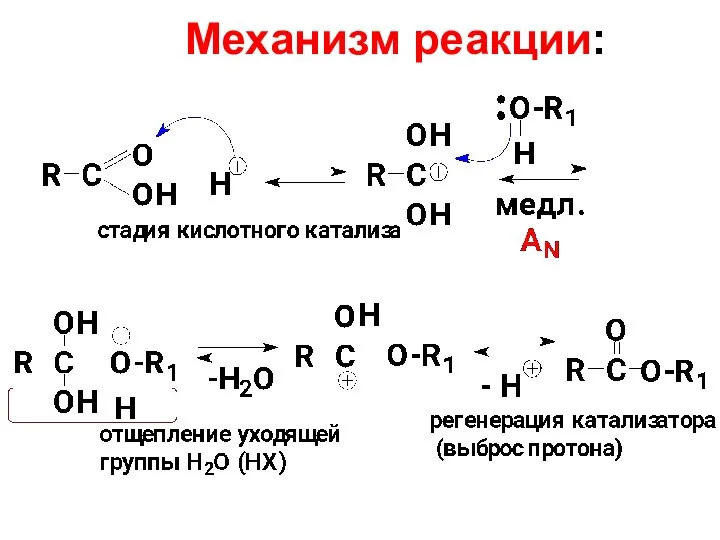
- 65. Механизм реакции:
- 66. Все стадии этерификации обратимы. Обратная реакция представляет катализируемый кислотой гидролиз сложных эфиров (реакция омыления).
- 67. Увеличение объема радикалов и в КК и в спирте снижают скорость р-ции. В ряду первичный, вторичный,
- 68. Реакции этерификации ароматических к-т, имеющих заместители в о-положении, протекают медленно и с низким выходом (из-за пространственных
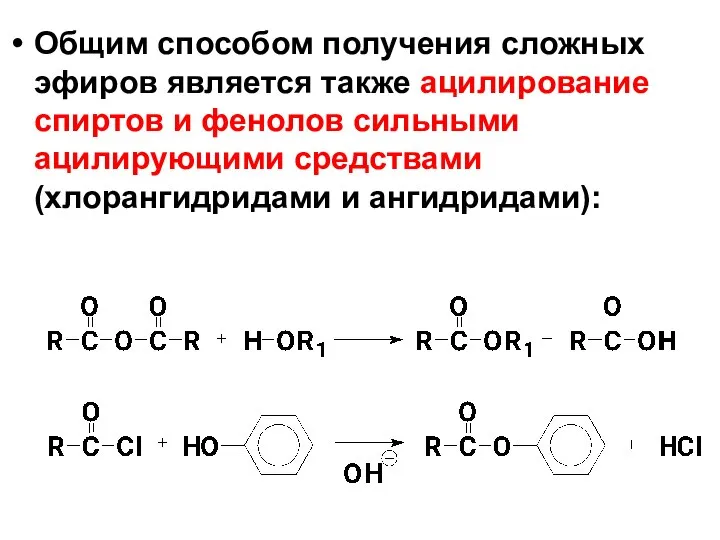
- 69. Oбщим способом получения сложных эфиров является также ацилирование спиртов и фенолов сильными ацилирующими средствами (хлорангидридами и
- 70. В случае спиртов реакция протекает легче и не требует обязательного присутствия катализатора. Ацилирование фенолов как слабых
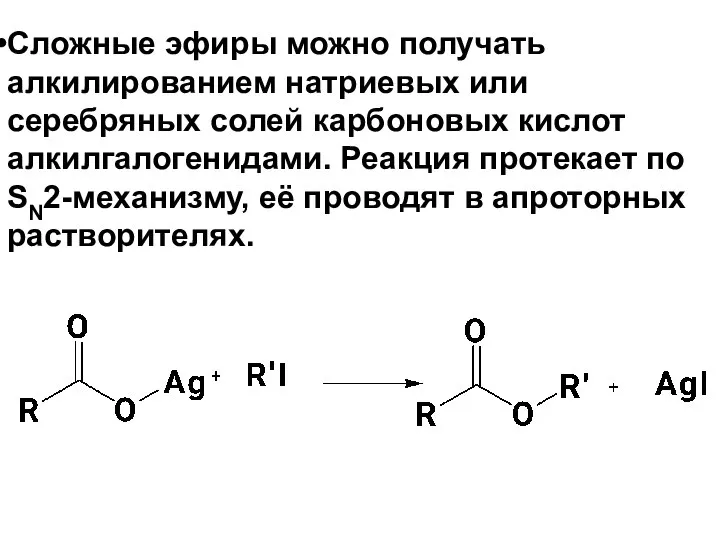
- 71. Сложные эфиры можно получать алкилированием натриевых или серебряных солей карбоновых кислот алкилгалогенидами. Реакция протекает по SN2-механизму,
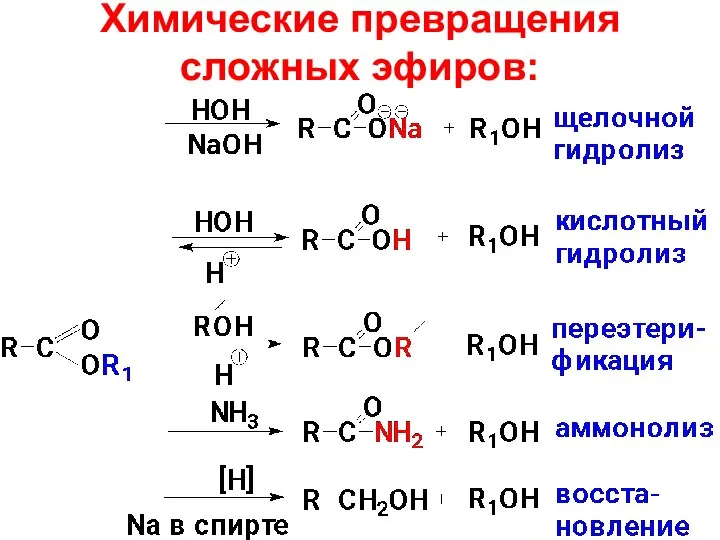
- 72. Химические превращения сложных эфиров:
- 73. Поскольку сложный эфир – слабое ацилирующее средство, то его можно подвергнуть гидролизу в присутствии катализаторов –
- 74. Щелочной гидролиз преимуществен перед кислотным: 1) протекает с большей скоростью (гидроксид-анион является более сильным и меньшим
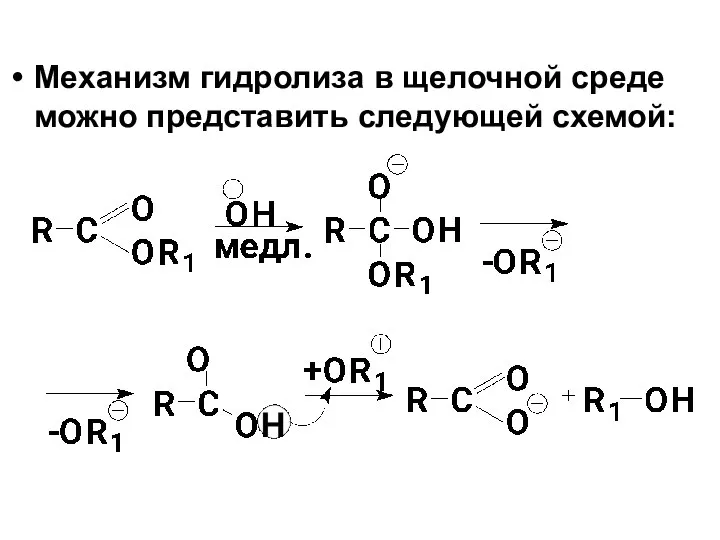
- 75. Механизм гидролиза в щелочной среде можно представить следующей схемой:
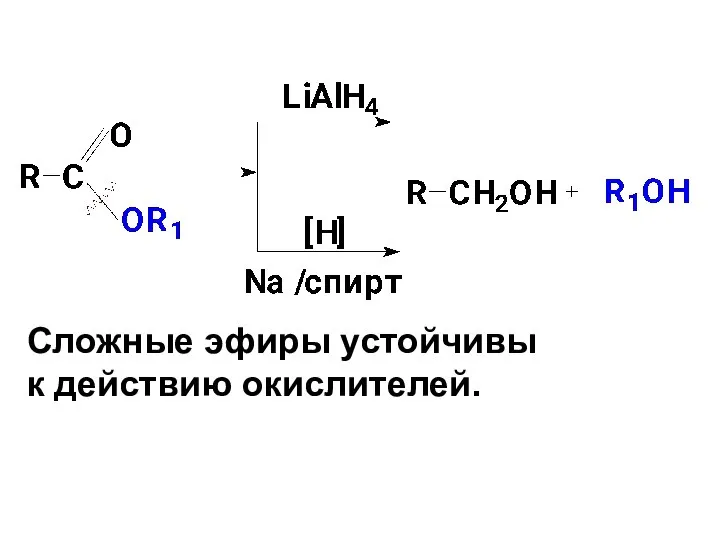
- 76. 1я стадия – Нуклеофильное присоединение гидроксид-иона по С=О группе с образованием промежуточного тетраэдрического продукта (медленная );
- 77. Переэтерификация (используется для получения метиловых эфиров жирных кислот МЭЖК - биодизеля). Переэтерификация также как и гидролиз
- 78. Сложные эфиры устойчивы к действию окислителей.
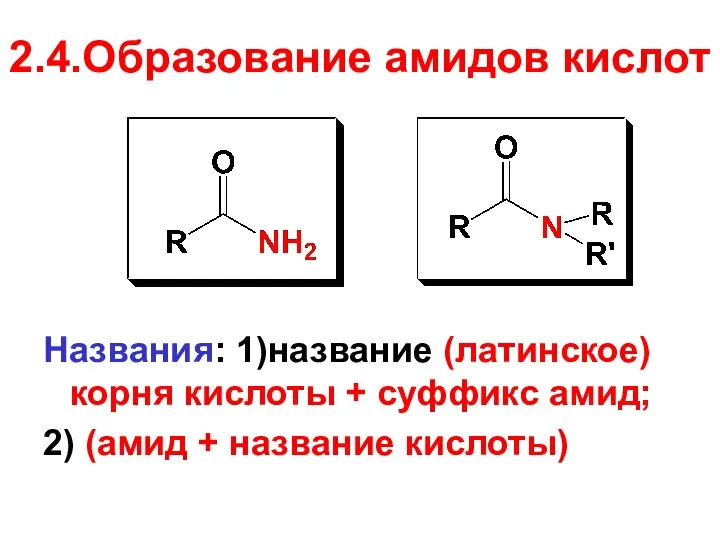
- 79. 2.4.Образование амидов кислот Названия: 1)название (латинское) корня кислоты + суффикс амид; 2) (амид + название кислоты)
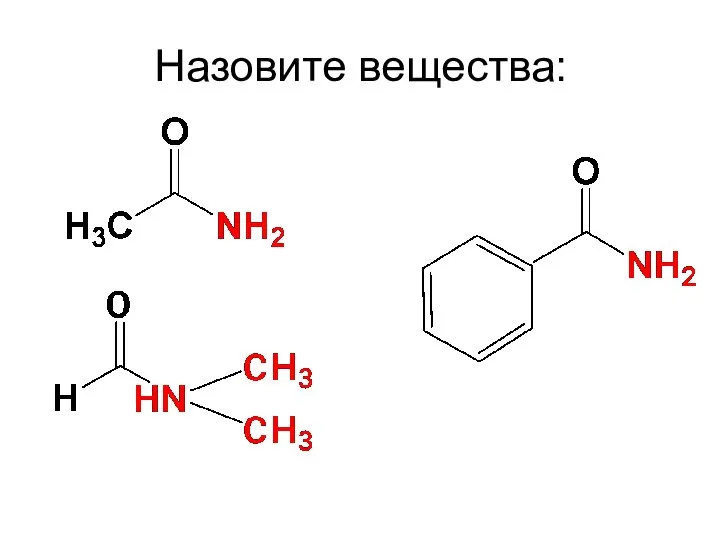
- 80. Назовите вещества:
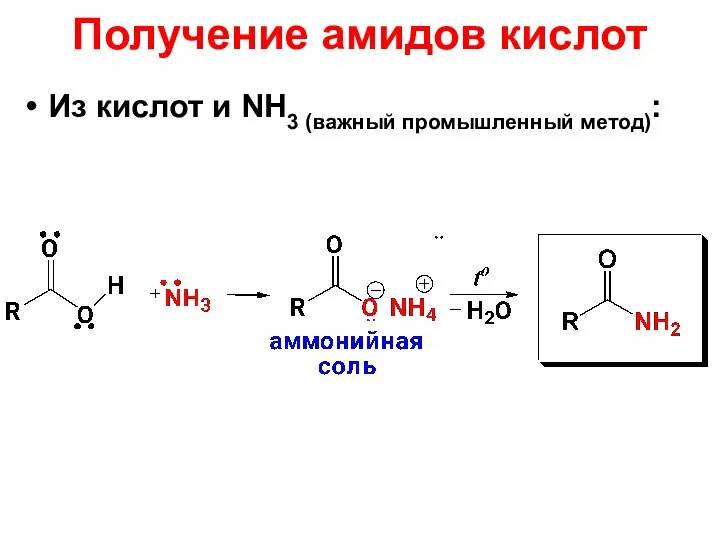
- 81. Получение амидов кислот Из кислот и NH3 (важный промышленный метод):
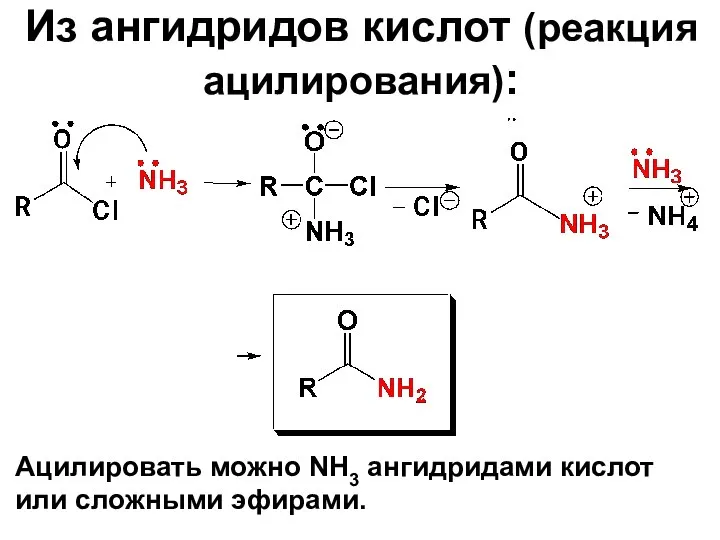
- 82. Из ангидридов кислот (реакция ацилирования): Ацилировать можно NH3 ангидридами кислот или сложными эфирами.
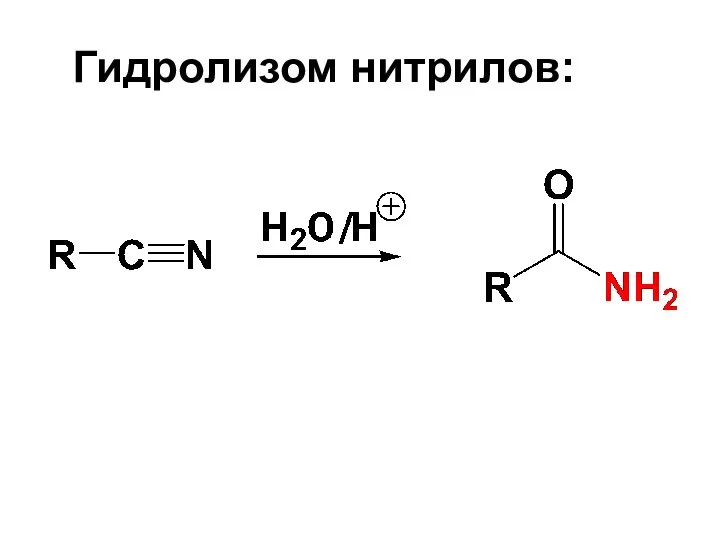
- 83. Гидролизом нитрилов:
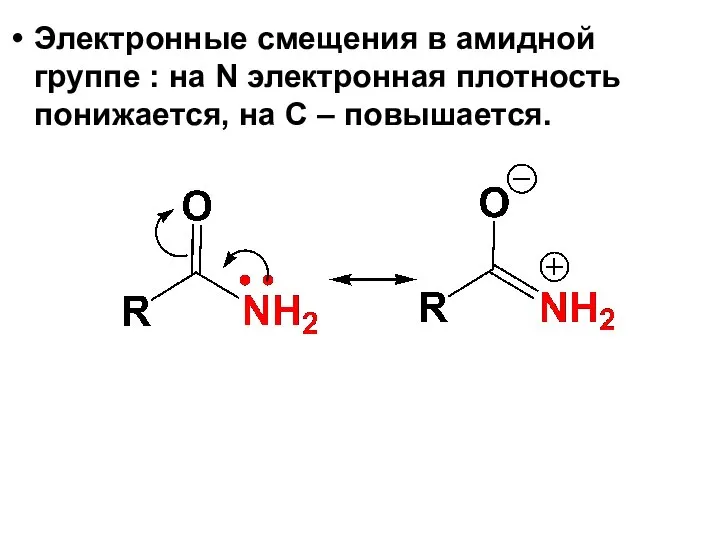
- 84. Электронные смещения в амидной группе : на N электронная плотность понижается, на С – повышается.
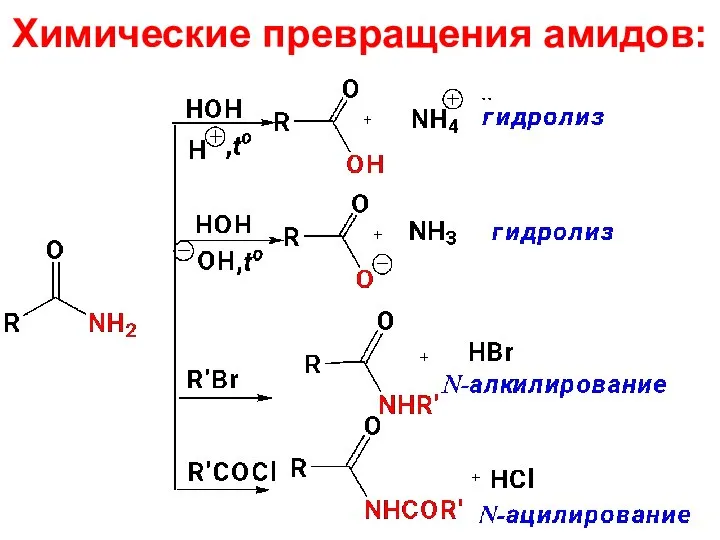
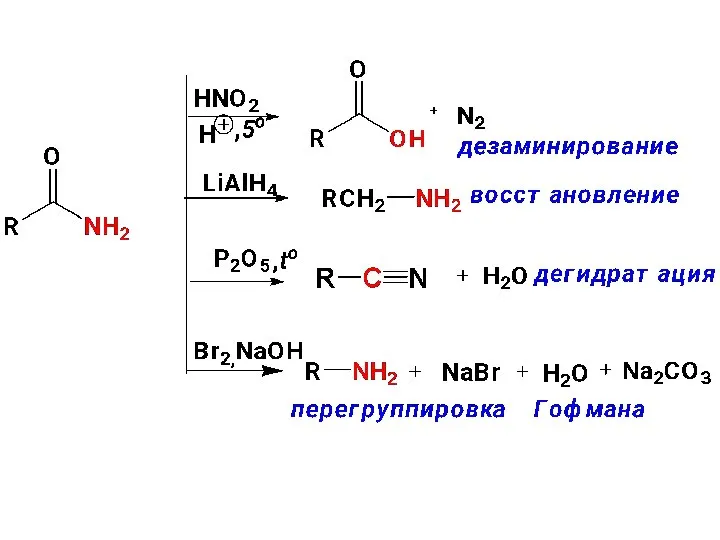
- 85. Химические превращения амидов:
- 87. Низшие амиды - жидкости, хорошо растворимые в воде, некоторые из них используют как растворители (ДМФА). В
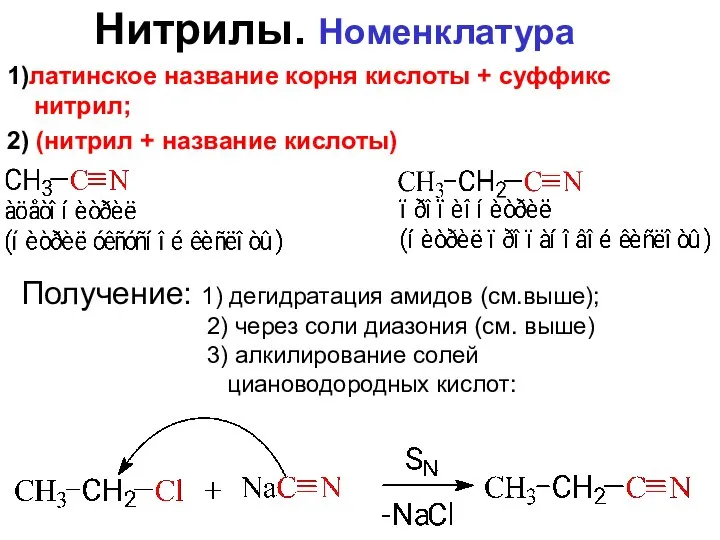
- 88. Нитрилы. Номенклатура Получение: 1) дегидратация амидов (см.выше); 2) через соли диазония (см. выше) 3) алкилирование солей
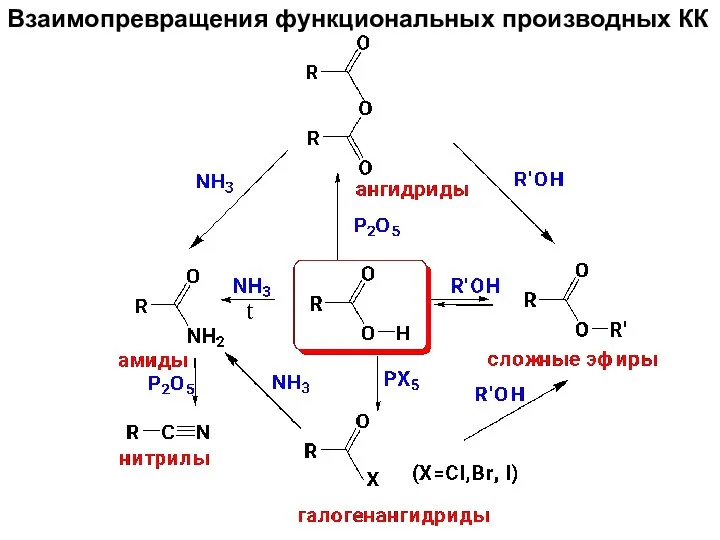
- 89. Взаимопревращения функциональных производных КК
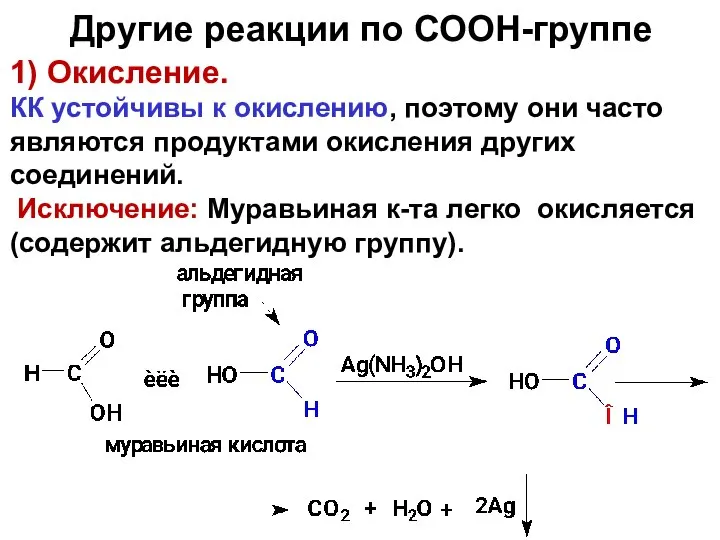
- 90. 1) Окисление. КК устойчивы к окислению, поэтому они часто являются продуктами окисления других соединений. Исключение: Муравьиная
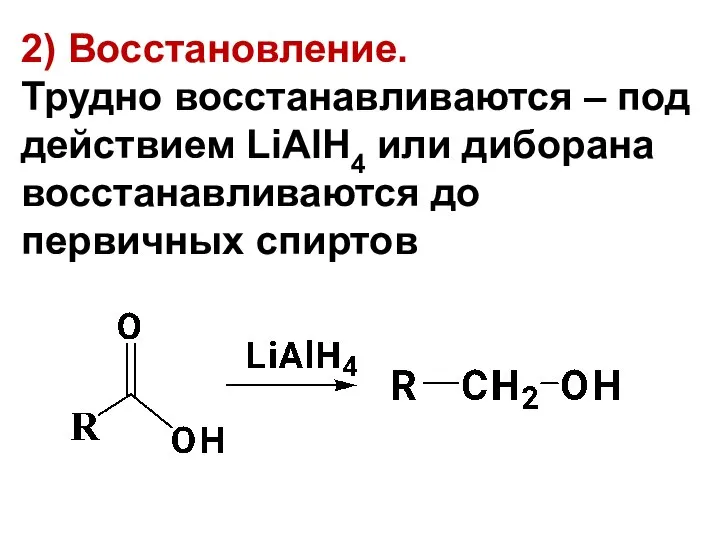
- 91. 2) Восстановление. Трудно восстанавливаются – под действием LiAlH4 или диборана восстанавливаются до первичных спиртов
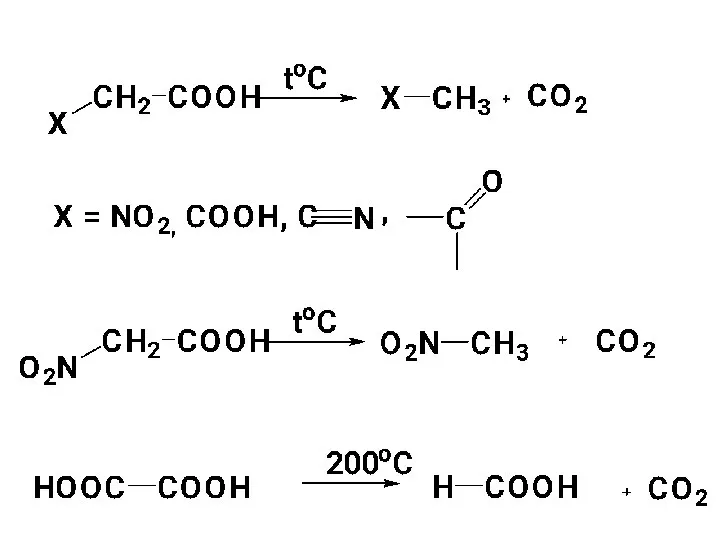
- 92. 3) Декарбоксилирование. КК довольно устойчивы к нагреванию. При высоких температурах >300 °С в присутствии катализаторов подвергаются
- 94. 1. В алифатическом ряду 1.1) Образование замещенных КК. В алифатическом ряду у КК Н-атом у α-С-атома
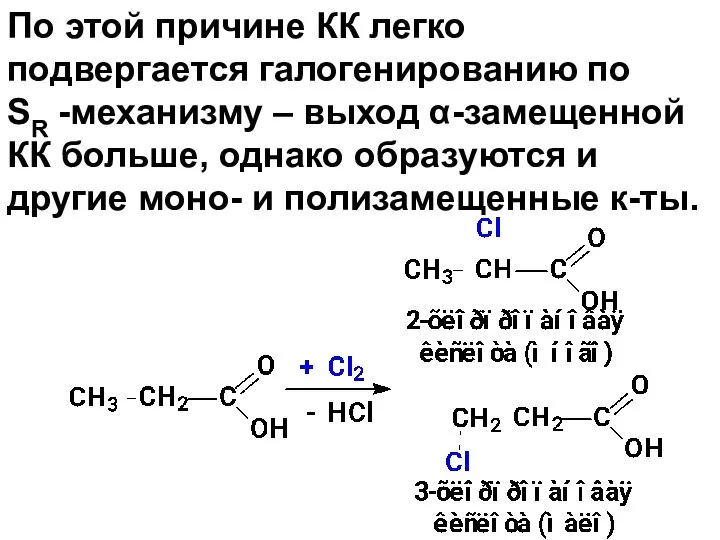
- 95. По этой причине КК легко подвергается галогенированию по SR -механизму – выход α-замещенной КК больше, однако
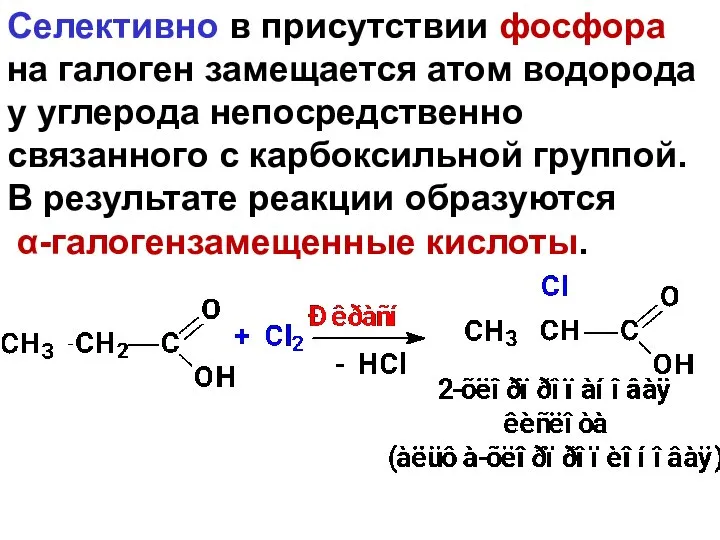
- 96. Селективно в присутствии фосфора на галоген замещается атом водорода у углерода непосредственно связанного с карбоксильной группой.
- 97. 1.2. Сложноэфирная конденсация Кляйзена: Сложные эфиры КК проявляют СН-кислотность, что обусловлено повышенной подвижностью Н-атомов у α-С-атома
- 98. Поэтому они вступают в сложноэфирную конденсацию Кляйзена. Одна молекула выступает в роли субстрата, другая – реагента
- 99. Напоминание: В ароматическом ряду СООН-группа является заместителем II рода (ЭА-заместителем) (-I и –M-эффекты) дезактивирует кольцо в
- 100. Применение КК • Муравьиная к-та. Используется в текстильной, бумажной, кожевенной пром-сти, для получения лекарственных средств, консервантов,
- 101. Высшие жирные кислоты (ВЖК). ВЖК с четным числом С-атомов (С12-С18) – они входят в состав жиров
- 102. Общие сведения о ненасыщенных и дикарбоновых кислотах В молекуле ненасыщенных кислот в радикале содержатся кратные связи.
- 103. Химическое поведение непредельных к-т связано с наличием двух активных групп СООН и двойной связи. Они вступают
- 104. Реакции АЕ (НГал, Н2О) идут против правила Марковникова
- 105. Акриловая кислота. Получают гидролизом акрилонитрила Оксосинтезом Широкое применение получили эфиры и нитрилы акриловой к-ты, полимеризацией которых
- 106. Метакриловая кислота. Большое техническое значение имеет метиловый эфир метакриловой к-ты, полимеризацией которого получают плексиглас (оргстекло).
- 107. Непредельные высшие жирные кислоты – входят в состав жидких жиров (масел): С17Н33 СOOH – олеиновая (1
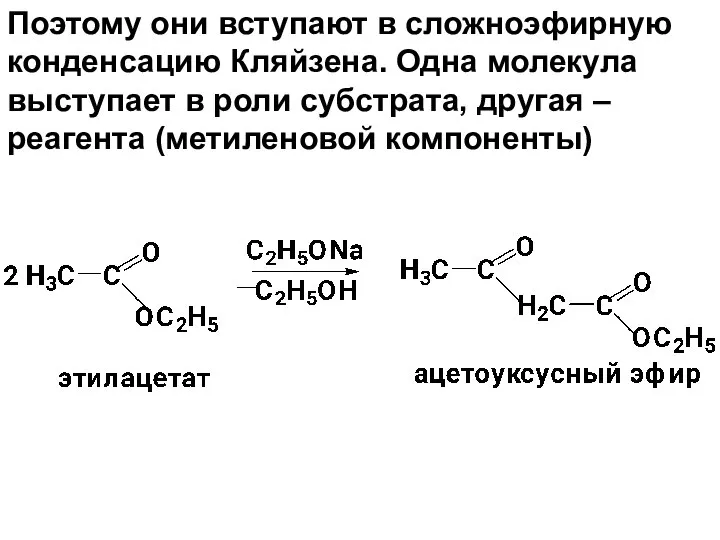
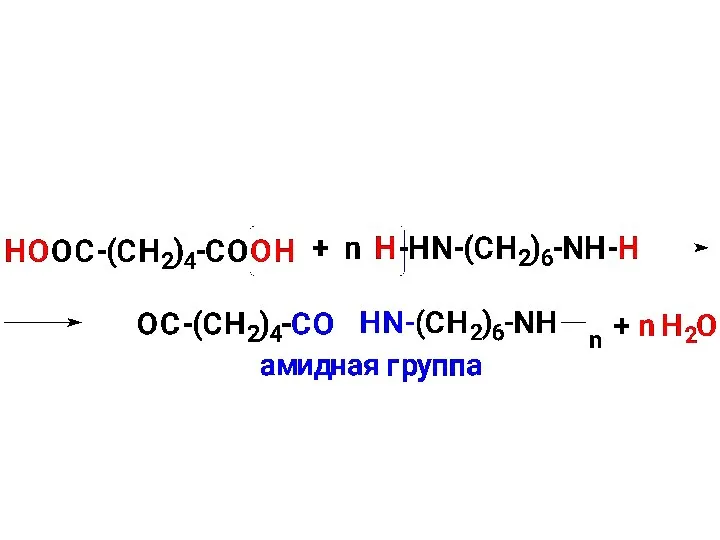
- 108. Дикарбоновые кислоты Содержат 2 СООН – гр. Могут давать два ряда производных – по одной и
- 109. Второй протон отщепляется труднее, т.к. карбоксилат-ион уменьшает способность к диссоциации второй СООН –гр. за счет водородных
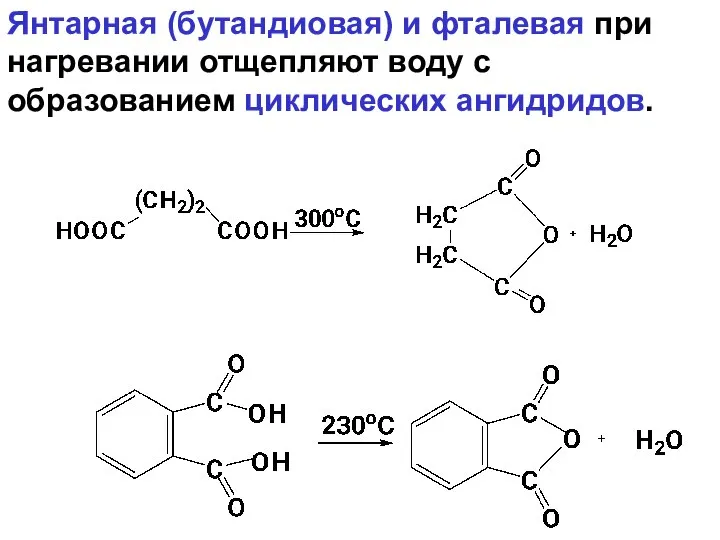
- 110. Янтарная (бутандиовая) и фталевая при нагревании отщепляют воду с образованием циклических ангидридов.
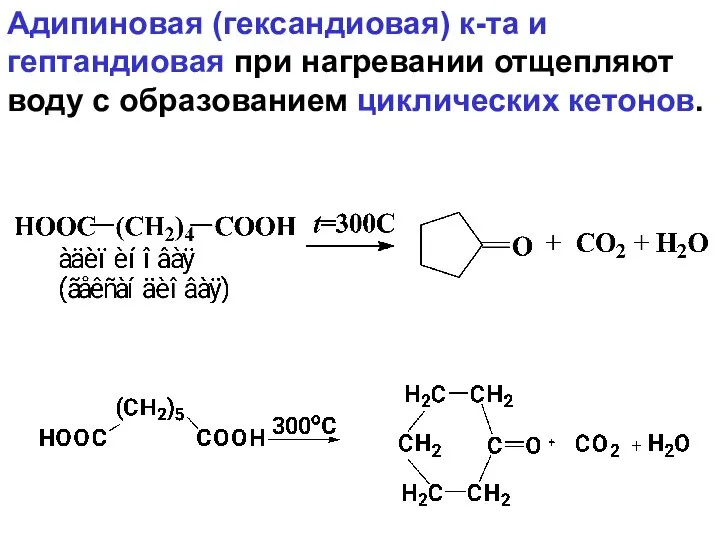
- 111. Адипиновая (гександиовая) к-та и гептандиовая при нагревании отщепляют воду с образованием циклических кетонов.
- 112. Отдельные представители Щавелевая к-та. Обладает восстанавливающими cв-вами (легко окисляется), на чем основано ее использование в аналитической
- 113. Янтарная к-та. Интерес представляет ангидрид и имид (сукцинимид) – мягкий бромирующий агент. Применяют в орг. синтезе,
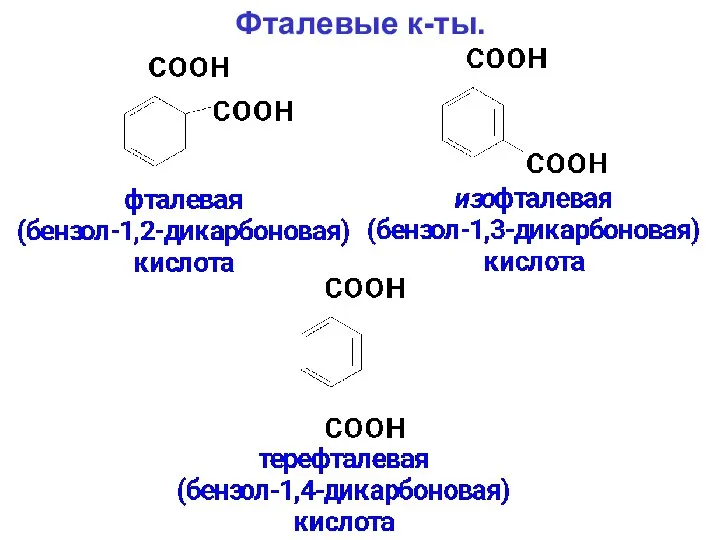
- 115. Фталевые к-ты.
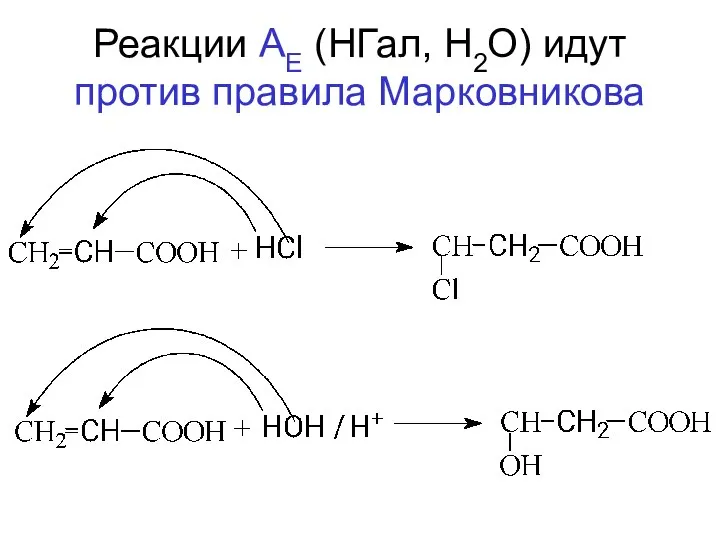
- 116. Наиболее ценные фталевая и терефталевая к-ты. Фталевая к-та склонна к образованию ангидрида, который имеет большое практическое
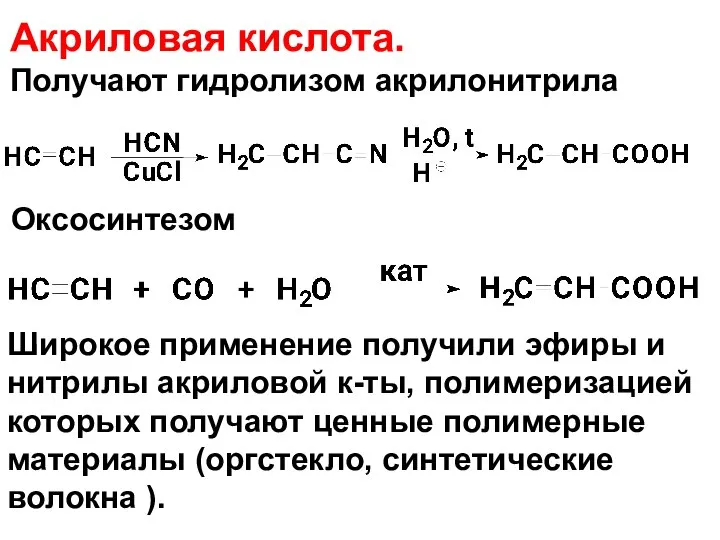
- 118. Скачать презентацию

































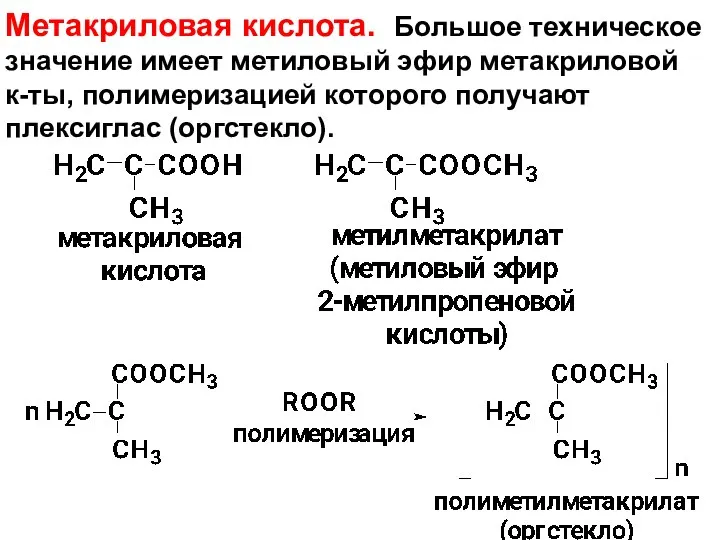






 Процессы переработки нефти
Процессы переработки нефти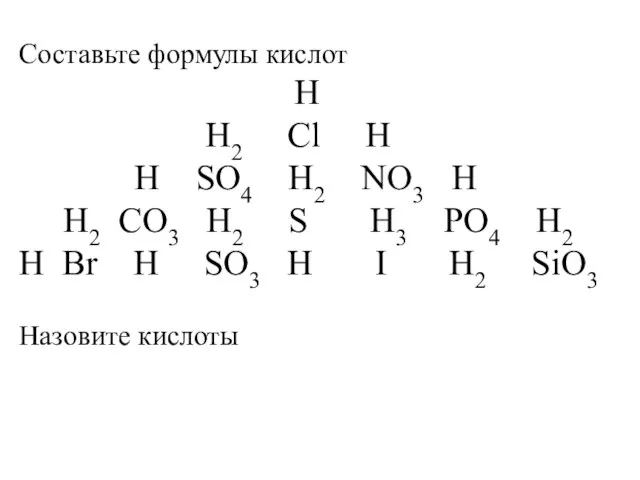 Составьте формулы кислот
Составьте формулы кислот ОГЭ ХИМИЯ 1
ОГЭ ХИМИЯ 1 Индикаторная бумага
Индикаторная бумага Влияние меди на коррозию низколегиованных сталей
Влияние меди на коррозию низколегиованных сталей Химический анализ. Исследовательская деятельность (8 класс)
Химический анализ. Исследовательская деятельность (8 класс) Углеводы. Тема 9
Углеводы. Тема 9 Презентация на тему Характеристика высокомолекулярных соединений
Презентация на тему Характеристика высокомолекулярных соединений  Классификация неорганических веществ
Классификация неорганических веществ Судьба углеродного скелета аминокислот
Судьба углеродного скелета аминокислот Реакции разложения
Реакции разложения Основания (Ме+n(ОН)-n)
Основания (Ме+n(ОН)-n) Бутилацетат. Химическая формула бутилацетата
Бутилацетат. Химическая формула бутилацетата 4.1-2 Генетическая связь+
4.1-2 Генетическая связь+ Сухая вода помогла измерить поляризацию ковалентных связей
Сухая вода помогла измерить поляризацию ковалентных связей Алюминий и его соединения
Алюминий и его соединения Классы неорганических веществ. Типы химических реакций Конкурс знаний
Классы неорганических веществ. Типы химических реакций Конкурс знаний Аналитическая химия
Аналитическая химия Новое в ЕГЭ. Химия
Новое в ЕГЭ. Химия Chemsheets AS 1009 (Electron arrangement)
Chemsheets AS 1009 (Electron arrangement)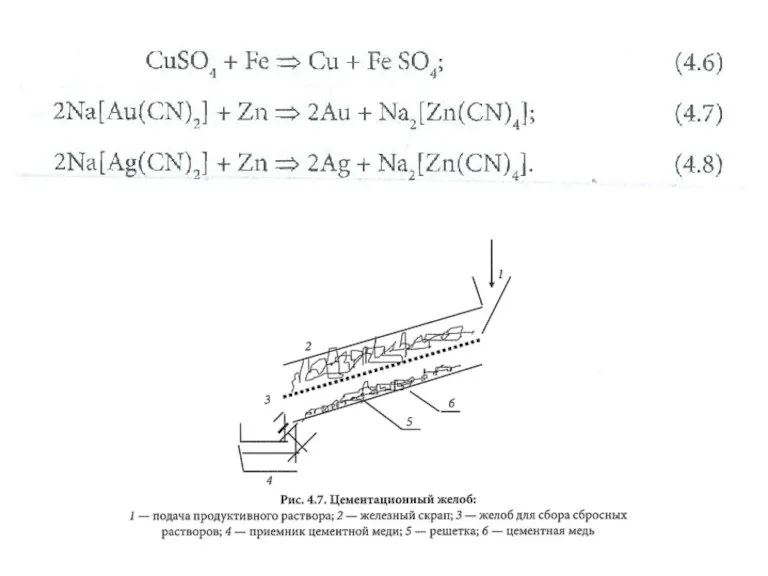 Гальванохимическая очистка. Сорбция
Гальванохимическая очистка. Сорбция Повторение по теме Химические реакции
Повторение по теме Химические реакции Жиры. Их классификация и свойства
Жиры. Их классификация и свойства Скорость химических реакций
Скорость химических реакций Кислоты основания и соли как электролиты
Кислоты основания и соли как электролиты Презентация на тему Общая характеристика подгруппы углерода
Презентация на тему Общая характеристика подгруппы углерода  Решение экспериментальных задач по теме Металлы
Решение экспериментальных задач по теме Металлы