Содержание
- 2. КЛАССИФИКАЦИЯ МЕТОДОВ АНАЛИЗА В основе всех методов анализа лежит измерение либо химического, либо физического свойства вещества,
- 3. В химических методах анализа для получения аналитического сигнала используется химическая реакция. В качестве аналитического сигнала в
- 4. Физико-химические методы анализа основаны на регистрации аналитического сигнала какого-либо физического свойства (потенциала, тока, количества электричества, интенсивности
- 5. Физические методы – методы, при реализации которых регистрируется аналитический сигнал каких-либо физических свойств (ядерные, спектральные, оптические)
- 6. Физико-химические методы анализа: электрохимические; спектральные; термические; хроматографические.
- 7. Согласно рекомендациям ИЮПАК электрохимические методы анализа можно классифицировать следующим образом: методы без протекания электродной реакции, в
- 8. В состав электролитической ячейки входят два или три электрода, один из которых — индикаторный или рабочий,
- 9. Электрод, действующий как датчик, реагируя на фактор возбуждения и на состав раствора (не оказывая влияния на
- 10. Потенциометрический метод используют для определения содержания веществ в растворе и измерения различных физико-химических величин. Потенциометрический метод
- 11. ПОТЕНЦИОМЕТРИЯ В потенциометрии обычно применяют гальванический элемент, включающий два электрода, которые могут быть погружены в один
- 12. Достоинства метода: быстрота; возможность измерения в мутных, окрашенных растворах, вязких пастах; возможность измерения в микрообъемах (измерения
- 13. Ионселективные электроды делятся на группы: Стеклянные электроды; Электронообменные электроды; Твердые электроды с гомогенной или гетерогенной мембраной;
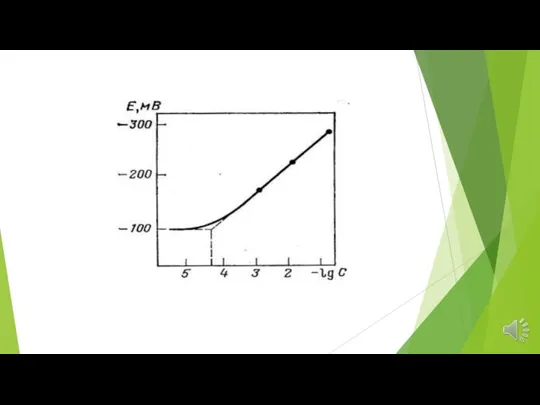
- 14. Уравнение Нернста: Е = const + RT/zF lg aион, где z — заряд потенциалопределяющего иона или
- 15. Основные характеристики электродов Предел обнаружения — минимальное количество вещества, определяемое с заданной достоверностью с помощью данного
- 17. Коэффициент селективности позволяет количественно оценить влияние мешающих ионов Y на результаты измерения концентрации определяемых ионов Х
- 18. КX.Y- коэффициент селективности электрода по отношению к иону X на фоне мешающего иона Y КX.Y =
- 19. Время отклика — время отклика τ90 определяется как время, в течение которого потенциал ионоселективного электрода изменяется
- 20. Обычно для относительно концентрированных растворов (10-4-10-2 М) время отклика не превышает 10-15 с, но для очень
- 21. Интервал определения содержания компонентов потенциометрическим методом в различных природных и промышленных объектах находится в пределах от
- 22. Иономер И-510 предназначен для определения в водных растворах активности ионов водорода (рН), окислительно-восстановительного потенциала, концентрации (активности)
- 23. АТП-02 – автоматический высокоточный потенциометрический титратор. Прибор позволяет проводить титрование, используя следующие методы: общий метод потенциометрического
- 24. Работа стеклянного электрода основана на том, что между тонкой стеклянной стенкой и водным раствором возникает разность
- 25. Стеклянный электрод Стеклянный электрод представляет собой тонкостенную мембрану из специального легкоплавкого стекла [22% Na2O, 6% CaO
- 26. Принцип действия стеклянного электрода основан на процессе ионного обмена. При погружении стеклянного электрода в раствор щелочные
- 28. В последнее время большое распространение получили так называемые комбинированные стеклянные электроды Работает в диапазоне рН от
- 29. В окислительно-восстановительных электродах в качестве индикаторных электродов часто применяют инертные металлы, например, платину, золото. Потенциал, возникающий
- 30. Металлические индикаторные электроды изготавливают из плоской металлической пластинки, скрученной проволоки или металлизированного стекла. Обычно при погружении
- 31. Твердые электроды
- 32. Чувствительный элемент: LaF3 Наиболее совершенным и высокоселективным электродом для определения F- ионов является монокристаллический лантанфторидный электрод.
- 34. . Применяют лантанфторидный электрод для определения ионов F- в различных жидких средах и твердых веществах, для
- 35. Сульфидсеребряные электроды - этот вид электродов является универсальным, с одной стороны Ag2S является основой одного из
- 36. Нижний концентрационный предел обусловлен нестабильностью растворов при концентрации ниже 10-7 М Ag+. Однако, можно измерить очень
- 37. В обычной конструкции ионселективного электрода с твердой мембранной внутренняя поверхность мембраны контактирует со стандартным раствором электролита,
- 39. Скачать презентацию



































 Ароматические углеводороды
Ароматические углеводороды Простое вещество и химический элемент азот
Простое вещество и химический элемент азот Циклические эфиры (окиси)
Циклические эфиры (окиси) Смеси веществ
Смеси веществ Моноенаминирование 4-пиронов и 4-метилен-4н-пиранов
Моноенаминирование 4-пиронов и 4-метилен-4н-пиранов Диффузия в металлах и сплавах
Диффузия в металлах и сплавах Презентация на тему Физические и химические явления 8 класс
Презентация на тему Физические и химические явления 8 класс  Электролитическая диссоциация
Электролитическая диссоциация Аналитическая химия (ЛЕКЦИЯ 1)
Аналитическая химия (ЛЕКЦИЯ 1) Получение и химические свойства металлов
Получение и химические свойства металлов Презентация на тему Альдегиды, свойства, получение, применение
Презентация на тему Альдегиды, свойства, получение, применение  Кислоты. Кислоты в животном мире
Кислоты. Кислоты в животном мире Составление химических уравнений
Составление химических уравнений Биологическое значение брома и йода
Биологическое значение брома и йода Многообразие веществ
Многообразие веществ Презентация на тему Процессы в растворах электролитическая диссоциация
Презентация на тему Процессы в растворах электролитическая диссоциация  Олигосахариды и полисахариды
Олигосахариды и полисахариды Основания. Классификация. Химические и физические свойства
Основания. Классификация. Химические и физические свойства Железо и его соединения
Железо и его соединения агрегатные состояния вещества 7 класс
агрегатные состояния вещества 7 класс Узагальнення знань з теми Вуглеводні
Узагальнення знань з теми Вуглеводні Научно-исследовательская деятельность учащихся в процессе изучения химии
Научно-исследовательская деятельность учащихся в процессе изучения химии Приобретённые: недостаточность митохондрий,
Приобретённые: недостаточность митохондрий, Стекло. Виды стекла
Стекло. Виды стекла ТЕМА: БОЛЬШОЙ КРУГОВОРОТ ВЕЩЕСТВ
ТЕМА: БОЛЬШОЙ КРУГОВОРОТ ВЕЩЕСТВ Силикатная промышленность: Вчера, сегодня, завтра
Силикатная промышленность: Вчера, сегодня, завтра Органическая химия. Теория строения органических веществ
Органическая химия. Теория строения органических веществ Общая характеристика металлов
Общая характеристика металлов