Содержание
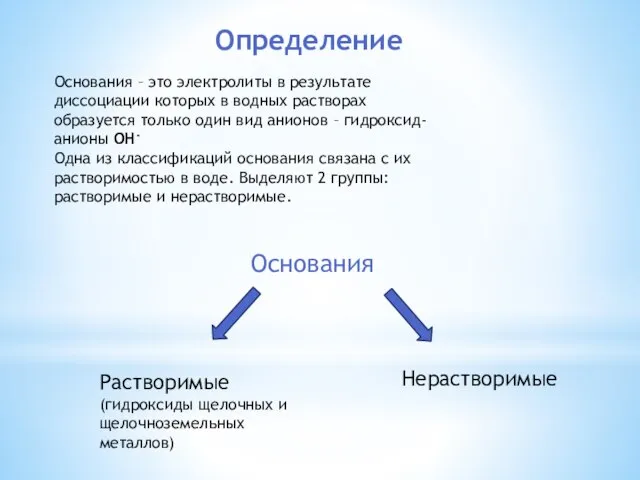
- 2. Определение Основания – это электролиты в результате диссоциации которых в водных растворах образуется только один вид
- 3. Растворимые гидроксиды Едкий натр Едкое кали Гашёная известь Известковая вода Известковое молоко Аммиачная вода
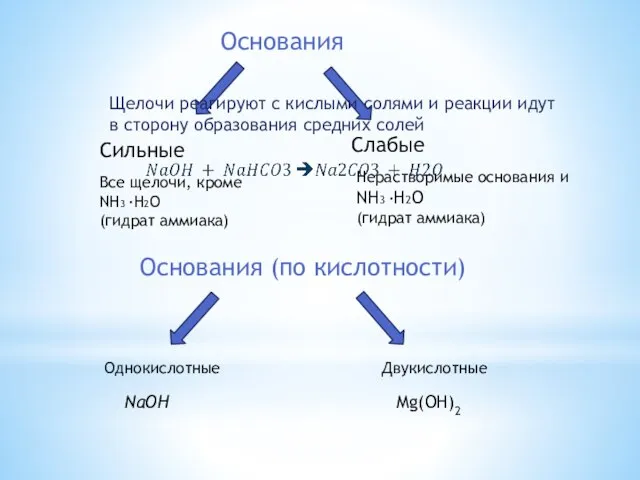
- 5. Основания Сильные Слабые Все щелочи, кроме NH3 ·H2O (гидрат аммиака) Нерастворимые основания и NH3 ·H2O (гидрат
- 6. Основные физические свойства Гидроксиды щелочных металлов – при обычных условиях твёрдые белые кристаллические вещества, мылкие на
- 7. Классификация Оснований
- 8. Классификация Оснований
- 9. Классификация Оснований
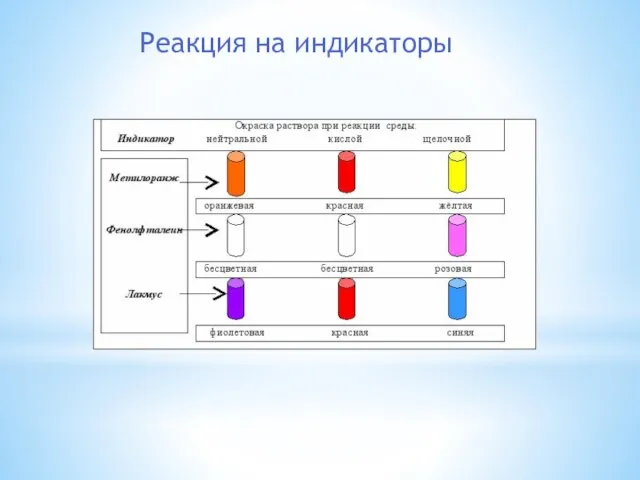
- 10. Реакция на индикаторы
- 11. Получение и применение оснований Щелочи можно получить в результате одного из следующих процессов: 1)Взаимодействие щелочи или
- 12. Получение щелочей и нерастворимых оснований Метал + вода Основный оксид + вода Электролиз водных растворов Щелочи
- 13. Химические свойства I. Без изменения СТОКа 2. Щелочь + кислота (реакция нейтрализации) Сильная кислота: Ортофосфорная кислота:
- 14. Химические свойства 3. Щелочь + кислотный оксид Сплав
- 15. Химические свойства t
- 16. Химические свойства 7. Раствор щелочи + раствор соли = основания( ) II. C изменением СТОКа
- 17. Химические свойства 9. Реакции диспропорционирования Холодный р-р Горячий р-р Гипофосфит натрия
- 18. Химические свойства 10. Межмолекулярные 11. Щелочи реагируют с кислыми солями и реакция идет в сторону обратную
- 19. Химические свойства 12.C органическими веществами C карбоновыми кислотами С фенолами С аминокислотами С алкилгалогенидами С солями
- 20. Химические свойства III. Свойства нерастворимых оснований 1. Нерастворимое основание + сильная кислота = раствор соли +
- 22. Скачать презентацию
















 Кремний и его соединения
Кремний и его соединения Циклоалканы или цикланы – циклические насыщенные углеводороды
Циклоалканы или цикланы – циклические насыщенные углеводороды Металлы. Общая характеристика ( 9 класс)
Металлы. Общая характеристика ( 9 класс) Типы химических реакций в неорганической химии
Типы химических реакций в неорганической химии Типы химических реакций. Реакции обмена
Типы химических реакций. Реакции обмена Спирты
Спирты Презентация на тему Законы электролиза
Презентация на тему Законы электролиза  Алкены
Алкены Chemia kosmetyczna
Chemia kosmetyczna Development of the system of concepts on the topic redox reactions in the school course of inorganic chemistry
Development of the system of concepts on the topic redox reactions in the school course of inorganic chemistry Теория химического строения органических веществ А.М. Бутлерова
Теория химического строения органических веществ А.М. Бутлерова Скорость химической реакции
Скорость химической реакции Строение комплексных соединений. Лекция 4
Строение комплексных соединений. Лекция 4 Чистые вещества и смеси. Использование химического анализа
Чистые вещества и смеси. Использование химического анализа Определение плотности газообразного вещества по плотности
Определение плотности газообразного вещества по плотности Решение заданий ОГЭ по химии (1 - 15)
Решение заданий ОГЭ по химии (1 - 15) Тайна алмазов
Тайна алмазов Исследование концентрированных заквасок для сметаны
Исследование концентрированных заквасок для сметаны Техника безопасности на уроках химии
Техника безопасности на уроках химии Адсорбция. Механизмы адсорбции. Термодинамика адсорбции. Лекция 5
Адсорбция. Механизмы адсорбции. Термодинамика адсорбции. Лекция 5 Аминокислоты
Аминокислоты Структура, свойства и термическая обработка железоуглеродистых сплавов
Структура, свойства и термическая обработка железоуглеродистых сплавов Изучение процесса замерзания воды
Изучение процесса замерзания воды Электрохимические процессы
Электрохимические процессы Расчет псевдокритических свойств конденсатного газа и пластовых газоконденсатных жидкостей. Анализ рекомбинированных проб
Расчет псевдокритических свойств конденсатного газа и пластовых газоконденсатных жидкостей. Анализ рекомбинированных проб Цинк (Zn). Свойства
Цинк (Zn). Свойства Тренинг по теме Валентность
Тренинг по теме Валентность Железо - основа всего мира
Железо - основа всего мира