Содержание
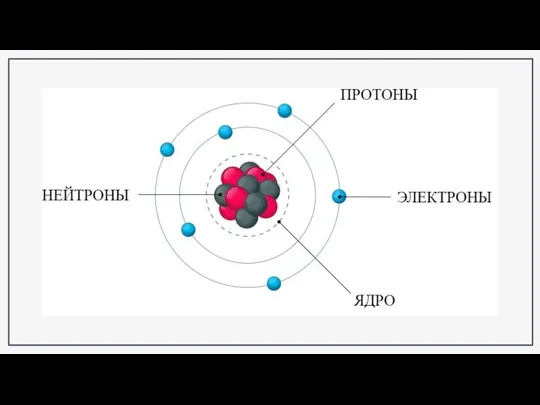
- 3. Квантовые числа электронов Первое квантовое число называется главным квантовым числом. Оно характеризует энергию электрона, обозначается буквой
- 4. Для описания энергии электронов на подуровнях ввели второе квантовое число, которое называется побочным или орбитальным квантовым
- 8. Построение схемы строения электронных оболочек на примере гелия (Не), бора (B), кислорода (O), фтора (F) 1.
- 9. Построение схемы строения электронных оболочек на примере гелия (Не), бора (B), кислорода (O), фтора (F) Определим
- 10. А теперь определим число электронов на каждом энергетическом уровне на наших примерах: Гелий (Не) – два
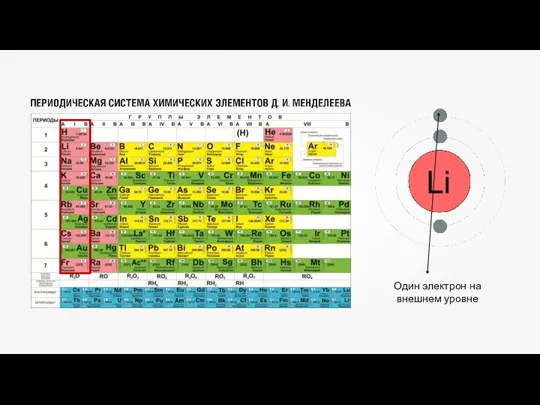
- 11. Бор (B) – пять электронов, из которых два располагаются на первом энергетическом уровне, максимально заполнив его,
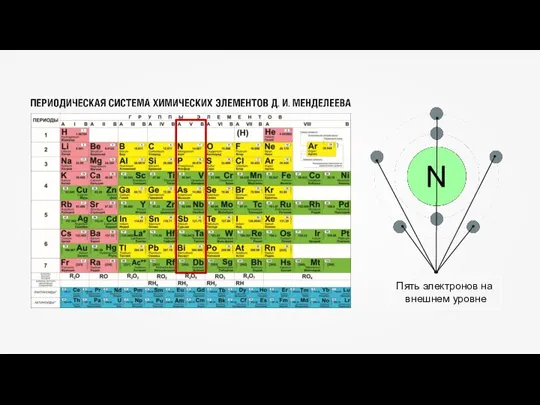
- 12. Кислород (O) – восемь электронов, из которых два располагаются на первом энергетическом уровне, максимально заполнив его,
- 13. Фтор (F) – девять электронов, из которых два располагаются на первом энергетическом уровне, максимально заполнив его,
- 14. На подуровнях электроны находятся на орбиталях, которые также обозначают, как и подуровни, буквами: s, p, d,
- 15. Квантовые числа электронов Электроны обладают магнитными свойствами и во внешнем магнитном поле могут менять ориентацию. Поэтому
- 16. Например, три p-орбитали направлены вдоль осей пространственных координат х, у, z. Различают рх, ру, рz- орбитали.
- 17. Квантовые числа электронов Четвертое квантовое число - спиновое, которое обозначается буквой s и характеризует собственный момент
- 18. Строение электронной оболочки атома. Порядок заполнения электронами уровней и подуровней. Принцип наименьшей энергии. Заполнение уровней и
- 19. Если сумма главного и побочного квантовых чисел для разных подуровней одинаковая, то заполняется первым тот подуровень,
- 20. 2. Правило Гунда. В основном состоянии атома электроны заполняют подуровни таким образом, чтобы суммарный спин был
- 21. 3. Принцип Паули. В атоме не может быть двух электронов, у которых все четыре квантовых числа
- 23. Скачать презентацию

















 Презентация на тему Подгруппа кислорода
Презентация на тему Подгруппа кислорода  Сера - химический элемент и простое вещество
Сера - химический элемент и простое вещество Презентация на тему Сложные эфиры
Презентация на тему Сложные эфиры  Презентация на тему Общая характеристика подгруппы углерода
Презентация на тему Общая характеристика подгруппы углерода  Нефть - природный источник углеводородов
Нефть - природный источник углеводородов Белки́ (протеины, полипепти́ды)
Белки́ (протеины, полипепти́ды) Обращеннофазовая хроматография высокого разрешения RP HPLC
Обращеннофазовая хроматография высокого разрешения RP HPLC Алкины: получение и применение
Алкины: получение и применение Презентация на тему Экологические риски при добыче и переработке нефти
Презентация на тему Экологические риски при добыче и переработке нефти  Ковалентная химическая связь
Ковалентная химическая связь Основные понятия химической кинетики. Скорость химической реакции
Основные понятия химической кинетики. Скорость химической реакции Оксиды. Сложные вещества
Оксиды. Сложные вещества Презентация на тему Серная кислота, свойства серной кислоты
Презентация на тему Серная кислота, свойства серной кислоты  Презентация на тему Кристаллические решетки
Презентация на тему Кристаллические решетки  (Bu4N)2[Mo6I8(OOCCH3)6]. Синтез
(Bu4N)2[Mo6I8(OOCCH3)6]. Синтез Магний (Mg, Magnesium). Общая характеристика магния
Магний (Mg, Magnesium). Общая характеристика магния Аналитическая химия (ЛЕКЦИЯ 1)
Аналитическая химия (ЛЕКЦИЯ 1) Материаловедение и технология конструкционных материалов
Материаловедение и технология конструкционных материалов Получение антибиотиков
Получение антибиотиков Строение органических молекул. (Лекция 2)
Строение органических молекул. (Лекция 2) Порох. Сера, халькогены
Порох. Сера, халькогены Первые попытки классификации химических элементов
Первые попытки классификации химических элементов Структура електронної оболонки атома. Енергетичні рівні та підрівні
Структура електронної оболонки атома. Енергетичні рівні та підрівні Строение атома. История открытия
Строение атома. История открытия Закон эквивалентов
Закон эквивалентов Камень, скользящий на льду
Камень, скользящий на льду Спирты или алканолы
Спирты или алканолы Цинк (Zn). Свойства
Цинк (Zn). Свойства