Слайд 2 Что такое кислоты ??
Кислоты -
это сложные вещества, в

состав которых обычно входят атомы водорода, способные замещаться на атомы металлов, и кислотный остаток. Водные растворы кислот имеют кислый вкус, обладают раздражающим действием, способны менять окраску индикаторов, отличаются рядом общих химических свойств.
Слайд 3В 1778 французский химик Антуан Лавуазье предположил, что кислотные свойства обусловлены наличием

в молекуле атомов кислорода. Эта гипотеза быстро доказала свою несостоятельность, так как многие кислоты не имеют в своём составе кислорода, в то время как многие кислородсодержащие соединения не проявляют кислотных свойств. Тем не менее, именно эта гипотеза дала название кислороду как химическому элементу.
Слайд 4В 1839 немецкий химик Юстус Либих дал такое определение кислотам:
кислота — это

водородосодержащее соединение, водород которого может быть замещён на металл с образованием соли.
Слайд 5Первую попытку создать общую теорию кислот и оснований предпринял шведский физикохимик Сванте

Аррениус.
Согласно его теории, сформулированной в 1887,
кислота — это соединение, диссоциирующее в водном растворе с образованием протонов (ионов водорода H+). Теория Аррениуса быстро показала свою ограниченность, она не могла объяснить многих экспериментальных фактов. В наше время она имеет главным образом историческое и педагогическое значение.
Слайд 7Химические свойства кислот:
Взаимодействие с основными оксидами с образованием соли и воды:
Взаимодействие

с амфотерными оксидами с образованием соли и воды:
Взаимодействие со щелочами с образованием соли и воды (реакция нейтрализации):
Взаимодействие с нерастворимыми основаниями с образованием соли и воды, если полученная соль растворима:
Взаимодействие с солями, если выпадает осадок или выделяется газ:
Сильные кислоты вытесняют более слабые из их солей:
Слайд 8Химические свойства кислот:
Металлы, стоящие в ряду активности до водорода, вытесняют его из

раствора кислоты (кроме азотной кислоты любой концентрации и концентрированной серной кислоты ), если образующаяся соль растворима:
С азотной кислотой и концентрированной серной кислотами реакция идёт иначе:
Для органических кислот характерна реакция этерификации (взаимодействие со спиртами с образованием сложного эфира и воды):
Например,
Слайд 9Кислоты в нашей жизни:
Азотная кислота широко используется для производства удобрений, красителей,

лаков, пластмасс, лекарственных и взрывчатых веществ, а также химических волокон.
Слайд 10Серная кислота расходуется в больших количествах для производства минеральных удобрений, красителей, химических
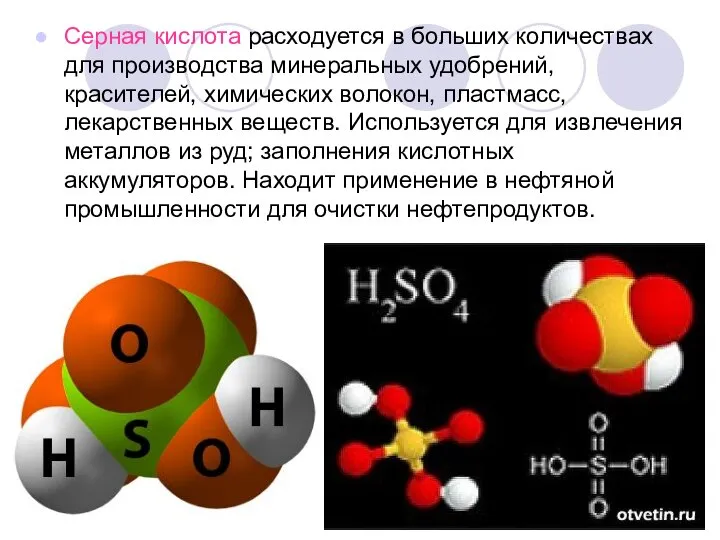
волокон, пластмасс, лекарственных веществ. Используется для извлечения металлов из руд; заполнения кислотных аккумуляторов. Находит применение в нефтяной промышленности для очистки нефтепродуктов.
Слайд 11Фосфорная кислота используется в составах для обезжиривания металлических поверхностей перед нанесением защитных
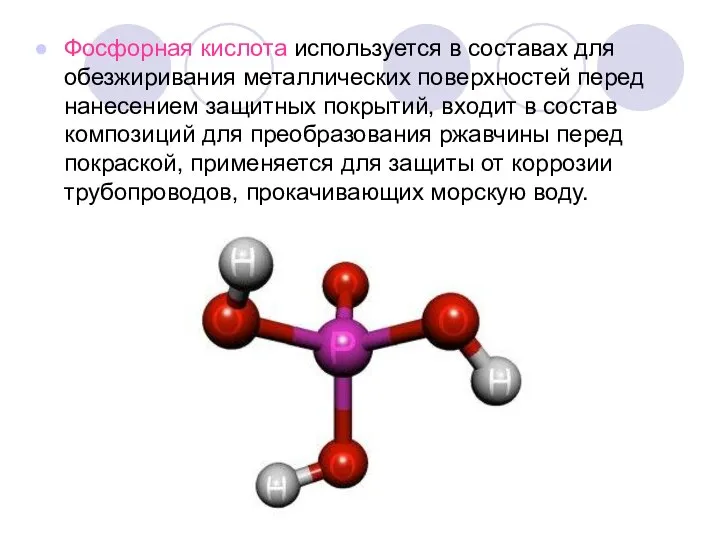
покрытий, входит в состав композиций для преобразования ржавчины перед покраской, применяется для защиты от коррозии трубопроводов, прокачивающих морскую воду.
Слайд 12Соляная кислота широко применяется в нефтяной промышленности для обработки призабойных зон скважин
с целью увеличения нефтеотдачи пластов, используется в составах травильных растворов для удаления ржавчины и отложений в трубопроводах и скважинах, а также как отвердитель фенол-формальдегидных смол.
Слайд 13Интересные факты:
У крокодила в желудке pH бывает меньше 0,5.












 Строение, свойства, биологическая роль дезоксисахаров и аминосахаров
Строение, свойства, биологическая роль дезоксисахаров и аминосахаров Кремний и его соединения
Кремний и его соединения Основания. 8 класс
Основания. 8 класс Диссоциация. Уравнения диссоциации
Диссоциация. Уравнения диссоциации Предмет биоорганической химии. Лекция 1
Предмет биоорганической химии. Лекция 1 Презентация по Химии "Здоровьесберегающие технологии при изучении химии"
Презентация по Химии "Здоровьесберегающие технологии при изучении химии"  Типы изомерии
Типы изомерии Презентация на тему Факторы, влияющие на скорость химической реакции
Презентация на тему Факторы, влияющие на скорость химической реакции  Основания. Классификация
Основания. Классификация Сероводород. Сульфиды
Сероводород. Сульфиды Алкины. Понятие об алкинах
Алкины. Понятие об алкинах Коррозия металлов, сплавов
Коррозия металлов, сплавов Производство полимеров в РК
Производство полимеров в РК Основания. Щелочи – растворимые основания
Основания. Щелочи – растворимые основания Классификация неорганических веществ
Классификация неорганических веществ Химический состав клетки
Химический состав клетки Химия в быту
Химия в быту Кислоты в химии
Кислоты в химии 9_OSNOVY_KOLANALIZA (1)
9_OSNOVY_KOLANALIZA (1) Химик белемнәрне тормышта куллану
Химик белемнәрне тормышта куллану Презентация на тему Глюкоза (10 класс)
Презентация на тему Глюкоза (10 класс)  Галогеноводородные кислоты
Галогеноводородные кислоты Оксиды. 8 класс
Оксиды. 8 класс Очистка рабочих электродов
Очистка рабочих электродов Техника безопасности на уроках химии
Техника безопасности на уроках химии Спирты. Понятие о спиртах
Спирты. Понятие о спиртах Презентация на тему Сахароза
Презентация на тему Сахароза  Практическая работа: наблюдение роста кристалов
Практическая работа: наблюдение роста кристалов