Содержание
- 3. O2, O3 Степени окисления 0, -1, -2 O2F, OF2 +1, +2 S8 в газе S4-S2 -2,
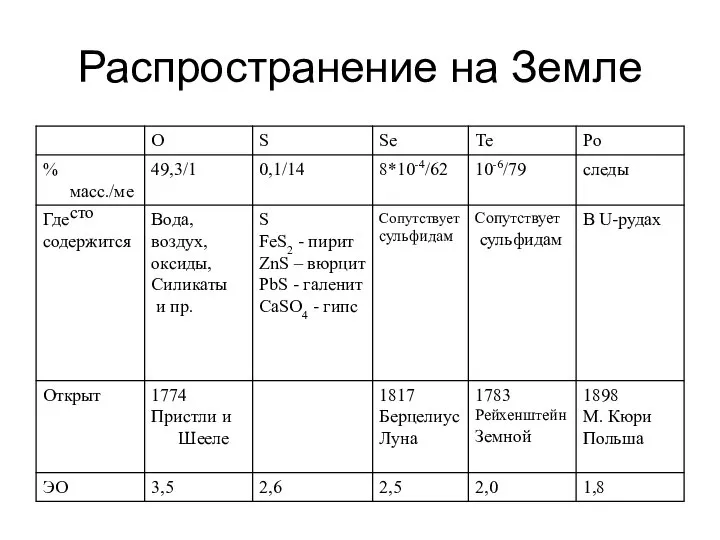
- 4. Распространение на Земле
- 5. Кислород получение Промышленное Фракционная перегонка жидкого воздуха Электролиз воды Применение Металлургия, получение стали Космические программы Химическая
- 6. Лабораторные способы получения Термическое разложение солей 2KMnO4 = K2MnO4 + MnO2 + O2 KClO3 = KCl
- 7. Хранение кислорода
- 8. Свойства Кислород окислитель!!! Сильный!!! O2 + 4H+ + 4e = 2H2O ΔE°=1.23В O3 + 2H+ +
- 10. Скачать презентацию





 Изучение зависимости скорости химической реакции от различных факторов. Практическая работа № 6
Изучение зависимости скорости химической реакции от различных факторов. Практическая работа № 6 Исследовательская работа по химии на тему: Интегративные проблемные ситуации
Исследовательская работа по химии на тему: Интегративные проблемные ситуации Тест по теме Альдегиды и кетоны
Тест по теме Альдегиды и кетоны Материаловедение. Модуль
Материаловедение. Модуль Синтез оксида меди и йодида меди для формирования буферных слоев для ГОНП
Синтез оксида меди и йодида меди для формирования буферных слоев для ГОНП Обобщение и систематизация знаний по теме Вещества и их классификация
Обобщение и систематизация знаний по теме Вещества и их классификация Металлы
Металлы lektsia_6 (1)
lektsia_6 (1) Изучение возможности синтеза порошка сложного карбонитрида -титана молибдена Ti-Mo в режиме СВС
Изучение возможности синтеза порошка сложного карбонитрида -титана молибдена Ti-Mo в режиме СВС Development of the system of concepts on the topic redox reactions in the school course of inorganic chemistry
Development of the system of concepts on the topic redox reactions in the school course of inorganic chemistry Кристаллы
Кристаллы Электродные процессы. Электроды. Потенциометрия
Электродные процессы. Электроды. Потенциометрия Клеящие материалы
Клеящие материалы Алкены
Алкены Презентация на тему Арены (10 класс)
Презентация на тему Арены (10 класс)  Радон (222Rn)
Радон (222Rn) Основные классы неорганических соединений. Мы едем, едем, едем…
Основные классы неорганических соединений. Мы едем, едем, едем… Практические занятия по теме: Методы защиты энергооборудования от коррозии (1)
Практические занятия по теме: Методы защиты энергооборудования от коррозии (1) Оксид серы (VI) SO3
Оксид серы (VI) SO3 Реакции
Реакции Химическая картина мира
Химическая картина мира valentnost
valentnost Reactivi444
Reactivi444 Тест по теме Основные классы неорганических соединений
Тест по теме Основные классы неорганических соединений Классы неорганических соединений Подготовка к ЕГЭ
Классы неорганических соединений Подготовка к ЕГЭ Получение и примененипе радиоактивные изотопы
Получение и примененипе радиоактивные изотопы Презентация на тему Химическая промышленность мира
Презентация на тему Химическая промышленность мира