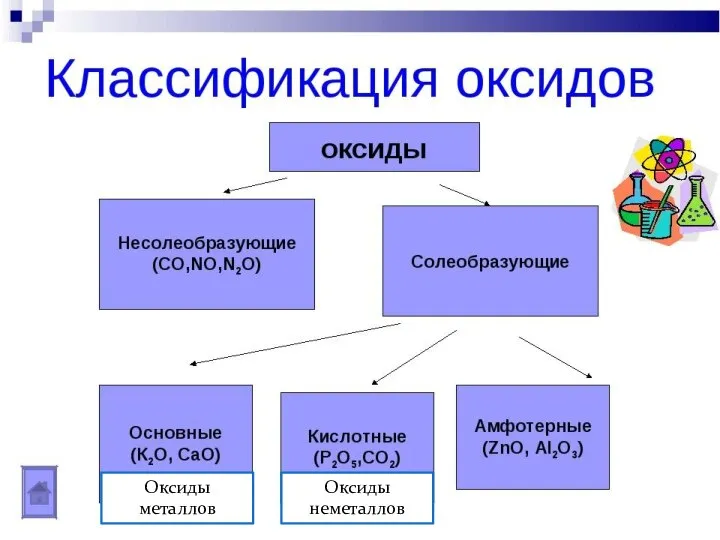
Слайд 4Классификация оксидов
Оксиды металлов
Оксиды неметаллов
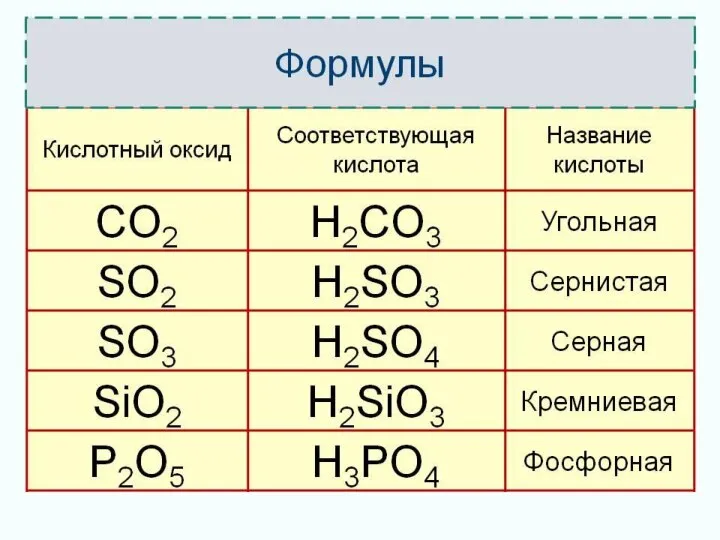
Слайд 7сернистая
серная
угольная
фосфорная
кремневая
азотистая
азотная
хромовая
марганцевая

Слайд 12Другие характерные реакции оксидов.
(кислотный О. + основный О.)

Слайд 14Взаимодействие оксидов с кислотами/щелочами.

Слайд 15Взаимодействие оксидов с элементами

Слайд 16Кислоты и щёлочи
Более подробно свойства этих классов соединений будут нами рассмотрены через

урок.
Сейчас хотелось бы обратить ваше внимание только на реакцию образования, характерную для ещё одного класса химических соединений – СОЛЕЙ.
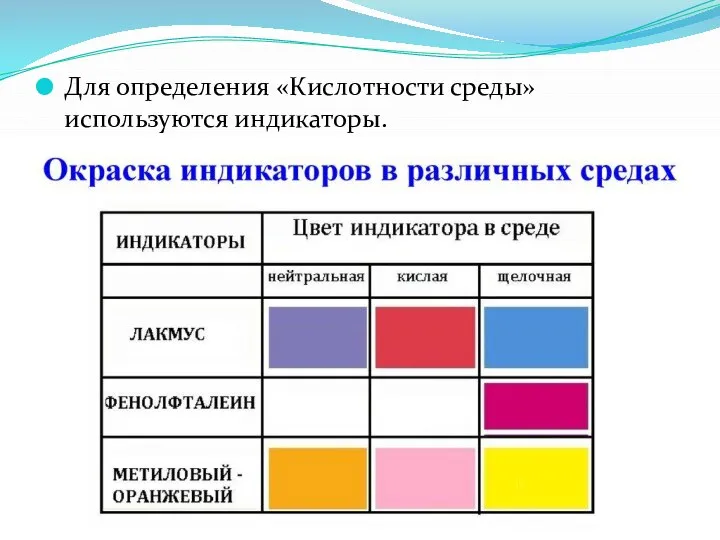
Слайд 17Для определения «Кислотности среды» используются индикаторы.
Слайд 18Получение солей
Реакция нейтрализации
Соли можно получить, например, при взаимодействии кислот с щелочами (кислотно-основное
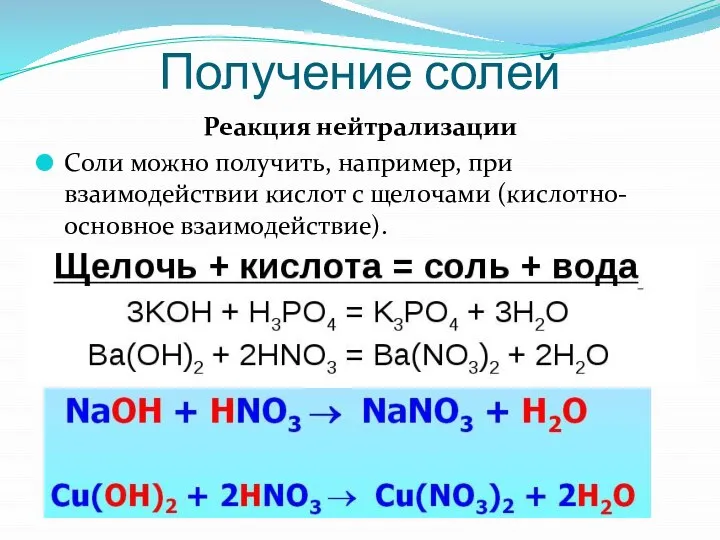
взаимодействие).
(тут будут примеры реакций)
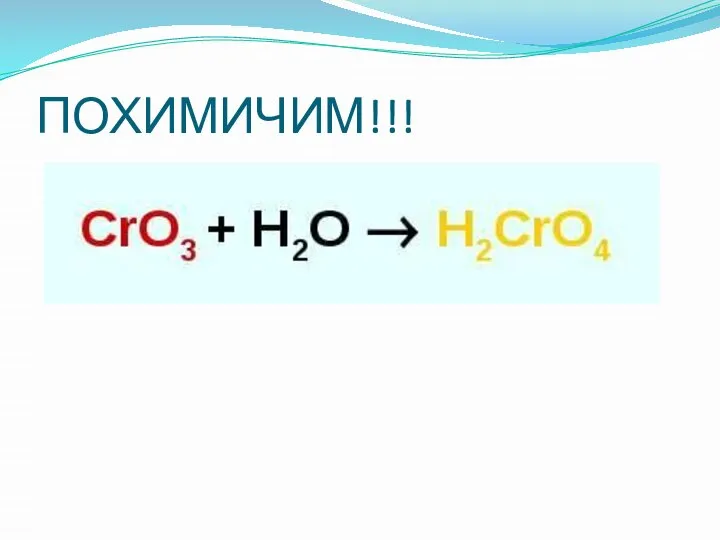
Слайд 19ПОХИМИЧИМ!!!
Посмотрим окраску индикаторов полученного раствора хромовой кислоты, гидроксида калия и раствора, через

который пропускают углекислый газ.
А также изменение окраски индикатора при нейтрализации раствора.
Слайд 20Вода
Кроме реакций с оксидами с образованием щелочей и кислот вода также может

реагировать с некоторыми элементами.
Так, вам будет полезно знать реакцию воды с активными металлами.
Слайд 22ПОХИМИЧИМ!!!
Посмотрим взаимодействие металлического натрия с водой, а также будем контролировать щелочность раствора

фенолфталеином.



















 Периодическая система Д.И.Менделеева
Периодическая система Д.И.Менделеева Основы химии полимеров
Основы химии полимеров Презентация на тему Ионные уравнения
Презентация на тему Ионные уравнения  Cеминар 6 -Алканы-2
Cеминар 6 -Алканы-2 Материалы космической техники
Материалы космической техники Классификация химических реакций по различным основаниям
Классификация химических реакций по различным основаниям Презентация на тему Атомы и молекулы
Презентация на тему Атомы и молекулы  Презентация на тему Вещества в твоей жизни
Презентация на тему Вещества в твоей жизни  Материалы, изменившие мир
Материалы, изменившие мир Получение аммиака и изучение его свойств. Практическая работа № 2
Получение аммиака и изучение его свойств. Практическая работа № 2 Презентация на тему Основные законы науки химии
Презентация на тему Основные законы науки химии  Йод. Положение в периодической системе
Йод. Положение в периодической системе Кинетика химических и биохимических процессов. Часть 1
Кинетика химических и биохимических процессов. Часть 1 Сутек өндірісінің болашақ технологиясы - фотокатализ
Сутек өндірісінің болашақ технологиясы - фотокатализ Презентация на тему Окислительно – восстановительные реакции
Презентация на тему Окислительно – восстановительные реакции  Практические занятия по теме: Методы защиты энергооборудования от коррозии (1)
Практические занятия по теме: Методы защиты энергооборудования от коррозии (1) Кристаллическое строение металлов и сплавов. Аморфные и кристаллические тела
Кристаллическое строение металлов и сплавов. Аморфные и кристаллические тела Карбоциклические соединения. Циклоалканы
Карбоциклические соединения. Циклоалканы Электролиз. Законы Фарадея
Электролиз. Законы Фарадея Исследование реологических характеристик радиационносшитых водорастворимых полимеров с целью разработки новых составов для ГРП
Исследование реологических характеристик радиационносшитых водорастворимых полимеров с целью разработки новых составов для ГРП Презентация на тему Кристаллическая решетка
Презентация на тему Кристаллическая решетка  Материаловедение. Стали. Свойства сталей. Классификация сталей
Материаловедение. Стали. Свойства сталей. Классификация сталей Подготовка газа к транспорту с применением процесса низкотемпературной сепарации
Подготовка газа к транспорту с применением процесса низкотемпературной сепарации Значение углеводородов
Значение углеводородов Химические и физические явления
Химические и физические явления Особенности растворов высокомолекулярных соединений (ВМС). Вязкость растворов ВМС. Набухание. Рубежный контроль №1
Особенности растворов высокомолекулярных соединений (ВМС). Вязкость растворов ВМС. Набухание. Рубежный контроль №1 Презентация в 8 классе к уроку по химии на тему__
Презентация в 8 классе к уроку по химии на тему__ Получение и реакции пиразина
Получение и реакции пиразина