способность реагировать с некоторыми металлами. В этих реакциях обычно выделяется водород и образуются соли
Zn + 2HCI = ZnCl2 + Н2
Чтобы узнать, какие металлы вытесняют водород из кислот, можно руководствоваться рядом активности металлов, который опытным путем (1865) определил русский ученый Н, Н. Бекетов (1826—1911):
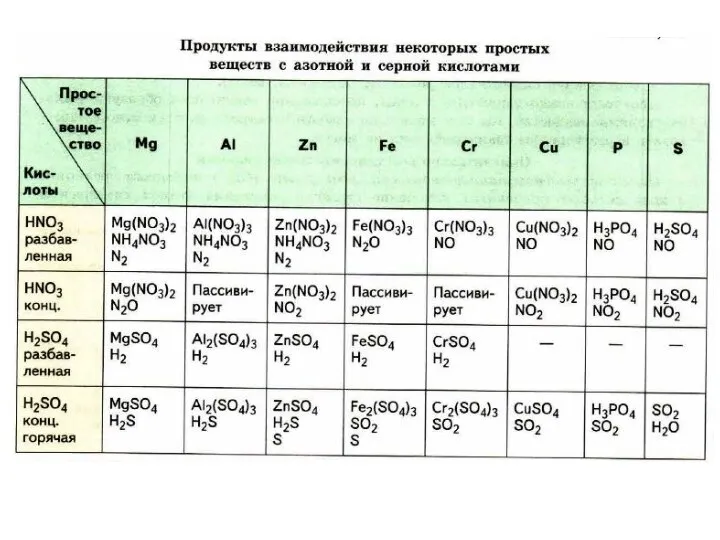
В этом ряду все металлы, стоящие до водорода, способны вытеснить его из кислот. Исключением является азотная кислота, при ее взаимодействии с металлами вместо водорода выделяются другие газы.









 Алкадиены
Алкадиены Обмен жиров в организме млекопитающего
Обмен жиров в организме млекопитающего Бинарные соединения – оксиды и летучие водородные соединения. 8 класс
Бинарные соединения – оксиды и летучие водородные соединения. 8 класс Научно-познавательное шоу Юный химик
Научно-познавательное шоу Юный химик Расчет по химическим уравнениям
Расчет по химическим уравнениям Презентация на тему Влияние пищевых добавок на здоровье человека
Презентация на тему Влияние пищевых добавок на здоровье человека  Презентация на тему Биография Д. И. Менделеева
Презентация на тему Биография Д. И. Менделеева  Изучение микроклимата коровника с целью создания системы очистки воздуха от аммиака
Изучение микроклимата коровника с целью создания системы очистки воздуха от аммиака Окислительно-восстановительные реакции (ОВР). Лекция 1
Окислительно-восстановительные реакции (ОВР). Лекция 1 Химия жиров (липидов)
Химия жиров (липидов) Основи масообміну
Основи масообміну География. Уральские самоцветы
География. Уральские самоцветы Общие химические свойства неметаллов
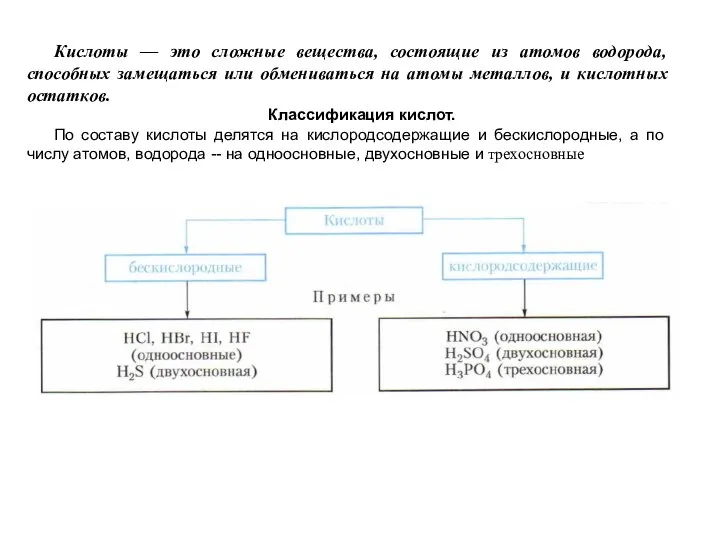
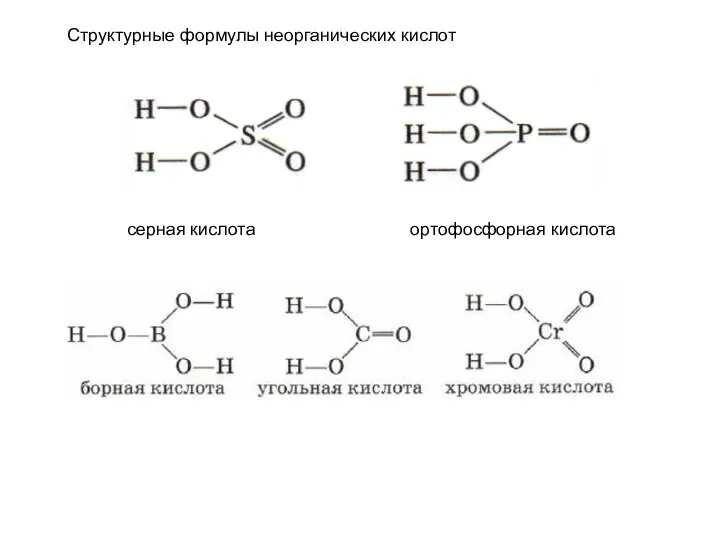
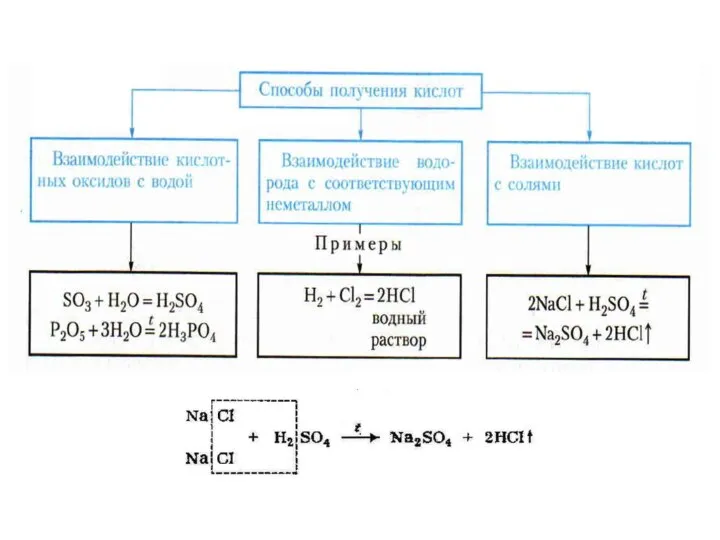
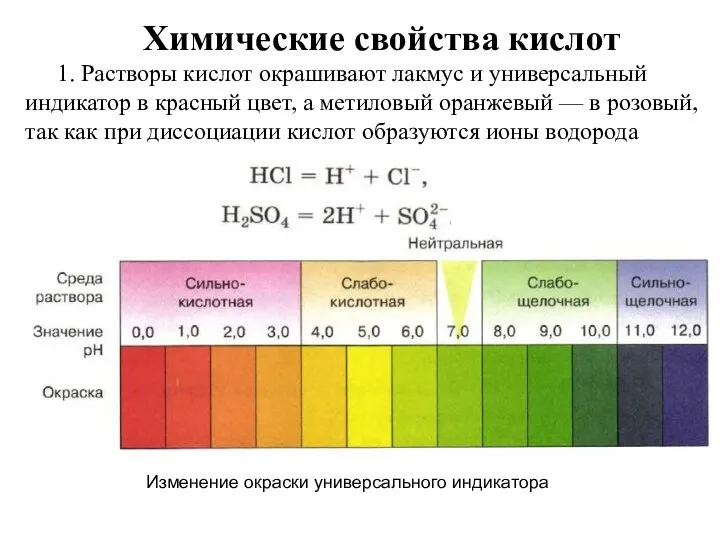
Общие химические свойства неметаллов Кислоты. Строение, классификации и свойства неорганических кислот
Кислоты. Строение, классификации и свойства неорганических кислот Химическая лаборатория
Химическая лаборатория Анилин (амидобензол, аминобензол, фениламин)
Анилин (амидобензол, аминобензол, фениламин) Возможности модернизации совместного производства фенола и ацетона кумольным способом
Возможности модернизации совместного производства фенола и ацетона кумольным способом Карбоновые кислоты
Карбоновые кислоты Предельные углеводороды. Урок №4
Предельные углеводороды. Урок №4 Химическая коррозия
Химическая коррозия Общие способы получения металлов
Общие способы получения металлов 11 типы связей
11 типы связей Соединения азота
Соединения азота Биохимия крови
Биохимия крови Презентация по Химии "Использование исследовательских и информационно-коммуникационных технологий в обучении химии" - скача
Презентация по Химии "Использование исследовательских и информационно-коммуникационных технологий в обучении химии" - скача Гидролиз солей
Гидролиз солей Самородные металлы
Самородные металлы Презентация на тему Алканы
Презентация на тему Алканы