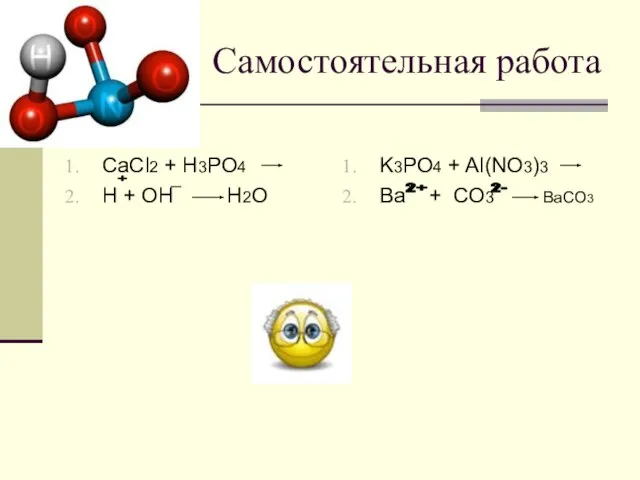
Слайд 2Самостоятельная работа
CaCl2 + H3PO4
H + OH H2O
K3PO4 + Al(NO3)3
Ba + CO3 BaCO3
+
Слайд 3Подумай
Были ли у тебя вопросы при выполнении домашнего задания?
Трудно ли составлять ионные

уравнения?
Нет ли у тебя пробелов в знаниях по химии?
Ты всегда молодец?
Слайд 5Типичные реакции
Кислота + основание = соль + вода (о)
Кислота + оксид металла
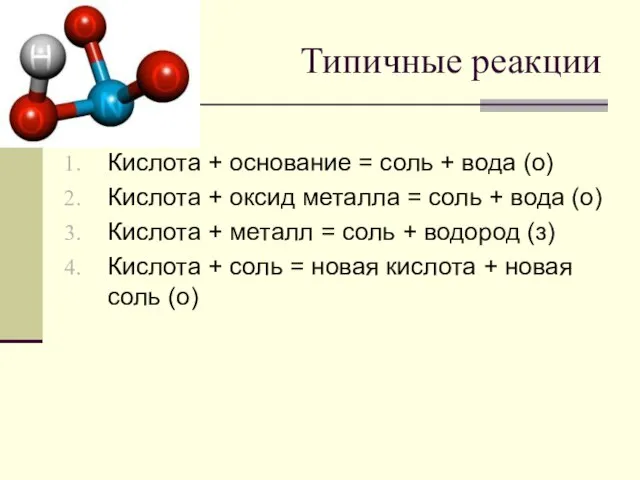
= соль + вода (о)
Кислота + металл = соль + водород (з)
Кислота + соль = новая кислота + новая соль (о)
Слайд 6Лабораторный опыт №7
Тема: Реакции характерные для растворов кислот.
Цель: Изучить свойства растворов кислот
Оборудование

и реактивы: штатив,
пробирки, NaOH, HCl, ф-ф, Al, H2SO4, CuO, BaCl2
Ход работы:
Слайд 7Реакция нейтрализации
Возьмите пробирку налейте 2-3 мл NaOH добавьте 1 каплю ф-ф, что

наблюдаете? Прилейте 2-3 мл HCl. Что вы увидели. Запишите уравнение реакции, протекающей в пробирке, его полное и сокращённое ионное уравнение.
Слайд 8Кислота + оксид металла
Возьмите 1г оксида меди (2) и прилейте к нему

2-3 мл серной кислоты. Нагрейте содержимое пробирки на спиртовке. Что вы наблюдаете? Запишите молекулярное уравнение реакции, полное и сокращённое ионное уравнение.
Слайд 9Кислота + металл
Возьмите гранулу алюминия и прилейте к ней 2-3 мл соляной

кислоты. Что наблюдаете? Запишите уравнения реакции.
Как реагируют кислоты с металлами? Какие есть особенности?
Слайд 10Кислота + соль
В пробирку налейте 2-3 мл хлорида бария и прилейте

2-3 мл серной кислоты. Что вы наблюдаете запишите уравнения реакции.
Вывод: Какие свойства кислоты проявляют в растворе?
Слайд 11Домашнее задание
§38 – «3»
№2 – «4»
№5 – «5»









 Строение вещества. Виды химической связи
Строение вещества. Виды химической связи Решение задач на основные законы и понятия химии
Решение задач на основные законы и понятия химии Спирты и их производные
Спирты и их производные Строение, свойства, биологическая роль дезоксисахаров и аминосахаров
Строение, свойства, биологическая роль дезоксисахаров и аминосахаров Гетерогенные химические системы и поверхностные явления в них
Гетерогенные химические системы и поверхностные явления в них Метанол. Краткая характеристика
Метанол. Краткая характеристика Использование катионных красителей в экстракционно-флуориметрическом анализе
Использование катионных красителей в экстракционно-флуориметрическом анализе Основания. Простые и сложные ионы
Основания. Простые и сложные ионы Строение и химические свойства галогенов
Строение и химические свойства галогенов Методы пробоотбора и пробоподготовки донных отложений, почв и грунтов
Методы пробоотбора и пробоподготовки донных отложений, почв и грунтов Основные понятия и законы химии
Основные понятия и законы химии Разбор задач
Разбор задач Классы веществ
Классы веществ Предельные углеводороды. Урок №4
Предельные углеводороды. Урок №4 Презентация на тему Природный и попутный газ
Презентация на тему Природный и попутный газ  Лекарственные средства – производные пиримидин 2,4,6-триона
Лекарственные средства – производные пиримидин 2,4,6-триона Условия, замедляющие выход водорастворимых питательных веществ из удобрений на примере аммофоса
Условия, замедляющие выход водорастворимых питательных веществ из удобрений на примере аммофоса Очистка поверхности медного сплава
Очистка поверхности медного сплава Роль М.В. Ломоносова и Дж. Дальтона в создании атомно-молекулярного учения
Роль М.В. Ломоносова и Дж. Дальтона в создании атомно-молекулярного учения Сульфиды
Сульфиды Alkini
Alkini Критерии оценки качества природного газа
Критерии оценки качества природного газа Современные способы защиты ОТТ
Современные способы защиты ОТТ Определение химического эквивалента, эквивалентной и атомной массы металла
Определение химического эквивалента, эквивалентной и атомной массы металла Простые и сложные вещества. Основные классы неорганических веществ
Простые и сложные вещества. Основные классы неорганических веществ Азотная кислота и ее соли. Специфические свойства азотной кислоты
Азотная кислота и ее соли. Специфические свойства азотной кислоты Интеллектуальная игра по химии Металлы
Интеллектуальная игра по химии Металлы Метод высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии
Метод высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии