Содержание
- 2. План лекции: Инструментальная индикация КТТ в комплексонометрии Практическое применение методов комплексонометрического титрования Органические аналитические реагенты Учебная
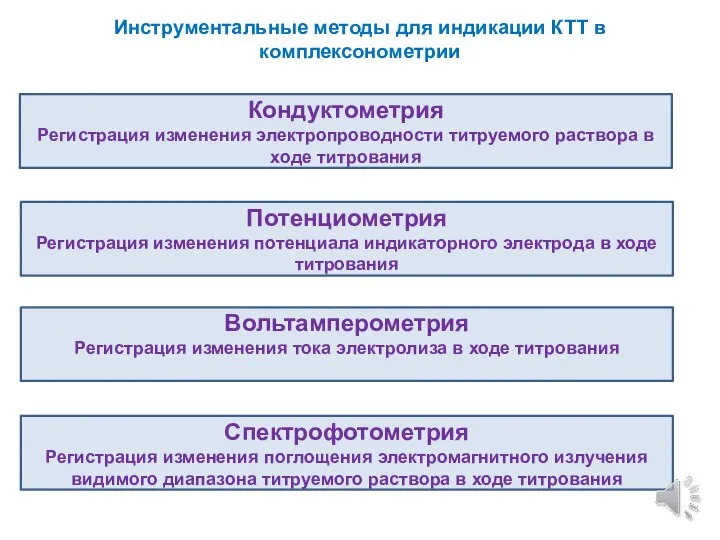
- 3. Инструментальные методы для индикации КТТ в комплексонометрии Кондуктометрия Регистрация изменения электропроводности титруемого раствора в ходе титрования
- 4. Кондуктометрический метод анализа
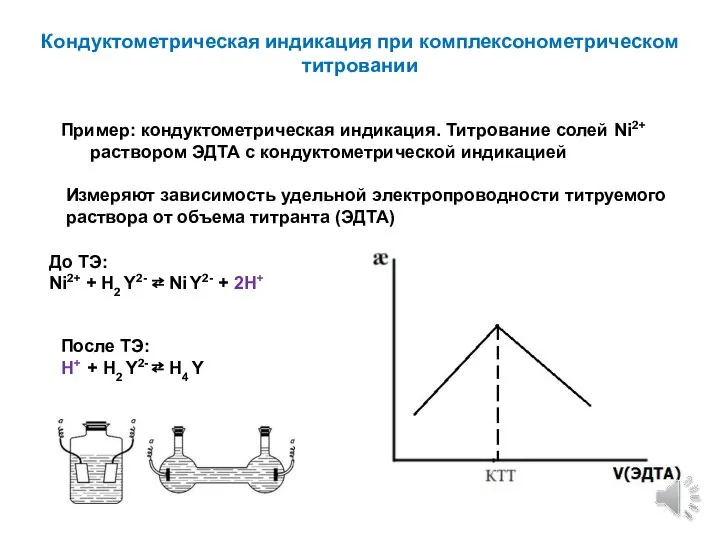
- 5. Кондуктометрическая индикация при комплексонометрическом титровании Пример: кондуктометрическая индикация. Титрование солей Ni2+ раствором ЭДТА с кондуктометрической индикацией
- 6. Молекулярная оптическая спектроскопия Аналитическая молекулярная спектрометрия Фотометрия (спектрофотометрия)
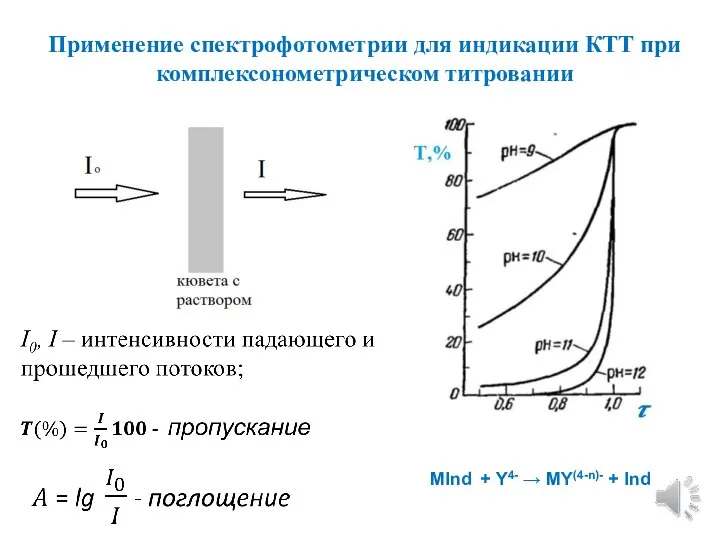
- 7. Применение спектрофотометрии для индикации КТТ при комплексонометрическом титровании MInd + Y4- → MY(4-n)- + Ind
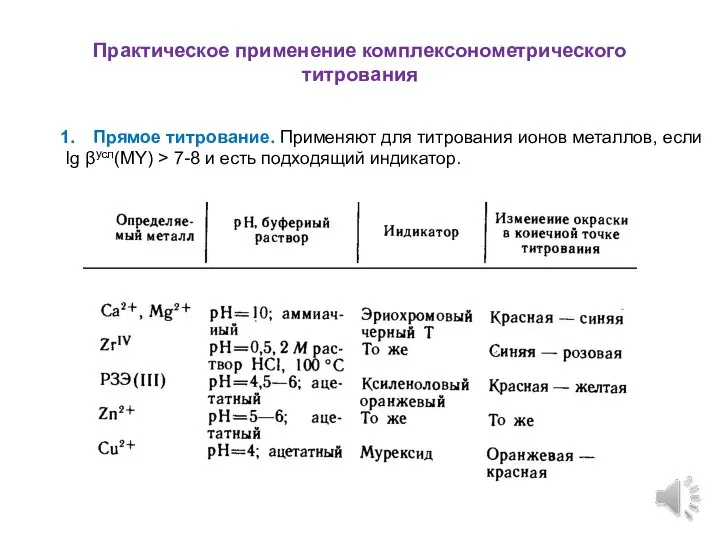
- 8. Практическое применение комплексонометрического титрования Прямое титрование. Применяют для титрования ионов металлов, если lg βусл(MY) > 7-8
- 9. Zn2+ + HY3– = ZnY2– + 3H+ fэкв(Zn2+) = 1/1; fэкв(HY3–) =1/1 Схема расчета для метода
- 10. Раздельное комплексонометрическое определение ионов кальция и магния при их совместном присутствии Определение общего содержания ионов кальция
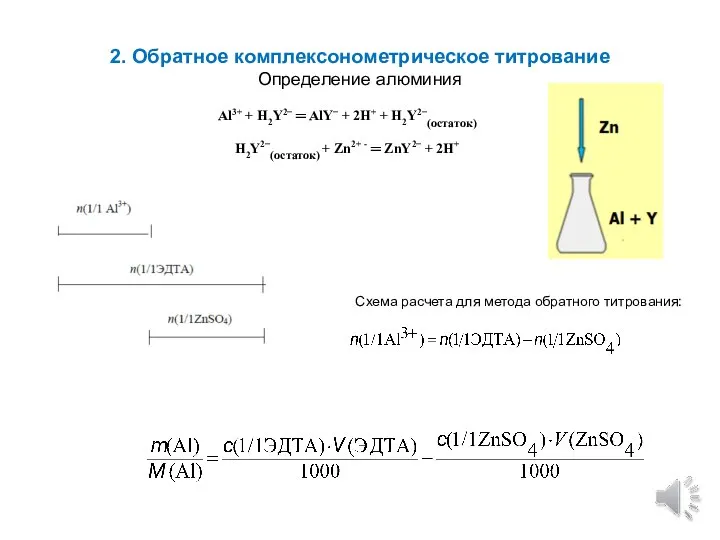
- 11. 2. Обратное комплексонометрическое титрование Определение алюминия Al3+ + H2Y2− ═ AlY− + 2H+ + H2Y2−(остаток) H2Y2−(остаток)
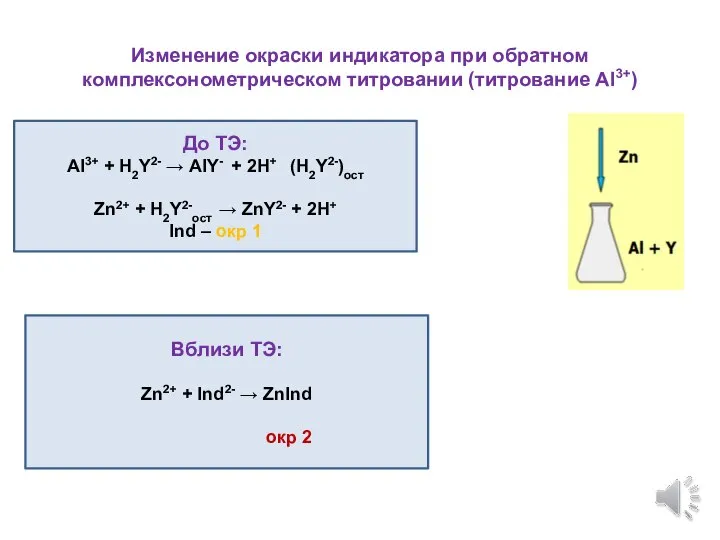
- 12. Изменение окраски индикатора при обратном комплексонометрическом титровании (титрование Al3+) До ТЭ: Al3+ + H2Y2- → AlY-
- 13. 3. Заместительное комплексонометрическое титрование Определение ионов натрия Натрий осаждают в виде малорастворимого соединения, в состав которого
- 14. Определение анионов методом заместительного комплексонометрического титрования Анион переводят в состав осадка, катион которого является металлом, образующим
- 16. Скачать презентацию







 Сельскохозяйственная токсикология
Сельскохозяйственная токсикология Презентация на тему Синтетические материалы
Презентация на тему Синтетические материалы  1. Классификация материалов
1. Классификация материалов Презентация по Химии "Алмаз и графит"
Презентация по Химии "Алмаз и графит"  ИЗМЕНЕНИЕ СВОЙСТВ В ПЕРИОДАХ И ГРУППАХ
ИЗМЕНЕНИЕ СВОЙСТВ В ПЕРИОДАХ И ГРУППАХ Производство серной кислоты
Производство серной кислоты Алифатические диазосоединения
Алифатические диазосоединения Общая характеристика элементов подгруппы углерода. Углерод как простое вещество
Общая характеристика элементов подгруппы углерода. Углерод как простое вещество Развитие творческих способностей школьников на уроках химии
Развитие творческих способностей школьников на уроках химии Альдегиды и кетоны
Альдегиды и кетоны Toshkent davlat texnika instituti
Toshkent davlat texnika instituti Первоначальные химические понятия
Первоначальные химические понятия Алкадиены
Алкадиены Карбонаты. Лекция 12
Карбонаты. Лекция 12 Катализ
Катализ Ароматические углеводороды
Ароматические углеводороды Пропиловый спирт C3H7OH
Пропиловый спирт C3H7OH Растворы. Лекция №4
Растворы. Лекция №4 Стекло. Виды стекла
Стекло. Виды стекла Обобщение знаний об углеводородах
Обобщение знаний об углеводородах Моносахариды
Моносахариды Команда Оптимисты
Команда Оптимисты Полистерол Прохоренко Е.О. 11 Б
Полистерол Прохоренко Е.О. 11 Б Альдегиды, их химические и физические свойства. Получение и применение альдегидов
Альдегиды, их химические и физические свойства. Получение и применение альдегидов Гидроксикарбоновые кислоты
Гидроксикарбоновые кислоты Коалесцирующие фильтры. Моделирование процесса разделения отходов углеводородов коалесцирующими фильтрами
Коалесцирующие фильтры. Моделирование процесса разделения отходов углеводородов коалесцирующими фильтрами Кабинет химии
Кабинет химии Карбоновые кислоты и их гетерофункциональные производные: гидрокси- и оксокарбоновые кислоты
Карбоновые кислоты и их гетерофункциональные производные: гидрокси- и оксокарбоновые кислоты