Содержание
- 2. Элементы и атомы, В менделеевский взятые круг Сделали химию самой богатой И самой творческой из наук.
- 3. Kонтроль результатов обучения учащихся – неотъемлемая часть учебного процесса. Это сложный и многогранный процесс, важный и
- 4. ТЕСТОВЫЙ КОНТРОЛЬ ЗНАНИЙ ПО ХИМИИ Тесты используются в образовательном процессе уже около ста лет. Они представляют
- 5. Тест выборки представляет собой задания, включающие готовый ответ, который учащиеся должны выбрать из нескольких (обычно четырех)
- 6. Тест дополнения представляет собой задание с пропуском знака, слова, цифры или формулы, отмеченным чертой или точками.
- 7. Тест группирования включает в себя перечень химических терминов или формул, которые следует распределить по заданным признакам.
- 8. Тест ранжирования представляет собой перечень (не более десяти) однопорядковых химических формул, физических или химических величин, химических
- 9. Тест сличения превалирует в части В ЕГЭ по химии. Суть выполнения заданий такого теста сводится к
- 10. Тест напоминания требует от выполняющего ответа на поставленный вопрос. В части В единого государственного экзамена по
- 11. Альтернативные тестовые задания еще не включались в тесты ЕГЭ по химии, но давно применяются учителями как
- 12. Тема урока: «Физические и химические явления». Цель урока: познакомить учащихся с физическими и химическими явлениями; Научить
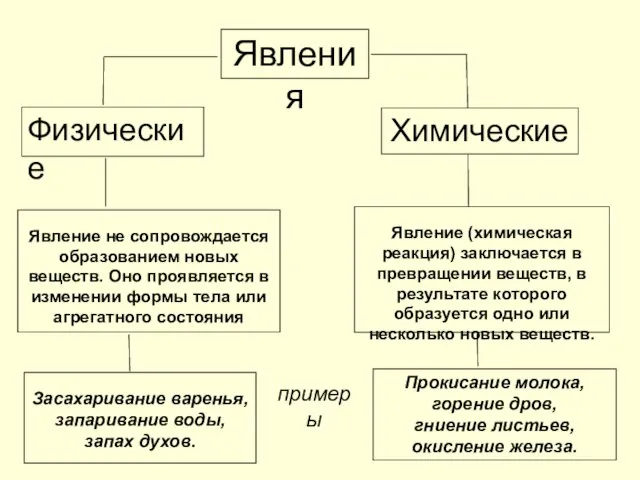
- 13. Явления Физические Химические Явление не сопровождается образованием новых веществ. Оно проявляется в изменении формы тела или
- 14. Закрепление(устно) Тест напоминания. О каком явлении говорится в пословицах? «Вода камень точит» _____________ «Железо ржа поедает,
- 15. Признаки химических реакций: Изменение цвета; Изменение запаха; Выпадение (растворение) осадка; Выделение газа; Выделение (поглощение) теплоты.
- 16. Лабораторная работа. Цель: на практике изучить признаки химических реакций.
- 17. Правила техники безопасности Чтобы не подвергать свою жизнь опасности, Надо знать технику безопасности: Делаешь только то,
- 18. Правила техники безопасности Вещества в лаборатории на вкус не изучаются – Это строго-настрого запрещается. Нельзя смешивать
- 19. Опыт 1. Горение лучины. Зажгите спиртовку.внесите лучину в ее пламя.Через некоторое время выньте лучину из пламени.
- 20. Опыт 2. Взаимодействие мрамора с кислотой. Положите в пробирку 1-2 кусочка мрамора. Прилейте столько соляной кислоты,
- 21. Опыт 3. Взаимодействие щелочи с индикатором. В пробирку налейте 2 мл щелочи NaOH, добавьте несколько капель
- 22. Опыт 4. Взаимодействие сульфата меди(II) со щелочью. В пробирку налейте 2 мл раствора сульфата меди(II) CuSO4
- 23. Тест сличения. Установите признаки проделанных химических реакций: Взаимодействие сульфата меди(II) со щелочью. Взаимодействие мрамора с кислотой.
- 24. Тест группирования Из приведенного перечня явлений выберите те, которые относятся к физическим: а) при нагревании вода
- 26. Скачать презентацию






















 Атом. Изотопы
Атом. Изотопы Растворы. Лекция 7
Растворы. Лекция 7 Синтетические материалы
Синтетические материалы Электролиз воды
Электролиз воды Галогены
Галогены Углеводы
Углеводы Презентация на тему Стекло. История открытия, получение, применение
Презентация на тему Стекло. История открытия, получение, применение  Чистые вещества и смеси
Чистые вещества и смеси Растворы, растворимость
Растворы, растворимость Химические волокна. Урок 1-2
Химические волокна. Урок 1-2 Фракционный состав нефти. Химический состав нефти
Фракционный состав нефти. Химический состав нефти Структура периодической системы химических элементов
Структура периодической системы химических элементов Презентация на тему Амины
Презентация на тему Амины  Вуглеводи. Групи
Вуглеводи. Групи Материаловедение. Строение металлических материалов. Металлические сплавы
Материаловедение. Строение металлических материалов. Металлические сплавы Разработка методов синтеза гомогенных катализаторов оксосинтеза бутиловых спиртов
Разработка методов синтеза гомогенных катализаторов оксосинтеза бутиловых спиртов Способы получения металлов
Способы получения металлов Классификация и номенклатура неорганических соединений
Классификация и номенклатура неорганических соединений Вычислительные методы в химии. Что такое вычислительная (компьютерная) химия. Лекция 1
Вычислительные методы в химии. Что такое вычислительная (компьютерная) химия. Лекция 1 Стратегия обучения решению задач по химии
Стратегия обучения решению задач по химии Алкадиены, каучуки
Алкадиены, каучуки Строение атома. История открытия атома
Строение атома. История открытия атома Химический состав продуктов питания
Химический состав продуктов питания 9_OSNOVY_KOLANALIZA
9_OSNOVY_KOLANALIZA Полімери. Пінополістирол
Полімери. Пінополістирол Окислительно-восстановительные реакции с электронной точки зрения
Окислительно-восстановительные реакции с электронной точки зрения Классификация неорганических веществ
Классификация неорганических веществ Презентация на тему "Водород"
Презентация на тему "Водород"