Содержание
- 2. УБЕДИТЕЛЬНАЯ ПРОСЬБА!
- 3. КЛЮЧЕВЫЕ ПОЛОЖЕНИЯ #1 1. Метаболическая активность организма зависит от регуляции кислотно- щелочного равновесия, что соответствует величине
- 4. КЛЮЧЕВЫЕ ПОЛОЖЕНИЯ #2 1. Концентрация водородных ионов – это число полярных группировок в макромолекулах, прежде всего
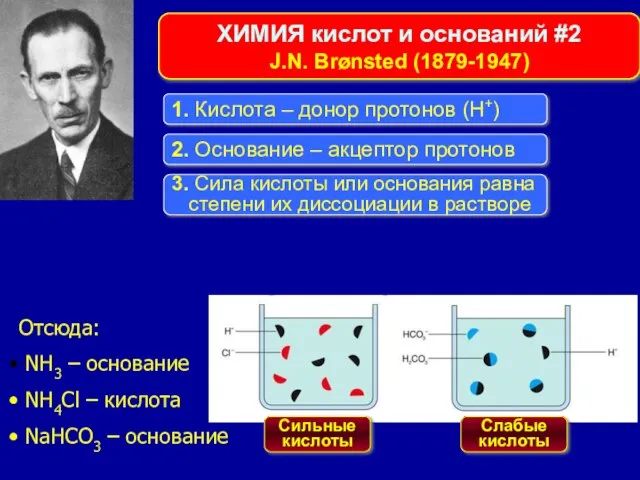
- 5. ХИМИЯ кислот и оснований #1 1. Кислота – молекула, которая может высвобождать свободные ионы H+, основание
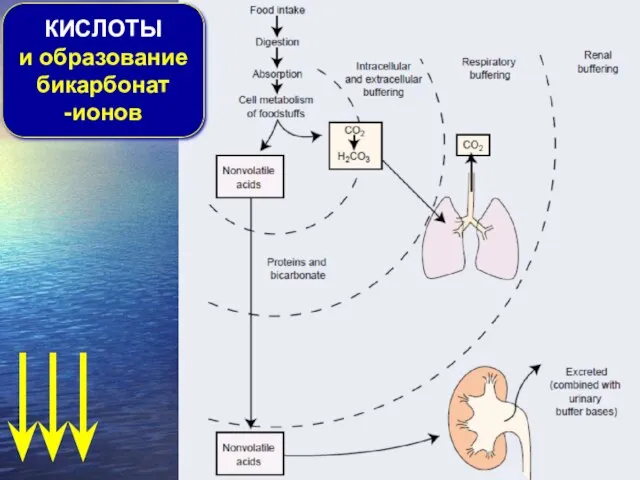
- 6. КИСЛОТЫ и образование бикарбонат -ионов
- 7. Образование (биосинтез) кислот 1. В процессе окисления серо-содержащих аминокислот (метионина, цистеина, цистина) синтезируется серная кислота Основные
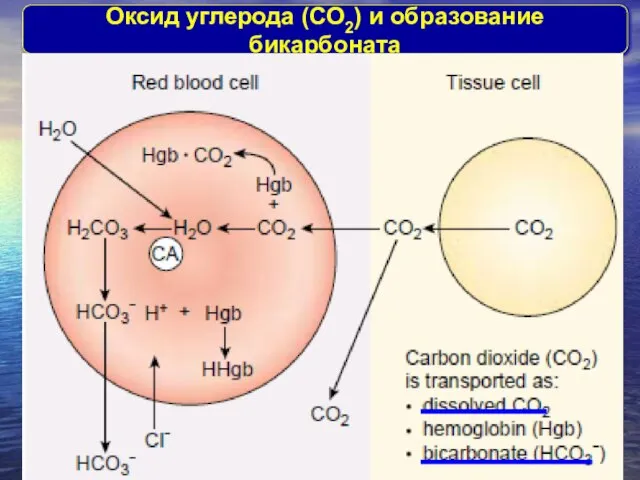
- 8. Оксид углерода (CО2) и образование бикарбоната
- 9. Отсюда: NH3 – основание NH4Cl – кислота NaHCO3 – основание ХИМИЯ кислот и оснований #2 J.N.
- 10. Расчет величины pH 1. H+ ионы. Поступление с пищей (уксус) либо в результате метаболизма, элиминация –
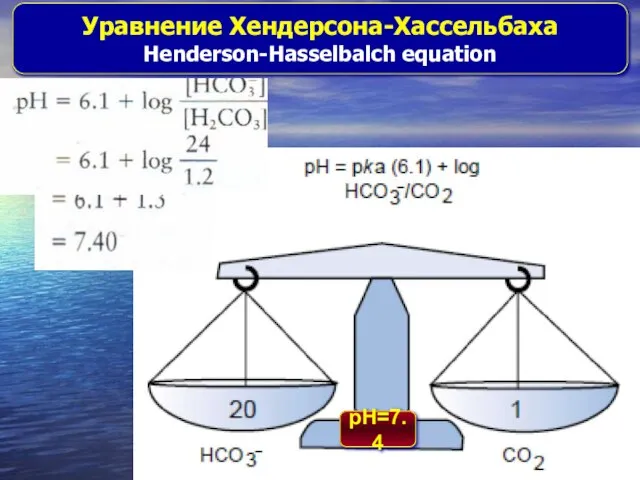
- 11. Уравнение Хендерсона-Хассельбаха Henderson-Hasselbalch equation pH=7.4
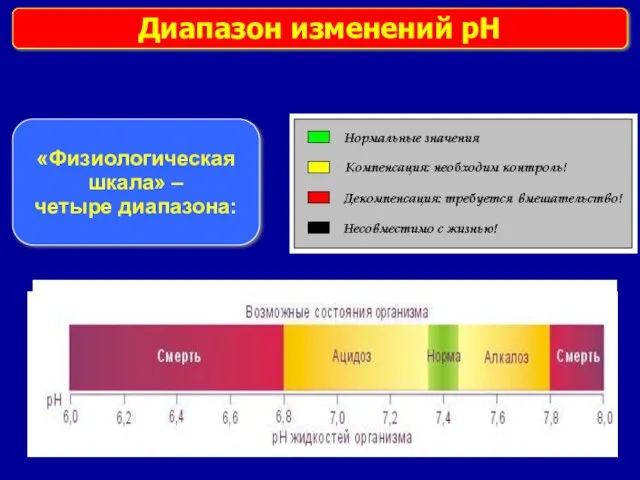
- 12. Диапазон изменений pH «Физиологическая шкала» – четыре диапазона:
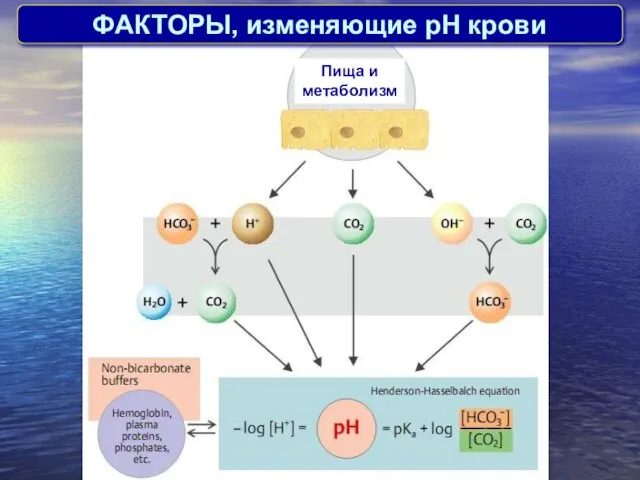
- 13. ФАКТОРЫ, изменяющие pH крови Пища и метаболизм
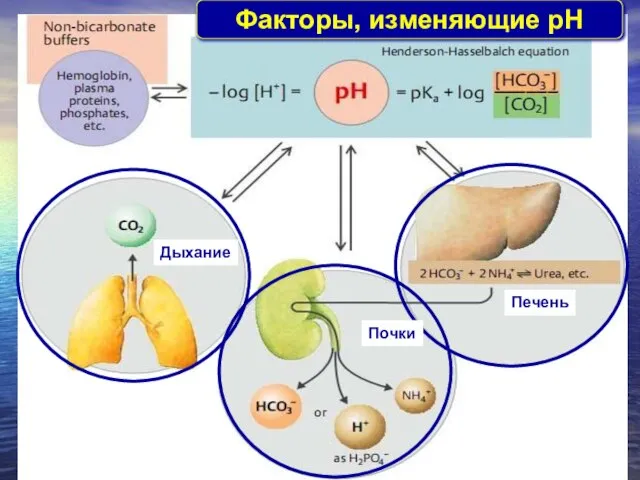
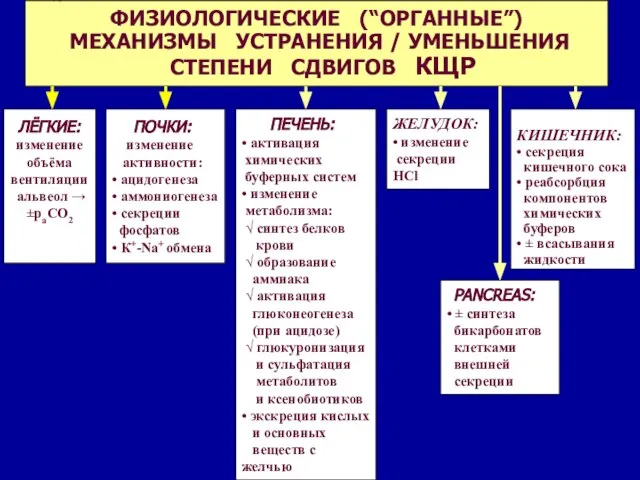
- 14. Факторы, изменяющие pH Дыхание Почки Печень
- 15. Буферные системы организма 1. Стабильность (поддержание) pH преимущественно обеспечивается активностью буферных систем 3. Оперативная регуляция pH
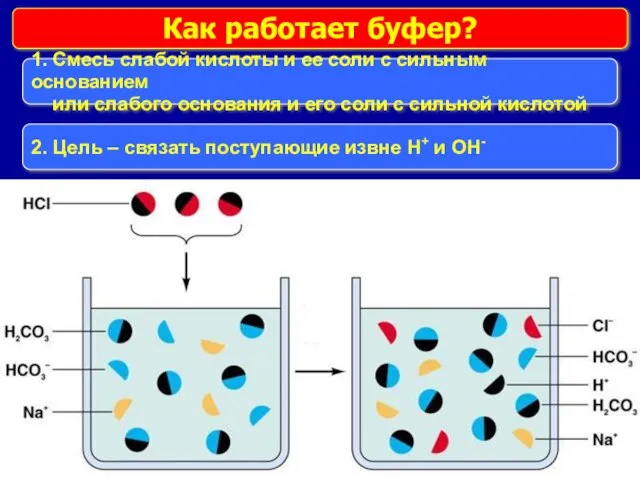
- 16. Как работает буфер? 1. Смесь слабой кислоты и ее соли с сильным основанием или слабого основания
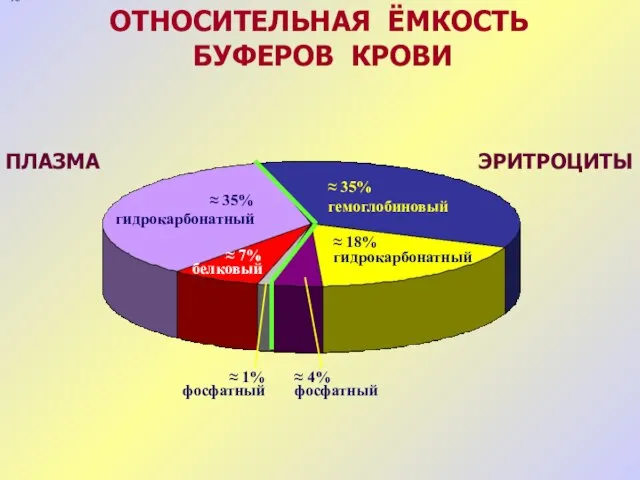
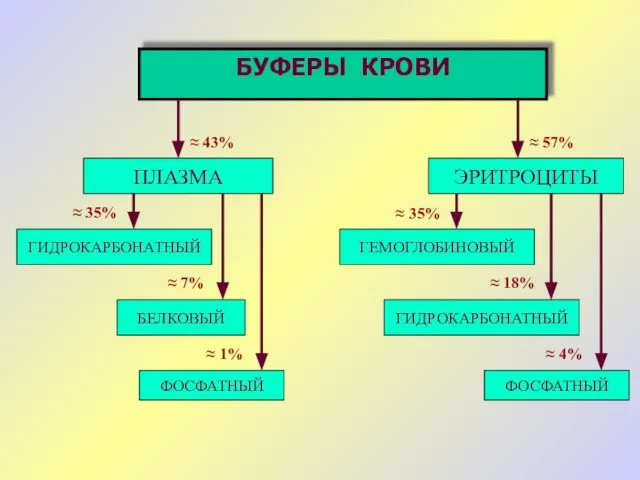
- 17. БФ в крови Tканевые БС Буферные системы организма HCO3- гемоглобин белковая фосфатная Mышцы Кости
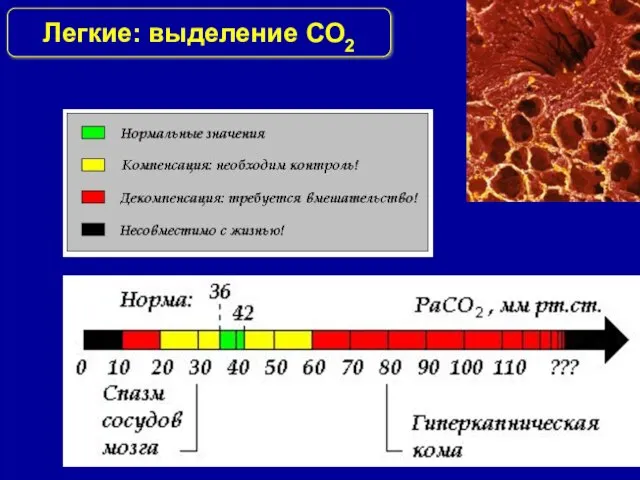
- 20. Респираторные механизмы поддержания pH 1. Пр каждом выдохе организм выделяет CO2 и H2O 3. Изменения параметров
- 21. Легкие: выделение СО2
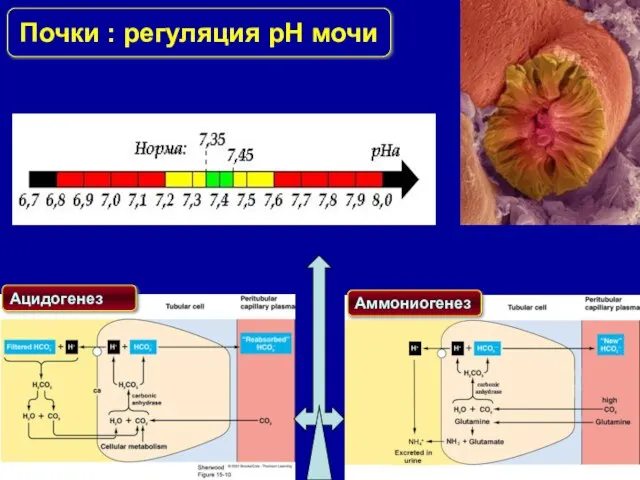
- 22. Почечные механизмы поддержания pH 1. Почки – наиболее эффективный регулятор pH крови 2. Почки экскретируют большее
- 23. Почки : регуляция pH мочи Ацидогенез Аммониогенез
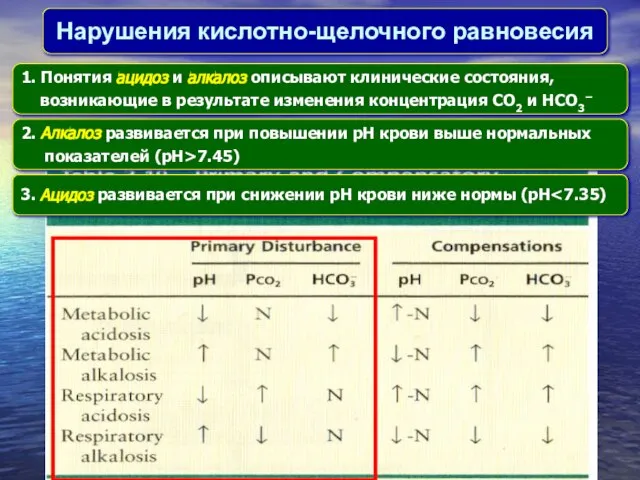
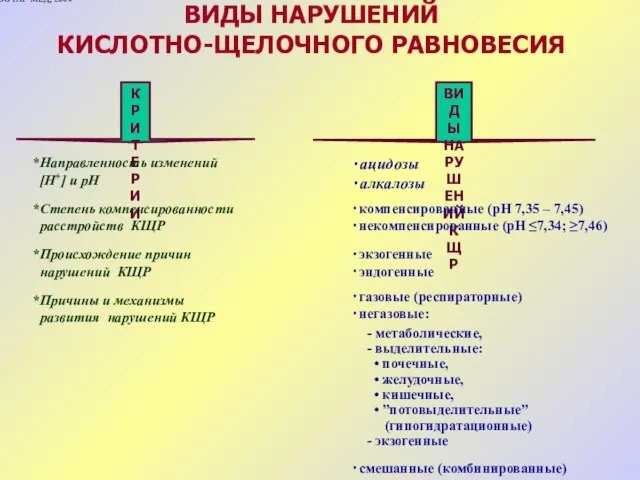
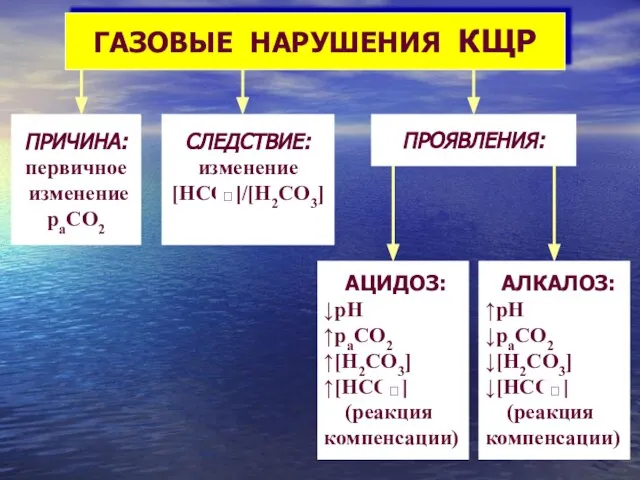
- 25. Нарушения кислотно-щелочного равновесия 1. Понятия aцидоз и aлкалоз описывают клинические состояния, возникающие в результате изменения концентрация
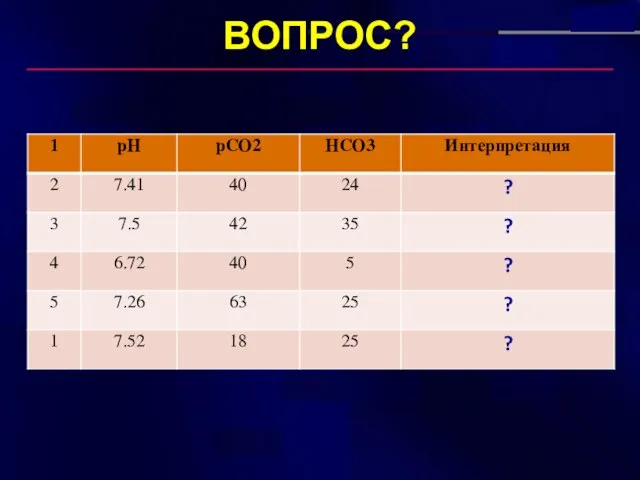
- 27. ВОПРОС?
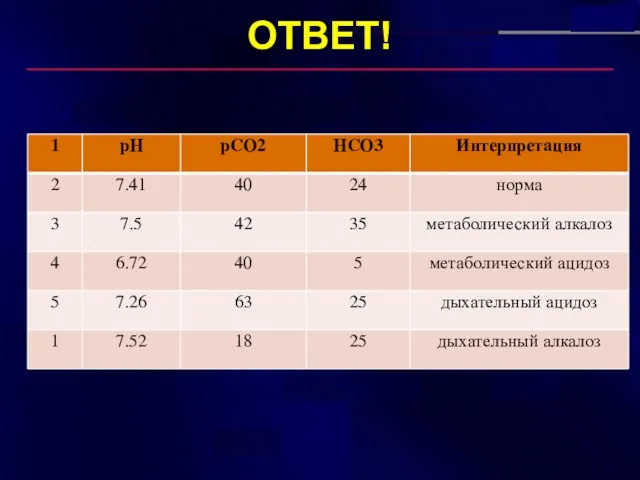
- 28. ОТВЕТ!
- 29. ПОМОЩЬ!
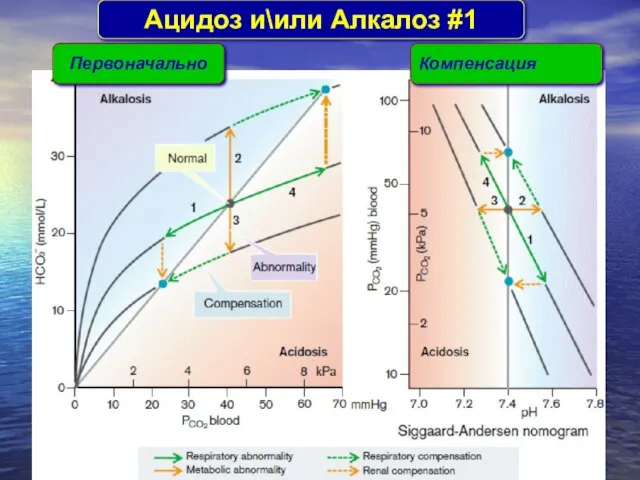
- 30. Aцидоз и\или Aлкалоз #1 Первоначально Компенсация
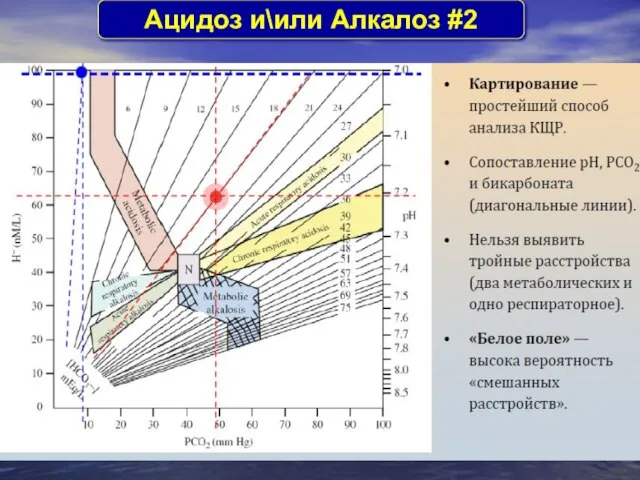
- 31. Aцидоз и\или Aлкалоз #2
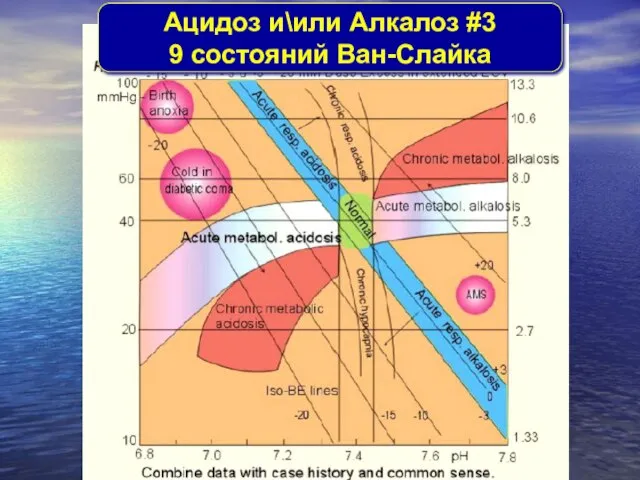
- 32. Aцидоз и\или Aлкалоз #3 9 состояний Ван-Слайка
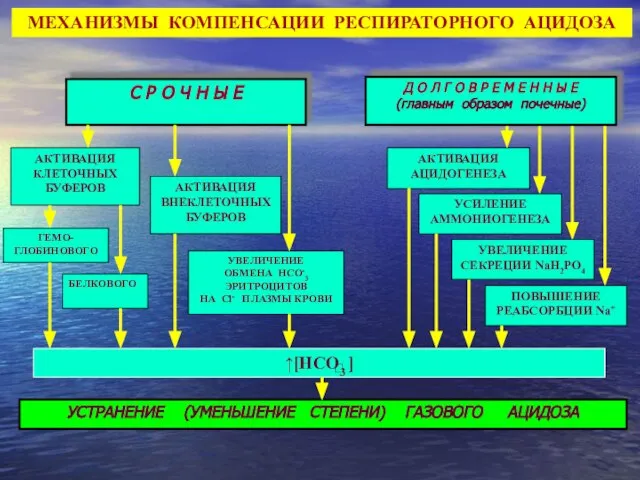
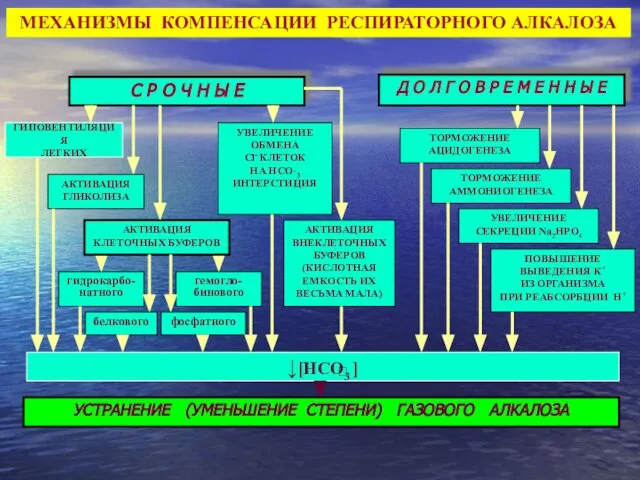
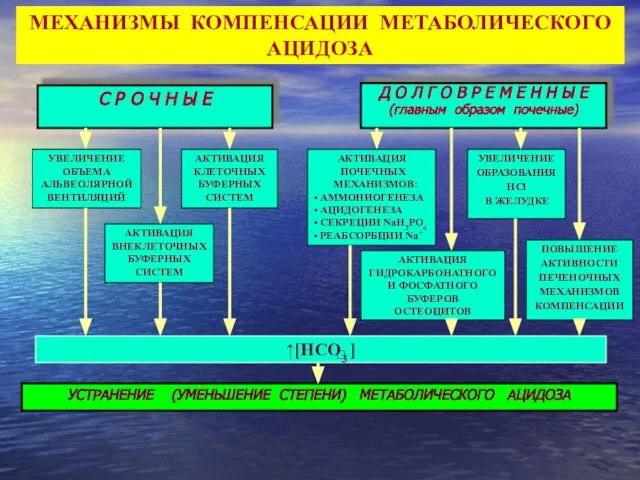
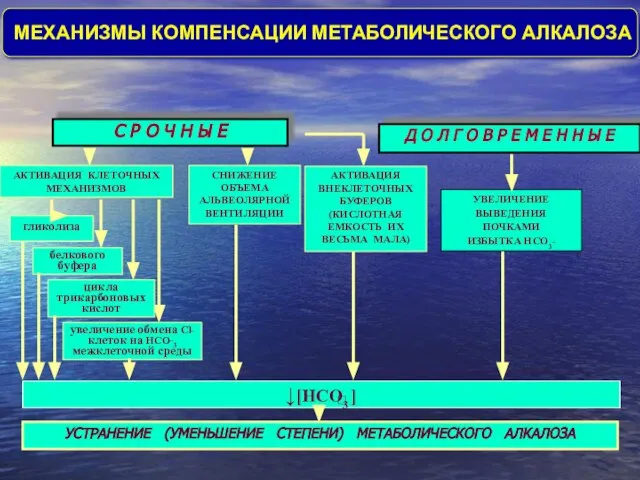
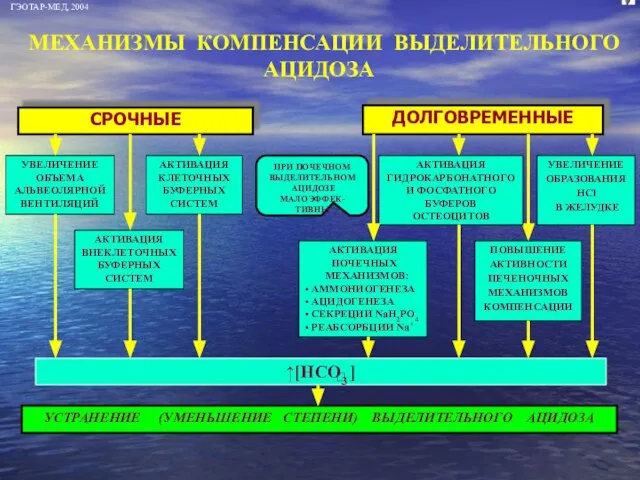
- 38. Д О Л Г О В Р Е М Е Н Н Ы Е С Р
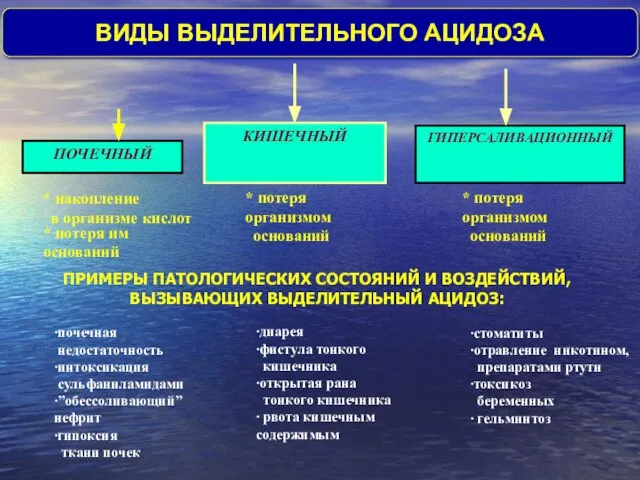
- 39. * накопление в организме кислот * потеря организмом оснований * потеря организмом оснований * потеря им
- 41. *потеря HCl желудочного сока *увеличение реаб-сорбции оснований *увеличение выве-дения К+ через кишечник *повышение выведе-ния хлоридов, К+
- 43. Скачать презентацию













 Кабинет химии
Кабинет химии Тест по неметаллам
Тест по неметаллам Непредельные карбоновые кислоты
Непредельные карбоновые кислоты Предельные одноатомные спирты
Предельные одноатомные спирты Простые вещества - металлы
Простые вещества - металлы Возможности модернизации совместного производства фенола и ацетона кумольным способом
Возможности модернизации совместного производства фенола и ацетона кумольным способом Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"
Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"  Определение времени прохождения диффузии
Определение времени прохождения диффузии Алкины
Алкины Химическая связь
Химическая связь Термодинамика и теплопередача. Реальные газы
Термодинамика и теплопередача. Реальные газы Вода. Физические свойства воды
Вода. Физические свойства воды Водород. Свойства, применение
Водород. Свойства, применение Химическая связь
Химическая связь Аналитическая химия
Аналитическая химия ZnS и ZnSe как оптические материалы,люминофоры, лазерные матрицы
ZnS и ZnSe как оптические материалы,люминофоры, лазерные матрицы Моющие и чистящие средства
Моющие и чистящие средства Физическое явление в химии
Физическое явление в химии Межмолекулярные взаимодействия (лекция 4)
Межмолекулярные взаимодействия (лекция 4) Биосенсоры. Основные принципы (лекция 2)
Биосенсоры. Основные принципы (лекция 2) Правила заполнения орбиталей электронами
Правила заполнения орбиталей электронами Строение электронных оболочек атома
Строение электронных оболочек атома Типы химических реакций
Типы химических реакций Флэшмоб: Лаборатория на кухне
Флэшмоб: Лаборатория на кухне Определение формул органических веществ. Задачи для самостоятельного решения
Определение формул органических веществ. Задачи для самостоятельного решения Кислоты. Классификация кислот
Кислоты. Классификация кислот Курсовая работа. Синтез адипиновой кислоты
Курсовая работа. Синтез адипиновой кислоты Химическое равновесие и способы его смещения. Принцип Ле Шателье. 9 класс
Химическое равновесие и способы его смещения. Принцип Ле Шателье. 9 класс