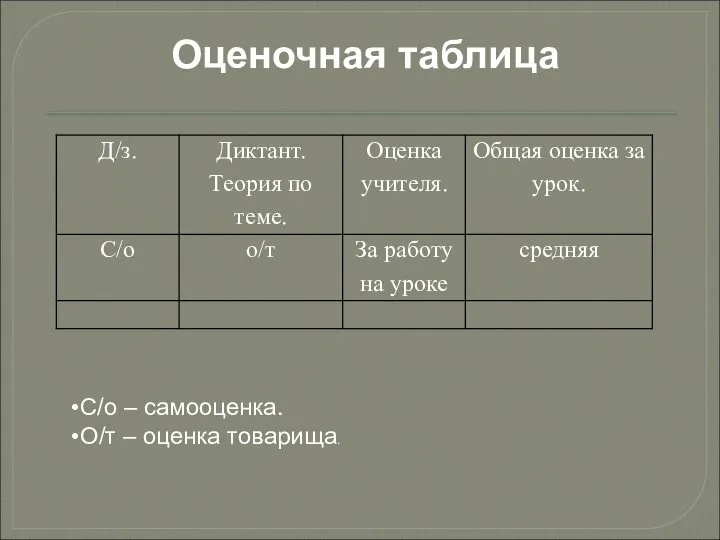
Слайд 2Оценочная таблица
С/о – самооценка.
О/т – оценка товарища.
Слайд 3Домашнее задание
Упражнение 2: Запишите уравнения следующих реакций замещения:
а)оксид железа(III) + Алюминий →

…..
Ответ: Fe2O3 + 2Al→2Fe + Al2O3
Б)оксид железа(III) + водород→ …..
Ответ: Fe2O3 + 3H2 →3H2O + 2Fe
Нет ошибок – отметка «5»
1 ошибка – отметка «4»
2 ошибки – отметка «3»
Слайд 4Правильные ответы:
3CuCl2+2Al = 2AlCl3+3Cu
Ca+2HCl = CaCl2 + H2
3. 2Al + H2SO4→Al2(SO4)3+H2
4P+5O2→P2O5
Разложения
Соединения
Нет

ошибок – отметка «5»
1 ошибка – отметка «4»
2 ошибки – отметка «3»
Слайд 5Чем отличаются эти реакции?
Fe+Cl2=FeCl2
2HgO?2Hg+O2
Fe+CuSO4=FeSO4+Cu
CaCO3 + 2HCl = CaCl2 + H2CO3

Слайд 6Цели урока
На урок пришли мы дружно
Что же здесь узнать нам нужно?
Суть реакции

обмена
Всем умело объяснять!
Уметь писать все уравнения
И предвидеть, что писать!
Слайд 7Реакции обмена - это такие реакции, в результате которых два сложных вещества

обмениваются своими составными частями.
AB+CD = AC+BD
Fe(NO3)3 + 3NaOH=
FeCl3 + NaOH =
Например
2NaI+Pb(NO3)2 = PbI2↓ + 2NaNO3
Слайд 8Два сложных вещества в реакцию вступают
В ходе которой, свои составные части меняют.
Вот

такой процесс взаимозамены
Называют реакцией обмена
Слайд 92NaOH + CuCl2 = Cu(OH)2 ↓+ 2NaCl

Слайд 10Реакции нейтрализации – это реакции обмена между кислотами и щелочами.
KOH+ H2SO4 =

K2SO4 + H2O
NaOH + HCl =
Слайд 11Na2CO3 + 2HCl = 2NaCl + H2CO3
H2CO3 = H2O + CO2↑
Поэтому уравнение

реакции следует записать так:
Na2CO3 + 2HCl =2NaCl+H2O+CO2↑
Слайд 12Реакции обмена, протекающие в растворах, идут до конца только в том случае,

если в результате их образуется осадок, газ или вода
Слайд 13Если выделится газ - Это раз;
И получится вода - Это два;
А еще

- нерастворимый
Осаждается продукт…
"Есть осадок" - говорим мы.
Это третий важный пункт.
Химик правила обмена
Не забудет никогда:
В результате - непременно
Будет газ или вода,
Выпадет осадок - Вот тогда - порядок!
Слайд 14Если к раствору хлорида натрия прилить раствор гидроксида калия, то никаких признаков

реакции не будет – реакция не идет, так как в результате ее не образуется ни осадка, ни газа, ни воды:
NaCl + KOH = NaOH+KCL
Слайд 16Какие из реакций обмена будут протекать до конца?
BaCl2 + AgNO3→
Cu(NO3)2 + NaCl→
Pb(NO3)2

+ K2S→
Слайд 17Какие из реакций обмена будут протекать до конца?
MgCl2 + K2SO4→
HNO3 + ZnSO4→
Ca(NO3)2

+ H3PO4→
Ba(NO3)2 + Na2SO4→
Слайд 18Допишите уравнения химических реакций и укажите их тип:
K2O + N2O5 = KNO3
Fe2O3

+ C = Fe + CO2
Fe2O3 + HCl =
Fe(OH)3 = Fe2O3 + H2O
Al(OH)3+ H2SO4 =
N2O5 + H2O = HNO3
NH4Cl = NH3 + HCl
Al + H2SO4 =
Слайд 19Итоги урока
сегодня на уроке мы с вами изучили новый тип реакции –

реакции обмена.
Провели лабораторную работу.
Сформулировали правило, согласно которому протекают реакции обмена между растворами веществ.
Слайд 20Домашнее задание
обязательное: прочитать §32, задание № 1 на стр. 167;
дополнительное: задание №

2 на стр. 168;
творческое: создать презентацию на тему «Реакции обмена».
Слайд 21Сейчас прозвенит долгожданный звонок.
Увы, но к концу подошел наш урок.
Прошу, уберите рабочее

место.
Давайте без слов, и пожалуй, без жестов.
А я благодарность вам всем объявляю,
Проверив работы, в журнал выставляю
Отметки все ваши, надеюсь привычно
Что будут они «хорошо» и «отлично»
Большое спасибо я вам говорю
Мы цели достигли. Благодарю!



















 Терпеноиды. Эфирные масла
Терпеноиды. Эфирные масла Галогены – химические элементы
Галогены – химические элементы Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок
Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок Устный журнал из истории развития химии
Устный журнал из истории развития химии Общие химические свойства неметаллов
Общие химические свойства неметаллов Альдегиды, их химические и физические свойства. Получение и применение альдегидов
Альдегиды, их химические и физические свойства. Получение и применение альдегидов Строение электронных оболочек
Строение электронных оболочек G12 - класс антифризов
G12 - класс антифризов Амины. Классификация аминов
Амины. Классификация аминов Метаболизм липидов
Метаболизм липидов Моделирование деформаций углеродных слоёв при функционализации технического углерода
Моделирование деформаций углеродных слоёв при функционализации технического углерода Исследование реологических характеристик радиационносшитых водорастворимых полимеров с целью разработки новых составов для ГРП
Исследование реологических характеристик радиационносшитых водорастворимых полимеров с целью разработки новых составов для ГРП Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Сложные эфиры и жиры
Сложные эфиры и жиры Классификация химических реакций. 11 класс
Классификация химических реакций. 11 класс Материаловедение. Модуль
Материаловедение. Модуль Презентация на тему Подгруппа азота
Презентация на тему Подгруппа азота  Оксиды и основания
Оксиды и основания Химия неметаллов: углерод, кремний
Химия неметаллов: углерод, кремний Эксперимент с духами
Эксперимент с духами Ароматические и ненасыщенные альдегиды и кетоны
Ароматические и ненасыщенные альдегиды и кетоны Масс-спектрометрия – аналитический метод определения молекулярной массы свободных ионов в высоком вакууме
Масс-спектрометрия – аналитический метод определения молекулярной массы свободных ионов в высоком вакууме Химическая связь
Химическая связь Сырье, продукты, параметры гидроочистки
Сырье, продукты, параметры гидроочистки Кислоты в химии
Кислоты в химии Алкины
Алкины Презентация на тему Интересные факты из жизни Д. И. Менделеева
Презентация на тему Интересные факты из жизни Д. И. Менделеева  Магматические породы
Магматические породы