Содержание
- 2. ПЛАН ЛЕКЦИИ 1. Химическая термодинамика, как наука; ее задачи, достоинства и недостатки. 2. Основные понятия термодинамики:
- 3. Термодинамика - … … научная дисциплина, которая устанавливает точные соотношения между энергией и свойствами системы, не
- 4. Особенности термодинамики Не требует представлений о строении веществ и механизмах процессов. Используется для макросистем. Используется для
- 5. Основные понятия термодинамики Главная задача – научиться производить термодинамические расчёты и по результату делать выводы о
- 6. Термодинамические системы По характеру взаимодействия с окружающей средой делят на: Открытая Изолированная Закрытая
- 7. Состояние системы - … … совокупность всех химических и физических свойств системы. … характеризуют термодинамические параметры:
- 8. Функции состояния Н − энтальпия − тепловой эффект образования 1 моль вещества из простых веществ при
- 9. Первый закон термодинамики − … … одна из форм закона сохранения энергии. Его формулировки: 1. Энергия
- 10. Первый закон термодинамики в приложении к химическим реакциям ΔH = ΔE + pΔV Теплота, подведённая к
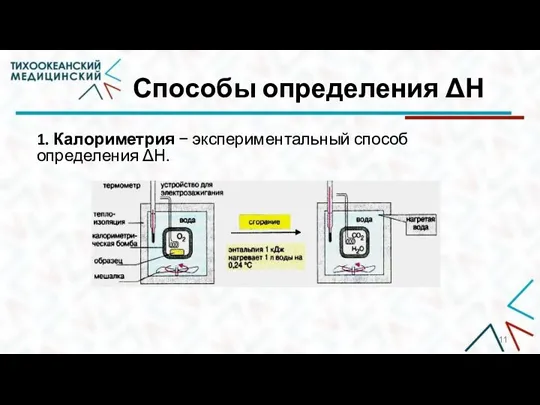
- 11. Способы определения ΔН 1. Калориметрия − экспериментальный способ определения ΔН.
- 12. Способы определения ΔН 2. Закон Гесса − изменение энтальпии в химической реакции зависит только от вида
- 13. Способы определения ΔН 3. Следствия из закона Гесса I-ое следствие: II-ое следствие: Реакция сгорания – процесс
- 14. Основные правила, используемые в расчётах ΔΗ реакции Изменение энтальпии (ΔН) прямо пропорционально количеству исходных веществ и
- 15. Для расчёта уровня основного обмена в организме. Основной обмен – скорость выделения организмом тепла в состоянии
- 16. Калорийность пищевых продуктов, представленная в виде их Е эквивалента
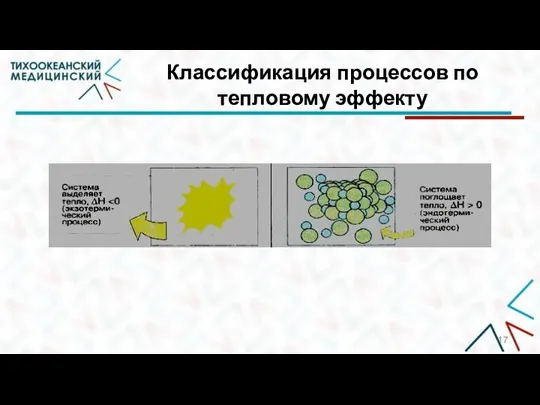
- 17. Классификация процессов по тепловому эффекту
- 18. I закон термодинамики позволяет определить ΔΗреакции, но не даёт ответа на вопрос о её направлении. Ответ
- 19. Второе начало термодинамики Энтропия (S) − мера рассеянной или обесцененной энергии. “Теплота сама по себе не
- 20. Второе начало термодинамики В самопроизвольном процессе В равновесном процессе Для изолированной системы, где Q = 0:
- 21. Стандартная энтропия. Расчёт
- 22. Статистическая природа S W – число различных состояний системы, доступное ей при данных условиях, или термодинамическая
- 23. Лизосома Приложение 2-го начала к биосистемам Катаболизм в лизосоме
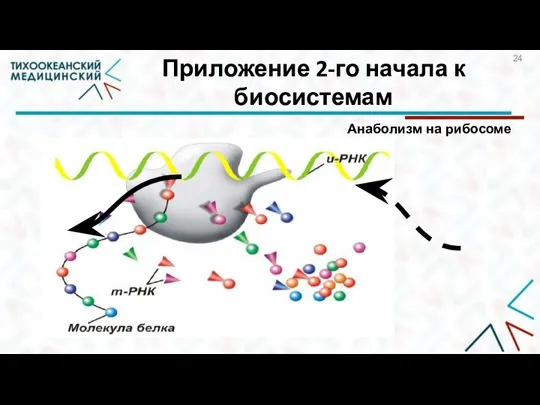
- 24. Приложение 2-го начала к биосистемам Анаболизм на рибосоме
- 25. Уравнение Гиббса… … является объединённым выражением I и II начал термодинамики. Для данной температуры ΔG =
- 26. Физический смысл G - …
- 27. Соотношение энтальпийного и энтропийного факторов
- 28. Реакции обмена Экзэргонические − реакции обмена, идущие с выделением энергии (ΔG Эндэргонические − реакции обмена, идущие
- 29. Макроэрги
- 30. Критерии равновесия Для обратимой реакции: aA + bB ↔ xX + yY при постоянном давлении и
- 31. Уравнение изотермы химической реакции Для процесса в общем виде: В положении равновесия: Якоб Хендрик Вант-Гофф (1852-1911)
- 32. Соотношение Пс и Кр
- 33. Уравнение изобары химической реакции Ограничение: ΔТ − должна быть небольшой.
- 34. Влияние давления на смещение равновесия Δn = (x + y) − (a + b) Δn −
- 35. Принцип подвижного равновесия При изменении одного из условий химического равновесия оно смещается в сторону той реакции,
- 37. Скачать презентацию































 Минеральные кислоты. Взаимодействие с простыми веществами
Минеральные кислоты. Взаимодействие с простыми веществами Легированные стали
Легированные стали Коррозия металлов
Коррозия металлов Простые вещества - неметаллы
Простые вещества - неметаллы Металлы и их соединения
Металлы и их соединения Физический этап развития периодического закона
Физический этап развития периодического закона Ароматические углеводороды. Арены
Ароматические углеводороды. Арены Атом. Ядро и электронная оболочка. Изотопы. Строение электронных оболочек атома. Понятие об орбиталях
Атом. Ядро и электронная оболочка. Изотопы. Строение электронных оболочек атома. Понятие об орбиталях Кислоты. Классификация кислот
Кислоты. Классификация кислот Коррозия металлов и борьба с ней. Лабораторная работа
Коррозия металлов и борьба с ней. Лабораторная работа Агрегатное состояние вещества
Агрегатное состояние вещества Круговорот азота
Круговорот азота Химия – это наука о …
Химия – это наука о … Дисперсные системы
Дисперсные системы Электролитическая диссоциация. 8 класс
Электролитическая диссоциация. 8 класс Презентация на тему Оксиды. Основания. Кислоты
Презентация на тему Оксиды. Основания. Кислоты  Химические элементы
Химические элементы Phosphorus
Phosphorus Азот в сельском хозяйстве
Азот в сельском хозяйстве ЭТА УВЛЕКАТЕЛЬНАЯ ХИМИЯ… Первый урок химии в 8 классе Абрамова С.И., учитель химии МОУ «Лихославльская СОШ №2» Тверской области
ЭТА УВЛЕКАТЕЛЬНАЯ ХИМИЯ… Первый урок химии в 8 классе Абрамова С.И., учитель химии МОУ «Лихославльская СОШ №2» Тверской области Простые вещества - металлы
Простые вещества - металлы Полимеры в медицине
Полимеры в медицине Магматические породы
Магматические породы Обмен и функции нуклеотидов
Обмен и функции нуклеотидов Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс
Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс Основания: определение, классификация, химические свойства
Основания: определение, классификация, химические свойства Натуральные и синтетические каучуки
Натуральные и синтетические каучуки Оксиды азота. Азотная кислота
Оксиды азота. Азотная кислота