Содержание
- 2. Основания - сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (-ОН). Хорошо
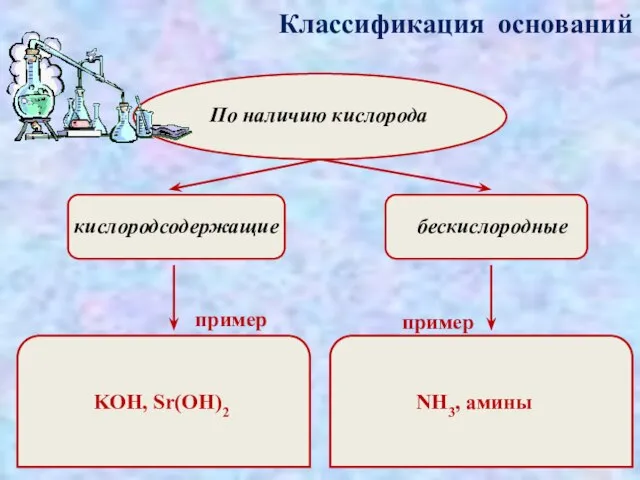
- 3. Классификация оснований По наличию кислорода кислородсодержащие бескислородные пример пример KOH, Sr(OH)2 NH3, амины
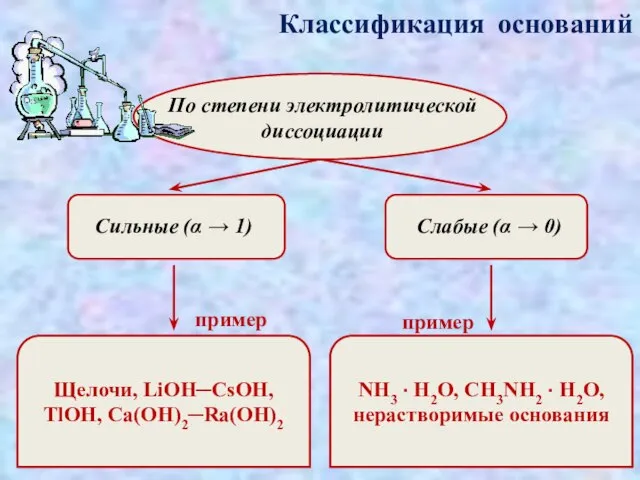
- 4. Классификация оснований По степени электролитической диссоциации Сильные (α → 1) Слабые (α → 0) пример пример
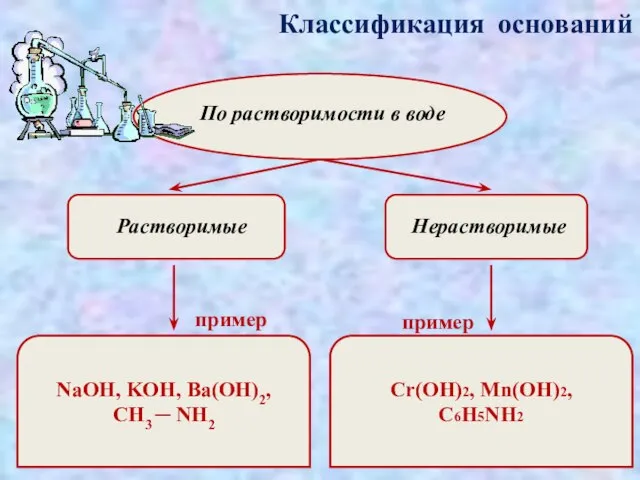
- 5. Классификация оснований По растворимости в воде Растворимые Нерастворимые пример пример NaOH, KOH, Ba(OH)2, CH3 ─ NH2
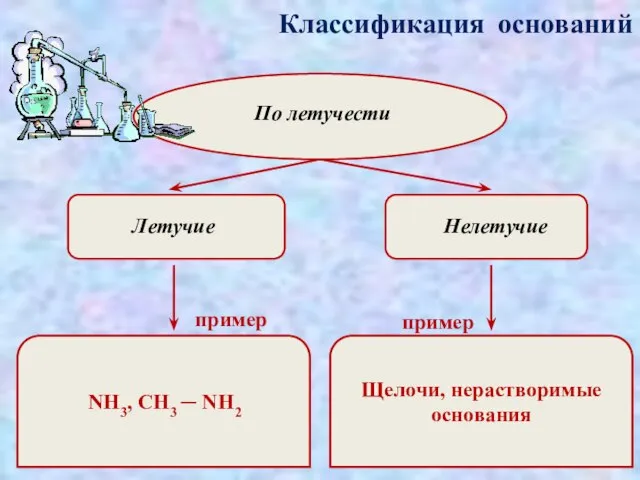
- 6. Классификация оснований По летучести Летучие Нелетучие пример пример NH3, CH3 ─ NH2 Щелочи, нерастворимые основания
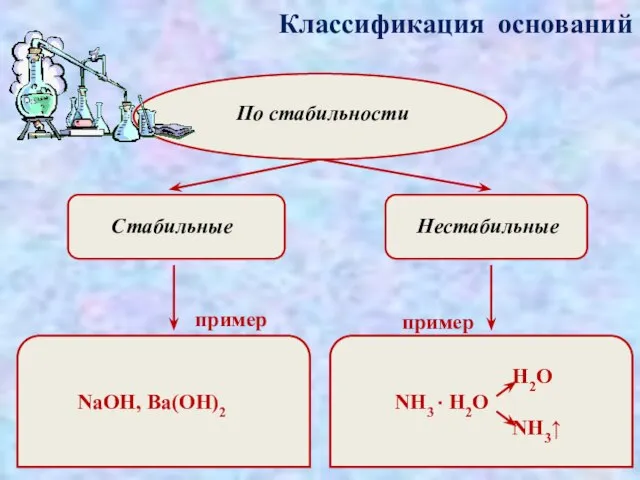
- 7. Классификация оснований По стабильности Стабильные Нестабильные пример пример NaOH, Ba(OH)2 H2O NH3 · H2O NH3↑
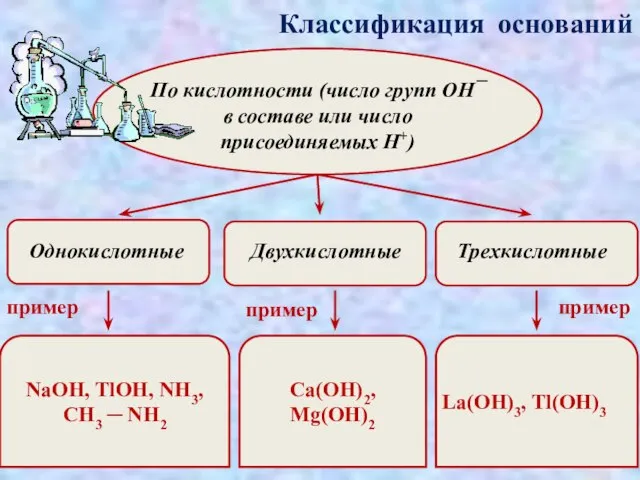
- 8. Классификация оснований По кислотности (число групп ОН¯ в составе или число присоединяемых H+) пример пример NaOH,
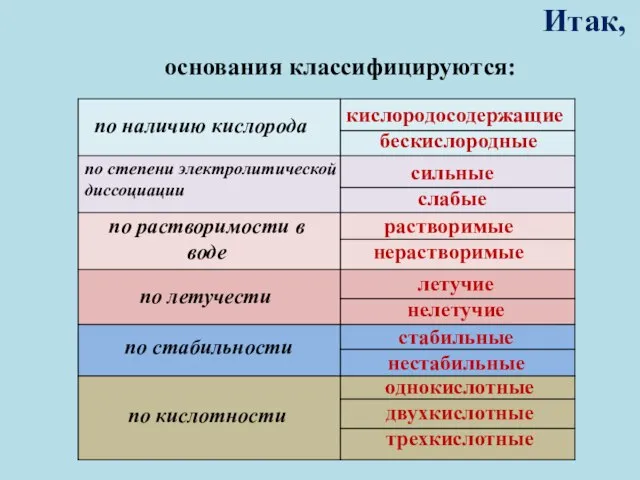
- 9. Итак, основания классифицируются: по наличию кислорода по степени электролитической диссоциации по растворимости в воде по летучести
- 10. Химические свойства оснований Взаимодействие с кислотами Все группы оснований объединяет их общее свойство - взаимодействие с
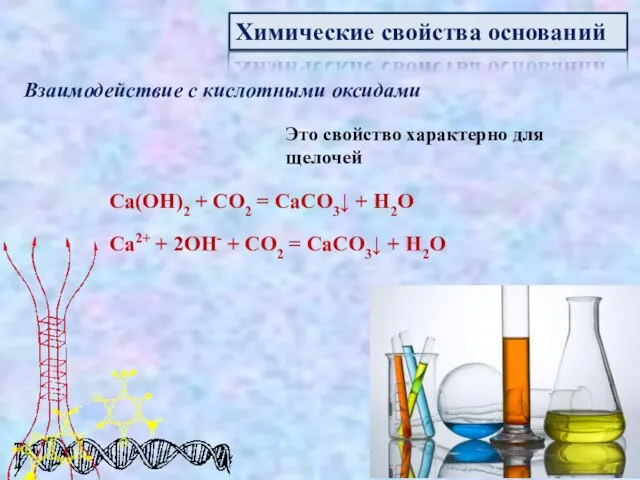
- 11. Химические свойства оснований Взаимодействие с кислотными оксидами Это свойство характерно для щелочей Ca(OH)2 + CO2 =
- 12. Химические свойства оснований Взаимодействие с солями Эти химические реакции подчиняются общему правилу условий протекания реакций между
- 13. Химические свойства оснований Взаимодействие с амфотерными гидроксидами и оксидами а) при сплавлении: 2NaOH + ZnO =
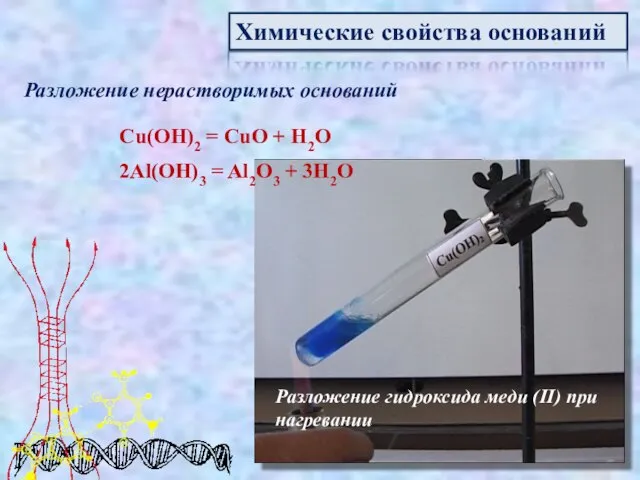
- 14. Химические свойства оснований Разложение нерастворимых оснований Cu(OH)2 = CuO + H2O 2Al(OH)3 = Al2O3 + 3H2O
- 15. Закрепляем тему Вопрос № 1 К реакции нейтрализации можно отнести взаимодействие
- 16. Закрепляем тему Вопрос № 2 При нагревании будет разлагаться на оксид и воду
- 17. Закрепляем тему Вопрос № 3 При обычных условиях основания
- 18. Закрепляем тему Вопрос № 4 Соль и вода образуются при взаимодействии
- 19. Закрепляем тему Вопрос № 5 Будет вступать в реакцию с соляной кислотой
- 20. Закрепляем тему Вопрос № 6 При приливании раствора гидроксида натрия к раствору сульфата меди (II)
- 21. Закрепляем тему Вопрос № 7 В растворах щелочей лакмус и метилоранж соответственно изменяют свои цвета на
- 22. Закрепляем тему Вопрос № 8 В уравнении реакции натрия с водой коэффициент перед водородом равен
- 23. Закрепляем тему Вопрос № 9 В реакцию с гидроксидом бария вступает
- 24. Правильные ответы Вопрос № 1 Вопрос № 2 Вопрос № 3 Вопрос № 4 Вопрос №
- 26. Скачать презентацию














 Применение неметаллов
Применение неметаллов Строение веществ
Строение веществ Смолисто-асфальтеновые вещества
Смолисто-асфальтеновые вещества Серебро
Серебро Полисульфидные каучуки
Полисульфидные каучуки Химия и производство
Химия и производство Нанокристаллические и аморфные металлы и сплавы
Нанокристаллические и аморфные металлы и сплавы Степень окисления
Степень окисления Строение и функции нуклеиновых кислот. Лекция №3
Строение и функции нуклеиновых кислот. Лекция №3 Ліпіди
Ліпіди Коррозия металлов
Коррозия металлов Взаимодействие атомов элементов-неметаллов между собой
Взаимодействие атомов элементов-неметаллов между собой Соли (8 класс)
Соли (8 класс) Разбор заданий на амины
Разбор заданий на амины Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы"
Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы"  Изучение фотокатализа в химии
Изучение фотокатализа в химии Индиго-краситель
Индиго-краситель Альдегиды и кетоны
Альдегиды и кетоны Общая и неорганическая химия. Строение атома и периодическая система. Химическая связь и строение вещества
Общая и неорганическая химия. Строение атома и периодическая система. Химическая связь и строение вещества Article review. Getting a two-component cold-cast products in polyurethane silicone mold in a vacuum
Article review. Getting a two-component cold-cast products in polyurethane silicone mold in a vacuum Физические свойства металлов
Физические свойства металлов nukleinovye_kisloty
nukleinovye_kisloty каталитические системы на основе металлоценов и метилалюмоксана в реакциях непредельных соединений с изобутиланами
каталитические системы на основе металлоценов и метилалюмоксана в реакциях непредельных соединений с изобутиланами Кинетика катодного выделения водорода на дисилициде хрома в щелочном и кислом электролитах
Кинетика катодного выделения водорода на дисилициде хрома в щелочном и кислом электролитах Соли. Свойства. Получение
Соли. Свойства. Получение d-элементы.Распространение в природе и основные материалы
d-элементы.Распространение в природе и основные материалы Улеводы Моносахариды
Улеводы Моносахариды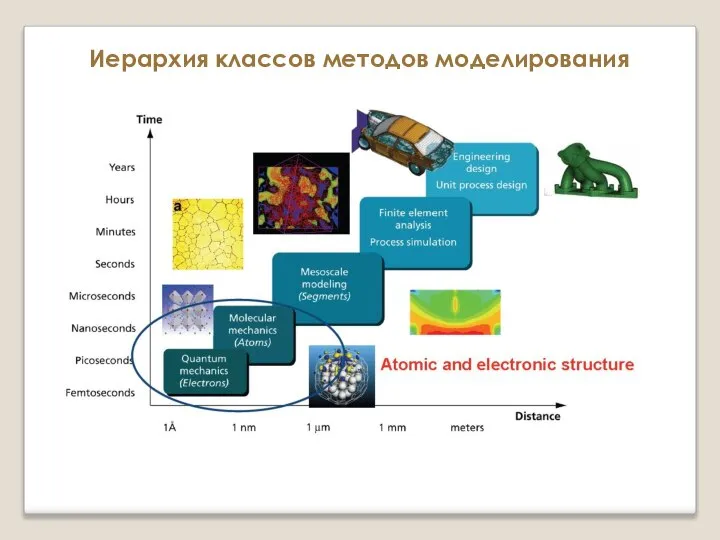 Иерархия классов методов моделирования. Атомистические и микроскопические методы
Иерархия классов методов моделирования. Атомистические и микроскопические методы