Содержание
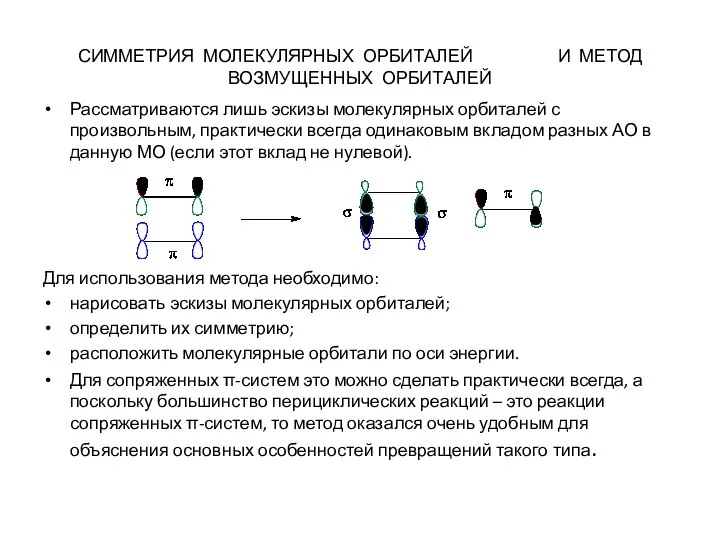
- 2. СИММЕТРИЯ МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ И МЕТОД ВОЗМУЩЕННЫХ ОРБИТАЛЕЙ Рассматриваются лишь эскизы молекулярных орбиталей с произвольным, практически всегда
- 3. Теория возмущений молекулярных орбиталей Основной вопрос, на который отвечает теория ВМО: как будет изменяться энергия системы
- 4. Предполагается, что при перекрывании орбиталей реагирующих молекул две (или большее число) первоначально невозмущенные (базисные) орбитали взаимодействуют
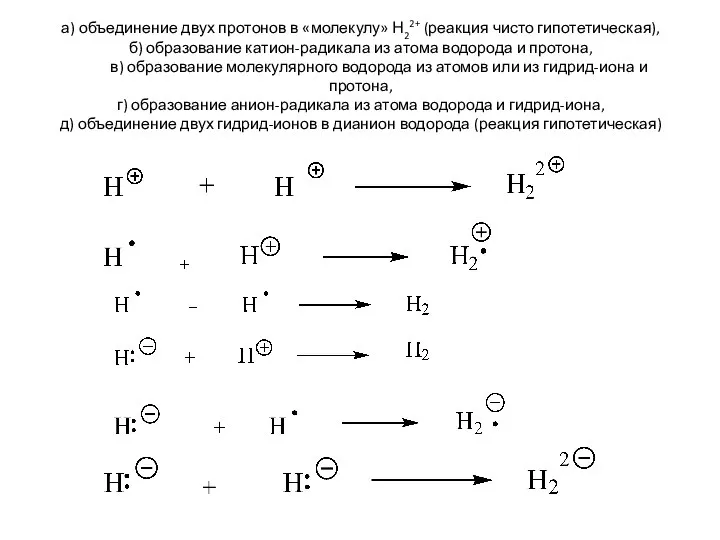
- 5. а) объединение двух протонов в «молекулу» Н22+ (реакция чисто гипотетическая), б) образование катион-радикала из атома водорода
- 6. Во всех этих случаях сближающиеся частицы имеют по одной 1s-атомной орбитали (1s-АО). Согласно теории возмущения, при
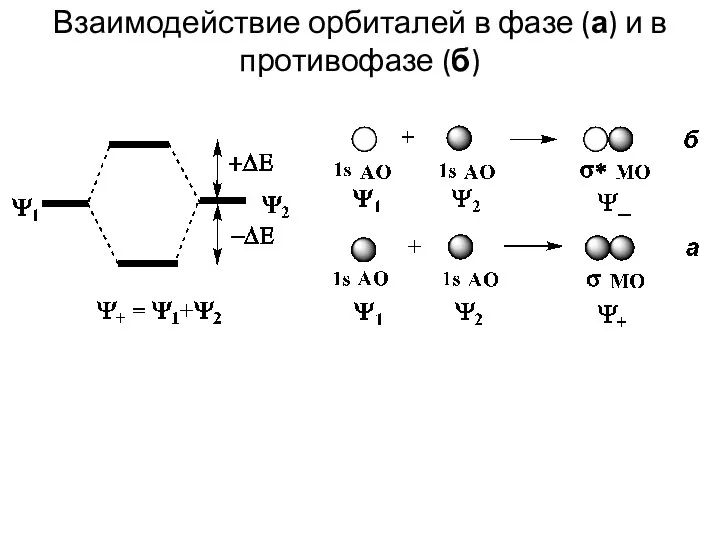
- 7. Взаимодействие орбиталей в фазе (а) и в противофазе (б)
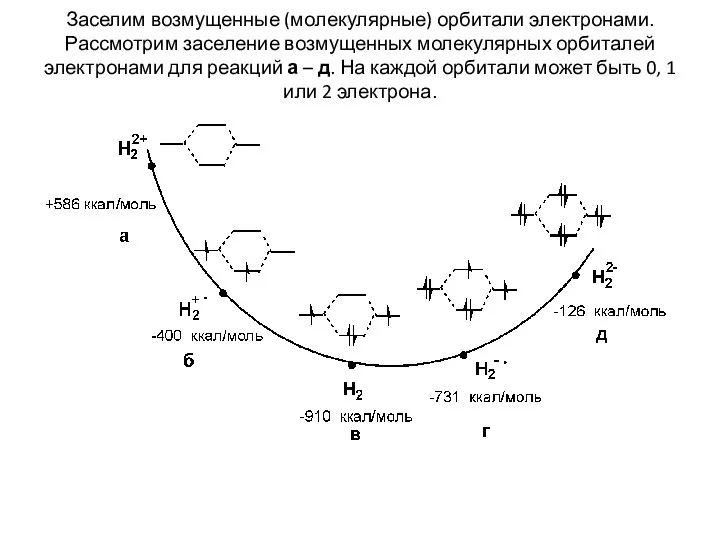
- 8. Заселим возмущенные (молекулярные) орбитали электронами. Рассмотрим заселение возмущенных молекулярных орбиталей электронами для реакций а – д.
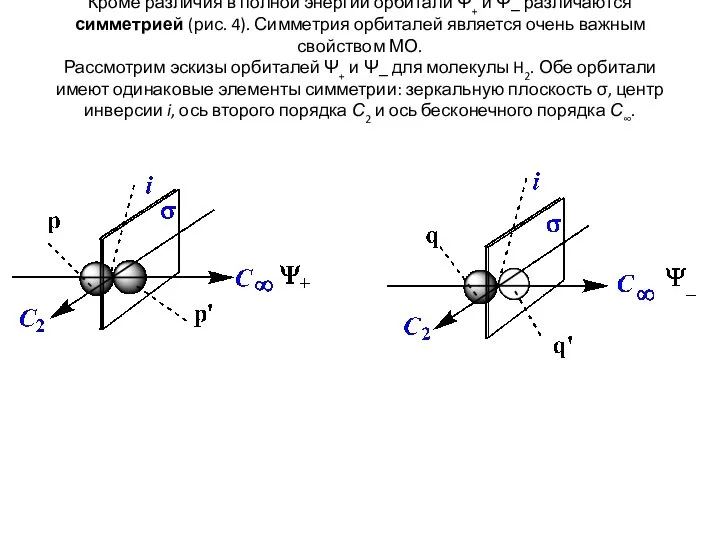
- 9. Кроме различия в полной энергии орбитали Ψ+ и Ψ_ различаются симметрией (рис. 4). Симметрия орбиталей является
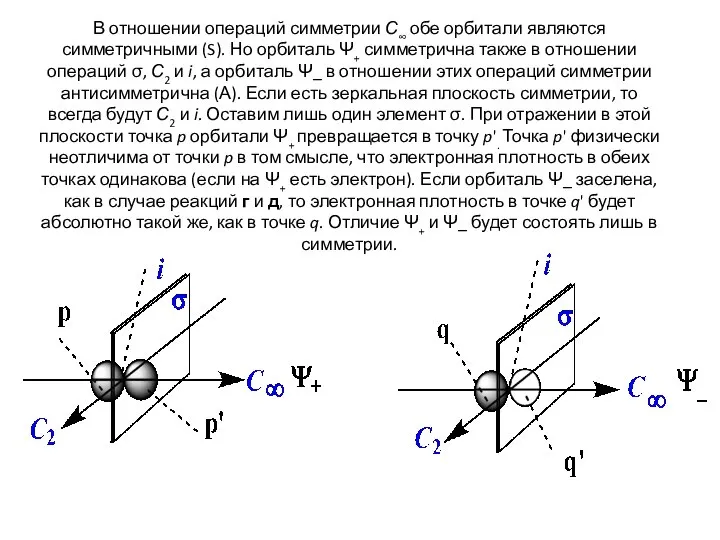
- 10. В отношении операций симметрии С∞ обе орбитали являются симметричными (S). Но орбиталь Ψ+ симметрична также в
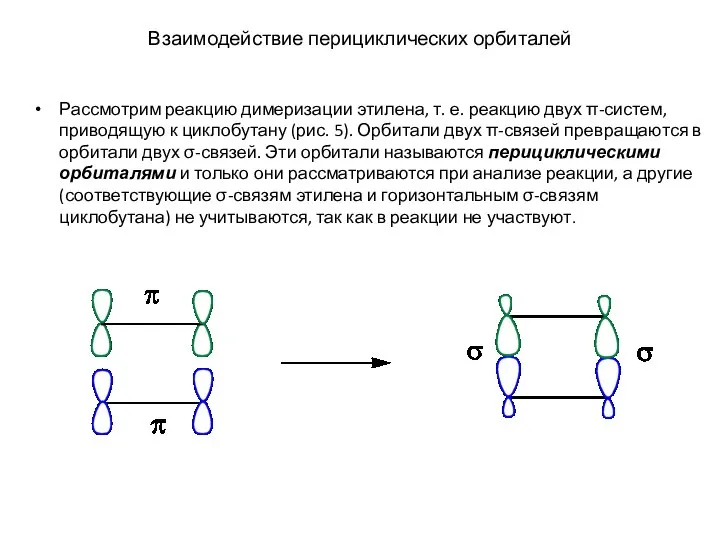
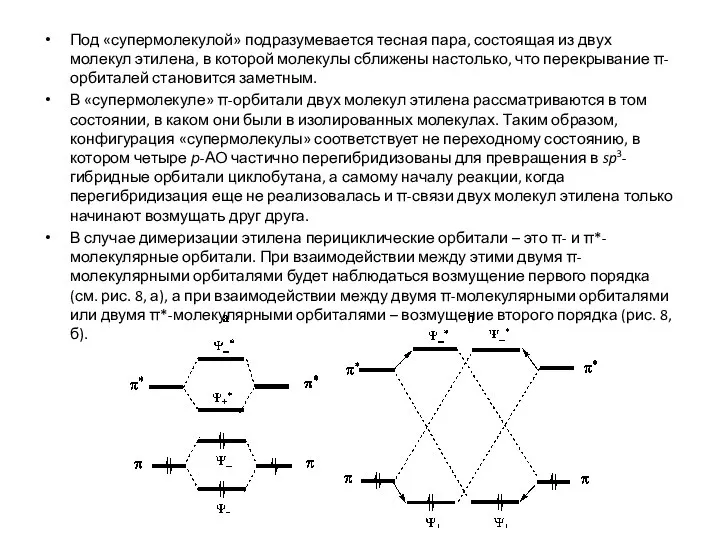
- 11. Взаимодействие перициклических орбиталей Рассмотрим реакцию димеризации этилена, т. е. реакцию двух π-систем, приводящую к циклобутану (рис.
- 12. Перициклические орбитали – это орбитали образующихся и разрывающихся связей. Возможность осуществления реакции при сближении двух молекул
- 13. Возмущение, описывающееся уравнениями (1), называется возмущением первого порядка. Базисные молекулярные орбитали имеют разную энергию (рис. 6,
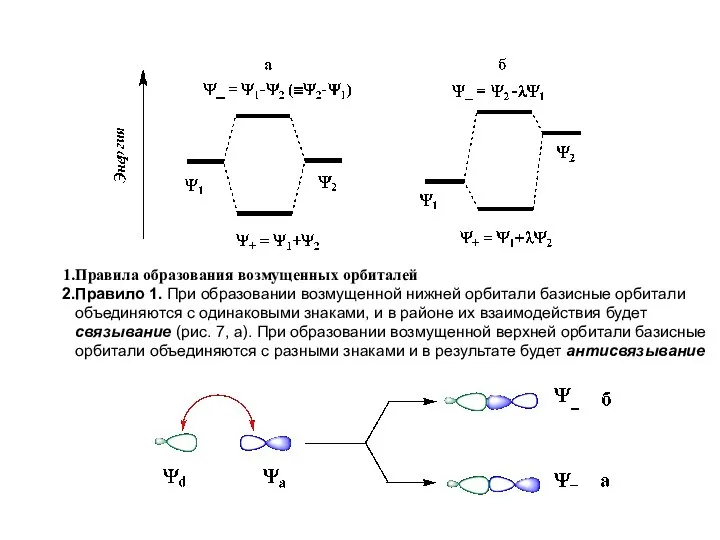
- 14. Правила образования возмущенных орбиталей Правило 1. При образовании возмущенной нижней орбитали базисные орбитали объединяются с одинаковыми
- 15. Правило 2. Если возмущенные орбитали имеют разную энергию, возмущение приводит к тому, что энергия орбиталей, первоначально
- 16. Под «супермолекулой» подразумевается тесная пара, состоящая из двух молекул этилена, в которой молекулы сближены настолько, что
- 17. Симметрия молекулярных орбиталей 2.2.1. Точечные группы симметрии Операции симметрии, которые будут рассмотрены, таковы, что, по крайней
- 18. Собственная ось симметрии. Все молекулы имеют ось С1, поскольку в любом случае поворот на 360о возвращает
- 20. Скачать презентацию








 Биологически важные реакции монофункциональных соединений. Реакционная способность альдегидов, кетонов, карбоновых кислот
Биологически важные реакции монофункциональных соединений. Реакционная способность альдегидов, кетонов, карбоновых кислот Строение и свойства металлов. Материаловедение. Лекция 1
Строение и свойства металлов. Материаловедение. Лекция 1 Номенклатура и изомерия карбоновых кислот
Номенклатура и изомерия карбоновых кислот Элементы vi группы главной подгруппы. Халькогены (рождающие руды)
Элементы vi группы главной подгруппы. Халькогены (рождающие руды) Растворение. Растворы. Свойства растворов электролитов, ионные уравнения, ОВР
Растворение. Растворы. Свойства растворов электролитов, ионные уравнения, ОВР Как осуществить цепочку превращений на основании положений теории электролитической диссоциации?
Как осуществить цепочку превращений на основании положений теории электролитической диссоциации? Строение органических веществ
Строение органических веществ Леция 1. Природа сил взаимодействия. Методы исследования комплексообразования:
Леция 1. Природа сил взаимодействия. Методы исследования комплексообразования: Молекула воды, какая ты?
Молекула воды, какая ты? Самородные минералы
Самородные минералы Горные породы
Горные породы Получение и свойства кислорода. Практическая работа
Получение и свойства кислорода. Практическая работа Простые и сложные вещества (8 класс)
Простые и сложные вещества (8 класс) Презентация на тему Подгруппа углерода
Презентация на тему Подгруппа углерода  Открытый урок по химии в 8 классе по теме: «Первоначальные химические понятия». Учитель химии ГБОУ СОШ № 650 Безверхова Олеся Влад
Открытый урок по химии в 8 классе по теме: «Первоначальные химические понятия». Учитель химии ГБОУ СОШ № 650 Безверхова Олеся Влад Реакции этерификации
Реакции этерификации Электрохимическая коррозия
Электрохимическая коррозия Периодическая система Д.И.Менделеева
Периодическая система Д.И.Менделеева Пятичленные гетероциклы с двумя и более атомами азота
Пятичленные гетероциклы с двумя и более атомами азота Строение вещества
Строение вещества Презентация на тему Движение электрона в атоме
Презентация на тему Движение электрона в атоме  Алкины. Способы получения
Алкины. Способы получения Углеводы
Углеводы gidroliz_soley (1)
gidroliz_soley (1) Олимпиадная подготовка
Олимпиадная подготовка Презентация на тему Неорганічні речовини живих організмів
Презентация на тему Неорганічні речовини живих організмів  Составление химических формул методом нулевой суммы
Составление химических формул методом нулевой суммы Амфотерные гидроксиды
Амфотерные гидроксиды