Содержание
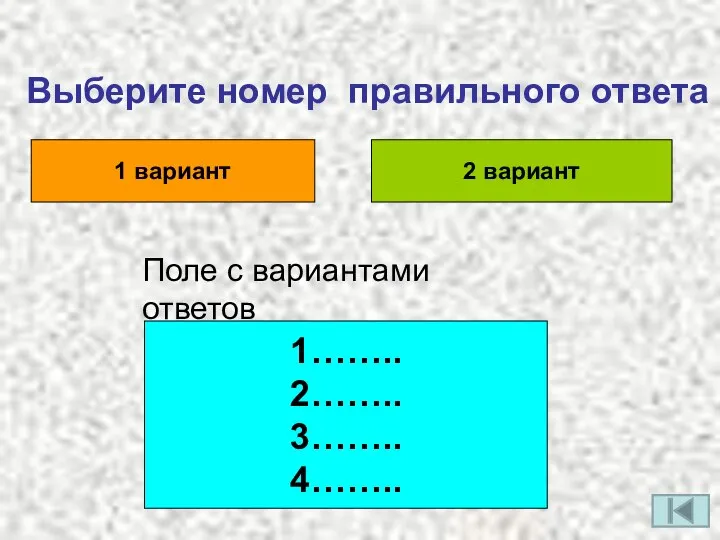
- 2. Выберите номер правильного ответа 1 вариант 2 вариант Поле с вариантами ответов 1…….. 2…….. 3…….. 4……..
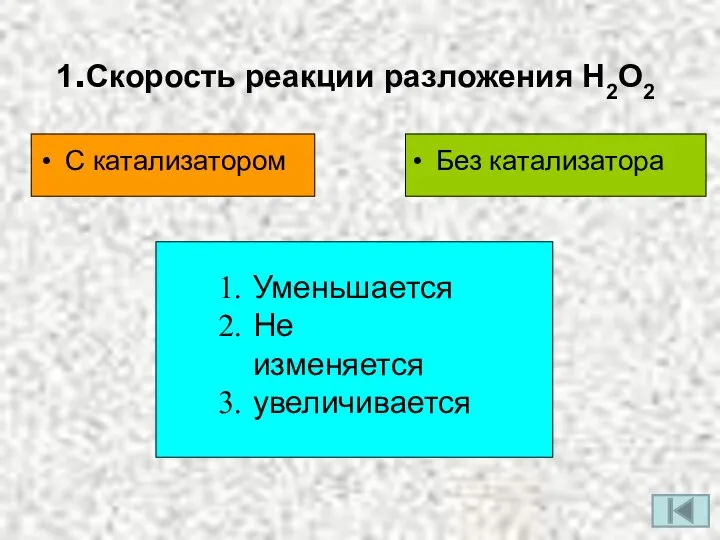
- 3. 1.Скорость реакции разложения Н2О2 С катализатором Без катализатора Уменьшается Не изменяется увеличивается
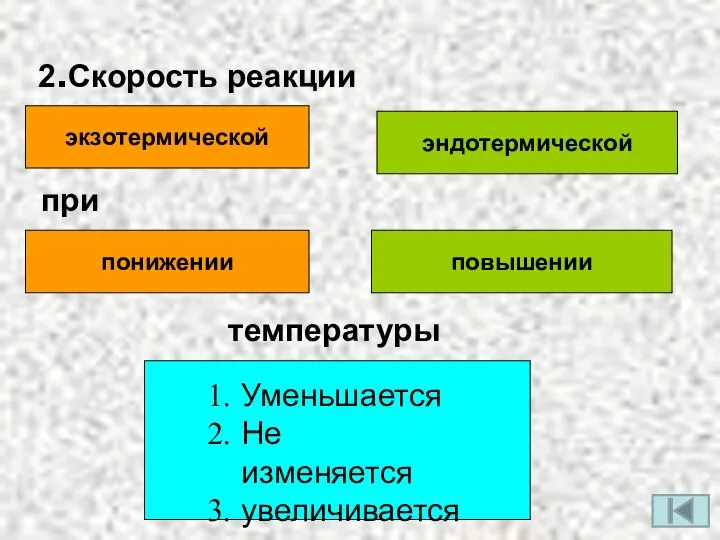
- 4. 2.Скорость реакции экзотермической эндотермической при понижении повышении температуры Уменьшается Не изменяется увеличивается
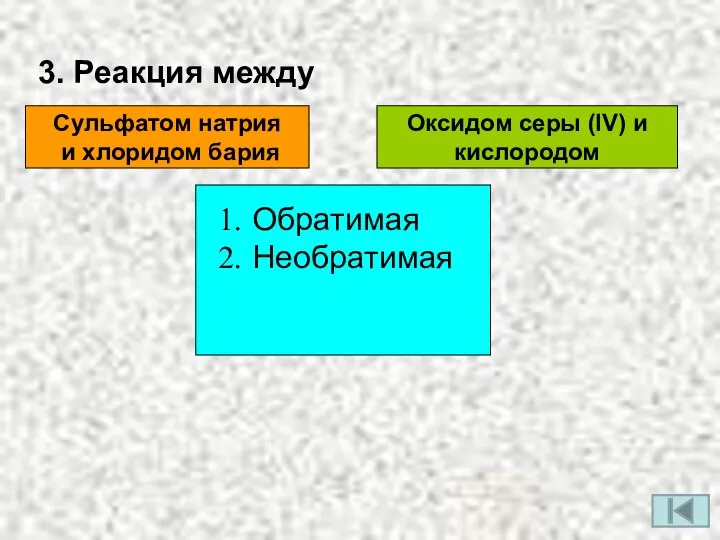
- 5. 3. Реакция между Сульфатом натрия и хлоридом бария Оксидом серы (IV) и кислородом Обратимая Необратимая
- 6. Установите соответствие 1…….А. 2…….В. 3…….Б. Варианты ответов:
- 7. 4. обозначения название величины 1. 2. С 1. 2. t А.концентрация вещества Б.время В.температурный коэффициент Г.скорость
- 8. 5. Физическая величина единица измерения 1. ɫ тау 2. t 1.v 2. С А.моль/л Б.секунда В.безразмерная
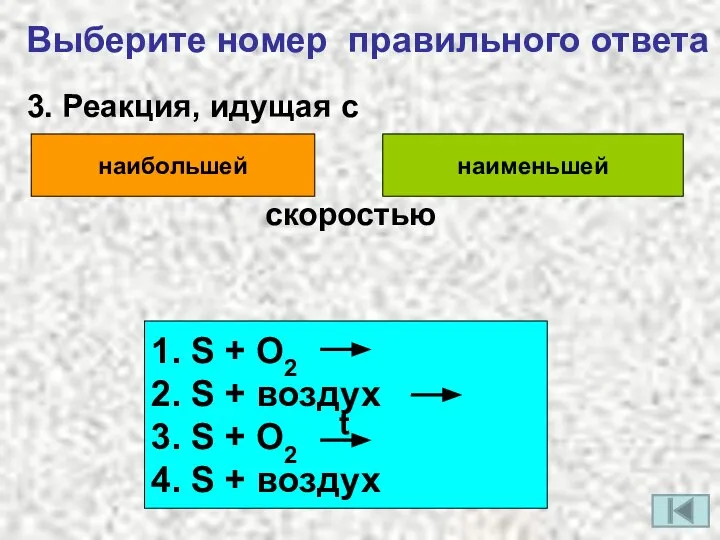
- 9. Выберите номер правильного ответа 3. Реакция, идущая с наибольшей наименьшей скоростью 1. S + O2 2.
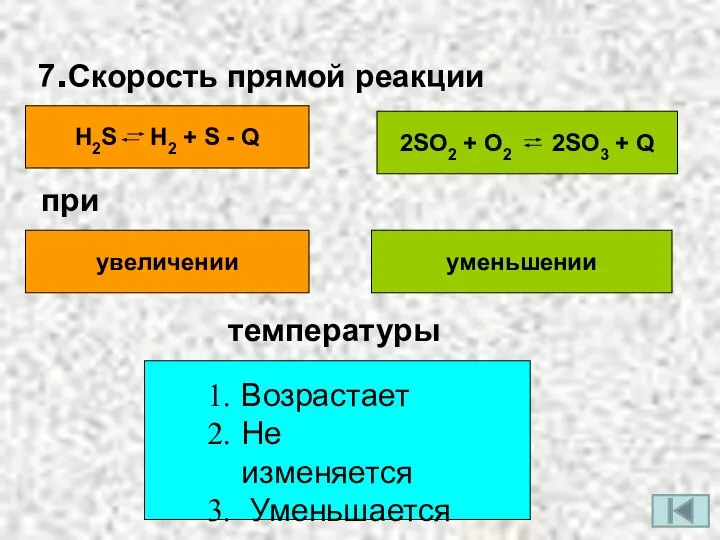
- 10. 7.Скорость прямой реакции H2S H2 + S - Q 2SO2 + O2 2SO3 + Q при
- 11. 8. Условия, способствующие образова- нию оксида углерода (II) (IV) Повышение температуры и повышение давления Повышение температуры
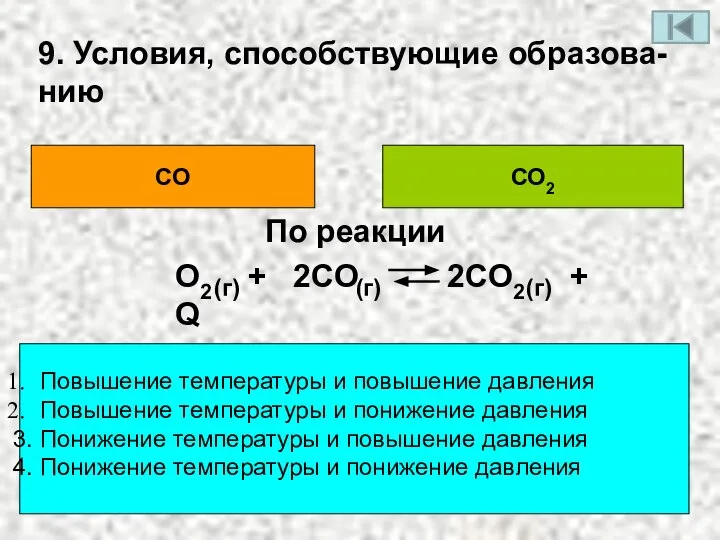
- 12. 9. Условия, способствующие образова- нию СО СО2 Повышение температуры и повышение давления Повышение температуры и понижение
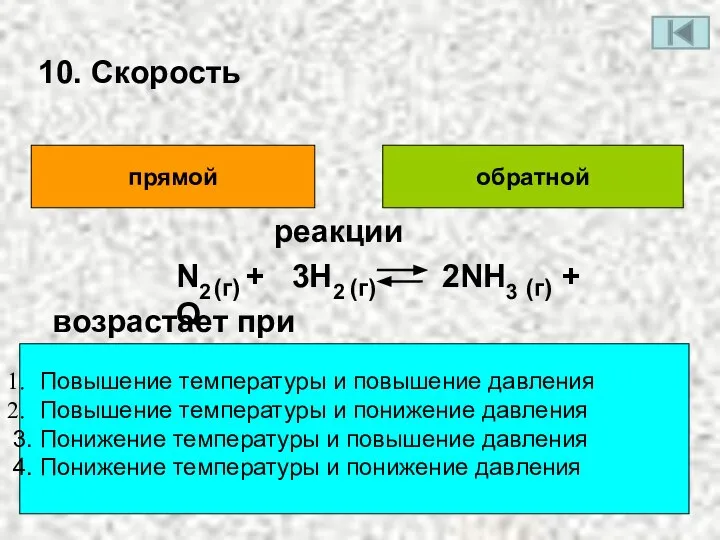
- 13. 10. Скорость прямой обратной Повышение температуры и повышение давления Повышение температуры и понижение давления 3. Понижение
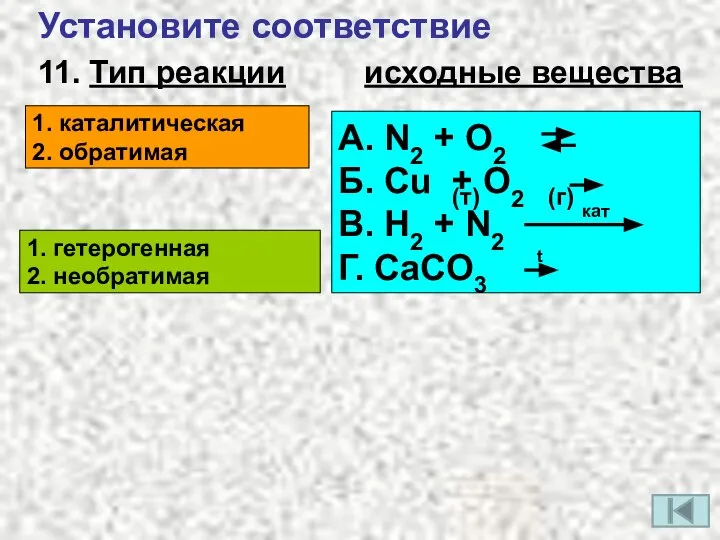
- 14. 11. Тип реакции исходные вещества 1. каталитическая 2. обратимая 1. гетерогенная 2. необратимая А. N2 +
- 15. 12. Формула вещества _____________, образующегося при Дополните: уменьшении увеличении концентрации водорода в реакции С4Н10 С4Н6 +
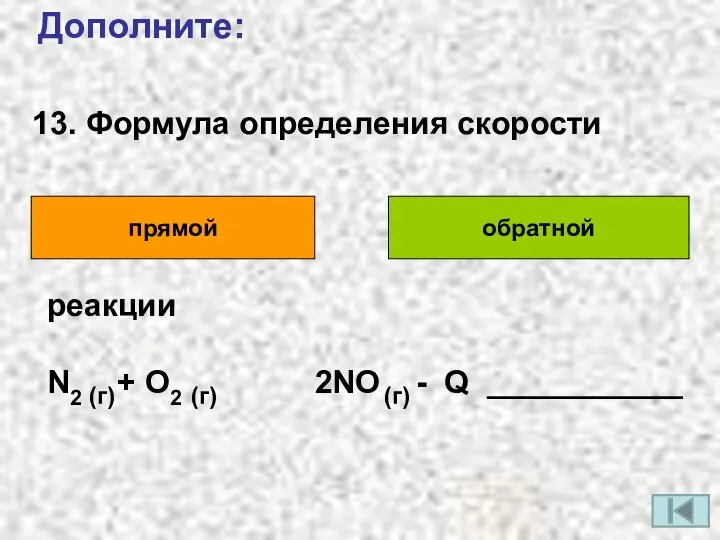
- 16. 13. Формула определения скорости Дополните: прямой обратной реакции N2 + O2 2NO - Q ___________ (г)
- 17. 14. Формула определения скорости обратной реакции Дополните: 2HBr H2 + Br2 2H2O 2H2 + O2 ___________
- 18. 15. Формула определения скорости Дополните: прямой обратной реакции 2SO2 + O2 2SO3 ___________ (г) (г) (г)
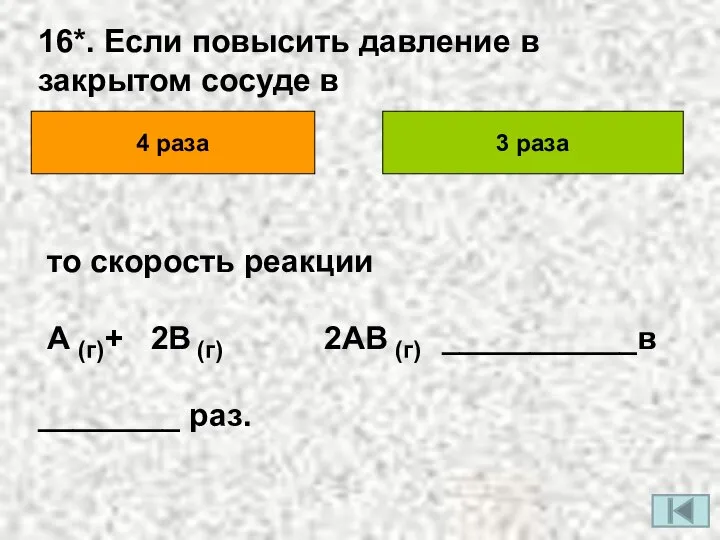
- 19. 16*. Если повысить давление в закрытом сосуде в 4 раза 3 раза то скорость реакции А
- 20. 17*. Скорость реакции возрастает при повышении температуры на 300 С 500 С в ________ раз, если
- 21. 18*. Если объем смеси в сосуде уменьшить в 3 раза, то скорость прямой обратной реакции 2SO2
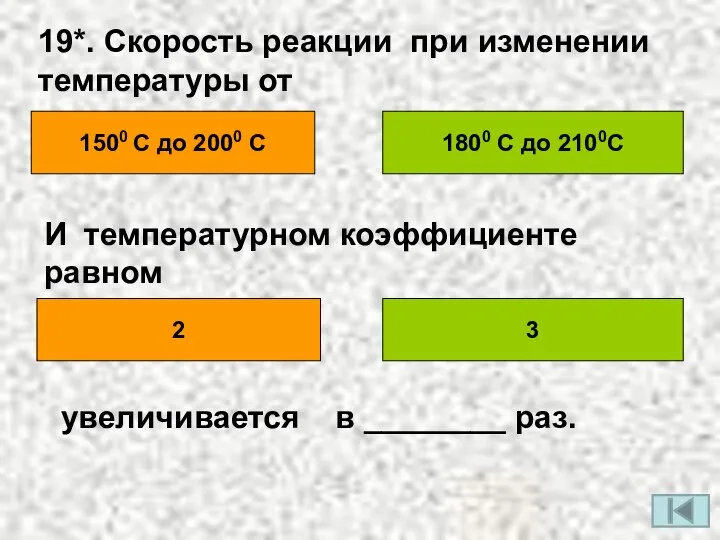
- 22. 19*. Скорость реакции при изменении температуры от 1500 С до 2000 С 1800 С до 2100С
- 24. Скачать презентацию









 Изомерия органических соединений. Лекция 2
Изомерия органических соединений. Лекция 2 Презентация на тему Серная кислота
Презентация на тему Серная кислота  Fosforan V wapnia Ca3(PO4)2
Fosforan V wapnia Ca3(PO4)2 Твердые электролиты
Твердые электролиты Обратимость химических реакций. Химическое равновесие
Обратимость химических реакций. Химическое равновесие Алкены
Алкены Жиры – биологически важные органические соединения
Жиры – биологически важные органические соединения Осаждение нитрида кремния
Осаждение нитрида кремния Составление ионных уравнений
Составление ионных уравнений Свойства кремниевой кислоты и области применения силикатов
Свойства кремниевой кислоты и области применения силикатов Алкины
Алкины Валентность. Валентные возможности атомов
Валентность. Валентные возможности атомов Теория электролитической диссоциации. Ионные уравнения. Задания
Теория электролитической диссоциации. Ионные уравнения. Задания Получение бутандиола, как способ переработки природного газа
Получение бутандиола, как способ переработки природного газа Химические вещества парабены
Химические вещества парабены Сложные эфиры и жиры
Сложные эфиры и жиры Презентация на тему Фенол и его свойства
Презентация на тему Фенол и его свойства  Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Презентация на тему Все о спиртах
Презентация на тему Все о спиртах  Структура периодической таблицы
Структура периодической таблицы Презентация на тему Химические средства гигиены и косметика
Презентация на тему Химические средства гигиены и косметика  Ключевые реакции и регуляторные ферменты начальных этапов углеводного обмена
Ключевые реакции и регуляторные ферменты начальных этапов углеводного обмена Дисперсные системы. Лекция №7
Дисперсные системы. Лекция №7 Реакции обмена. Типы химических реакций
Реакции обмена. Типы химических реакций Атомы химических элементов
Атомы химических элементов Вероятность протекания химических реакций
Вероятность протекания химических реакций Полезные ископаемые
Полезные ископаемые _Периодический закон. Распределение электронов по энергетическим уровням и подуровням (1)
_Периодический закон. Распределение электронов по энергетическим уровням и подуровням (1)