Содержание
- 2. При растворении органического вещества наблюдается три вида взаимоотношения между ним и молекулярными растворителями: Электростатическая (общая) сольватация.
- 3. Мерой способности растворителя вызывать диссоциацию молекул является диэлектрическая проницаемость (ε): чем она выше, тем выше диссоциирующая
- 4. Сольватация – энергетическое и пространственное взаимодействие между растворенными веществами и растворителем, приводящее к тому, что каждая
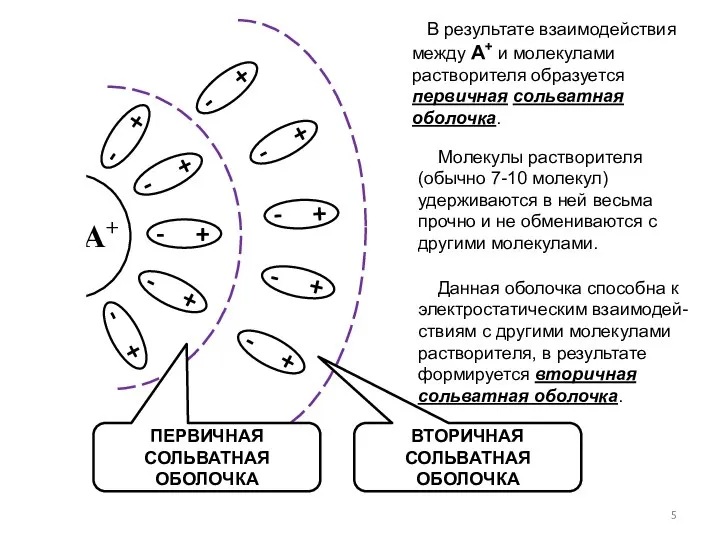
- 5. В результате взаимодействия между А+ и молекулами растворителя образуется первичная сольватная оболочка. А+ ПЕРВИЧНАЯ СОЛЬВАТНАЯ ОБОЛОЧКА
- 6. Во вторичной сольватной оболочке молекулы растворителя являются подвижными и легко обмениваются. Число молекул растворителя, находящихся во
- 7. ИОН – ИОННОЕ ВЗАИМОДЕЙСТВИЕ Изменение константы скорости реакции в растворителе (k) по сравнению с константой (k0)
- 8. Рассмотрим 2 случая. 1) Za и Zb – одноименно-заряжены. Выражение в скобках имеет положительное значение и
- 9. ИОН – ДИПОЛЬНОЕ ВЗАИМОДЕЙСТВИЕ Характеризуется уравнением: Z – заряд иона; r– радиус иона; r≠–радиус переходного состояния.
- 10. описывается уравнением: ДИПОЛЬ – ДИПОЛЬНОЕ ВЗАИМОДЕЙСТВИЕ μA, μB, μ≠ - дипольные моменты реагентов А, В и
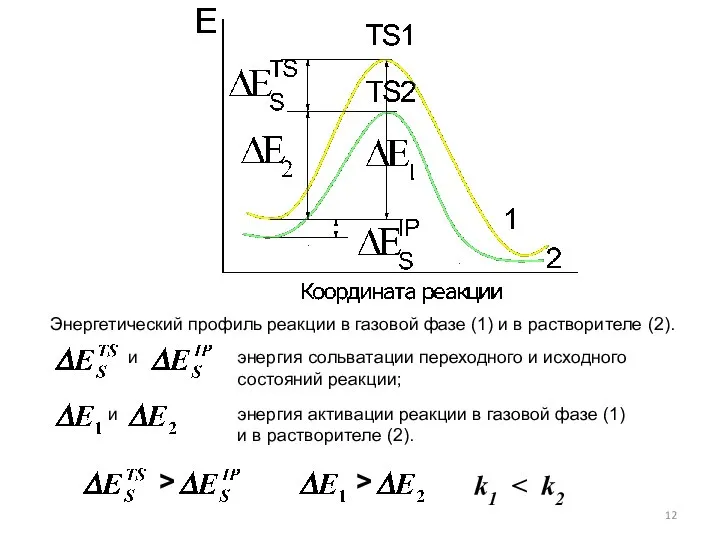
- 11. Согласно этой теории растворитель за счет электростатической сольватации изменяет энергию исходного и переходного состояний реакции. При
- 12. Энергетический профиль реакции в газовой фазе (1) и в растворителе (2). энергия сольватации переходного и исходного
- 13. RE TS Влияние диэлектрической проницаемости растворителя на скорость реакций
- 14. Если в TS возникают ионные заряды или концентрируются уже имеющиеся, то с увеличением полярности растворителя скорость
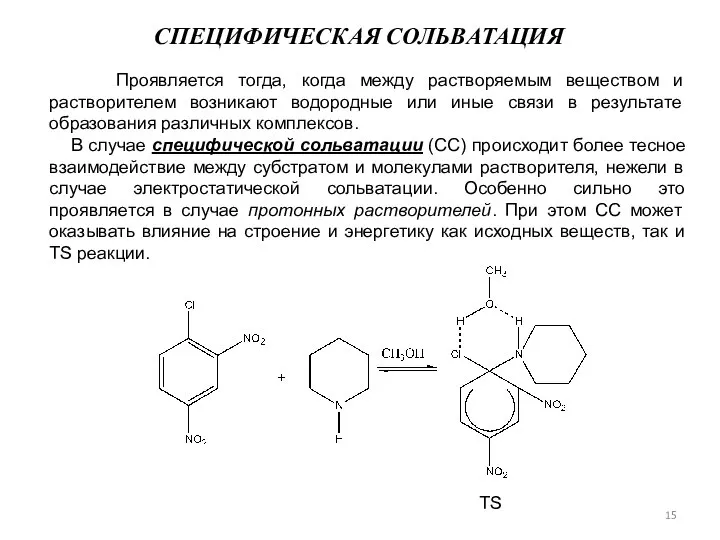
- 15. Проявляется тогда, когда между растворяемым веществом и растворителем возникают водородные или иные связи в результате образования
- 16. Дополнительная стабилизация TS достигается за счет образования водородных связей между атомом водорода пиперидина и атомом кислорода
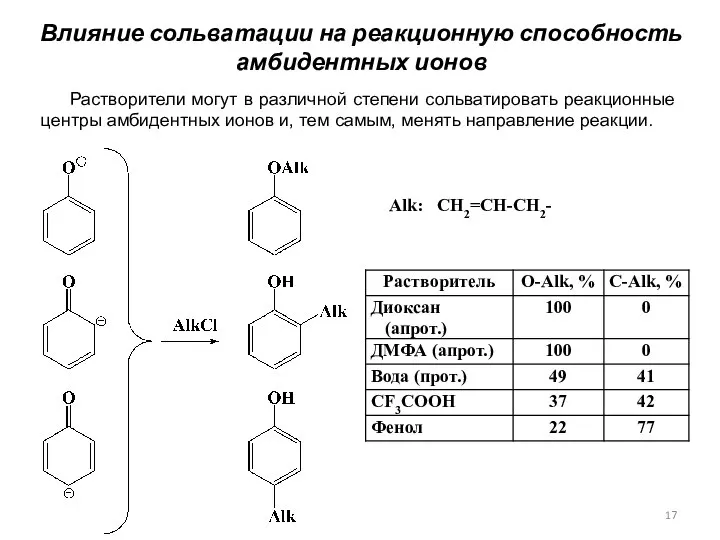
- 17. Растворители могут в различной степени сольватировать реакционные центры амбидентных ионов и, тем самым, менять направление реакции.
- 18. Растворители, содержащие активный атом водорода, образуют прочные сольваты с субстратом РhО–. В результате на нем уменьшается
- 19. Ионная сила раствора Установлено, что скорость ионной реакции зависит от ионной силы раствора. Так как ионную
- 20. Зависимость константы скорости реакции от ионной силы раствора определяется соотношением Бренстеда — Бьеррума: , где k
- 21. Зависимость lg(kr/k0) от I1/2 для ионных реакций: [Со(NH3)5Br]2+ + Hg2+; СН2ВгСОО- + S2032-; СН2СlСОО- + ОН-;
- 23. Скачать презентацию















![Зависимость lg(kr/k0) от I1/2 для ионных реакций: [Со(NH3)5Br]2+ + Hg2+; СН2ВгСОО- +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1109403/slide-20.jpg)
 Алканы
Алканы Гетероциклические соединения
Гетероциклические соединения Химические реакции. по фазовому составу
Химические реакции. по фазовому составу Уравнения химических реакций
Уравнения химических реакций Фосфорная кислота и ее свойства
Фосфорная кислота и ее свойства Селективное каталитическое восстановление оксидов азота
Селективное каталитическое восстановление оксидов азота Спирты
Спирты Альдегиды и кетоны
Альдегиды и кетоны Кислоты с металлами
Кислоты с металлами Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи
Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи Электрохимия. Экзаменационные вопросы
Электрохимия. Экзаменационные вопросы Соединения алифатического ряда
Соединения алифатического ряда Химическая связь
Химическая связь Презентация на тему Фенол и его свойства
Презентация на тему Фенол и его свойства  Взаимное притяжение и отталкивание молекул
Взаимное притяжение и отталкивание молекул Свойства растворов электролитов
Свойства растворов электролитов Сплавы металлов (познавательная презентация)
Сплавы металлов (познавательная презентация) Природа и классификация химических связей
Природа и классификация химических связей Синтез и свойства кукурбитурилов
Синтез и свойства кукурбитурилов Непредельные углеводороды: алкены и алкины
Непредельные углеводороды: алкены и алкины Лекция 3. Строение электронной оболочки атома (1)
Лекция 3. Строение электронной оболочки атома (1) Минералы
Минералы Презентация по Химии "Химические задачи как средство гуманизации обучения учащихся на уроках химии"
Презентация по Химии "Химические задачи как средство гуманизации обучения учащихся на уроках химии"  Электролиз
Электролиз К 180-летию со дня рождения Д.И. Менделеева
К 180-летию со дня рождения Д.И. Менделеева MPKh_PREZENTATsIYa_2
MPKh_PREZENTATsIYa_2 Окислительно-восстановительные реакции. 8 класс
Окислительно-восстановительные реакции. 8 класс