Содержание
- 2. Основные вопросы лекции: 1. Предмет изучения биоорганической химии 2. Классификация органических реакций. 2. Реакции SR алканов,
- 3. Биоорганическая химия изучает строение и свойства веществ, участвующих в процессах жизнедеятельности, в непосредственной связи с познанием
- 4. Субстрат – вещество, в котором происходит разрыв старых и образование новых связей с участием атома углерода.
- 5. Классификация реакций По направлению и конечному результату: Реакции присоединения – А; Реакции замещения – S; Реакции
- 6. Классификация реакций По характеру изменения связей в субстратах и реагентах: реакции радикальные (гомолитический тип разрыва связей)
- 7. Ионные реакции в зависимости от природы реагента: электрофильные нуклеофильные Классификация реакций
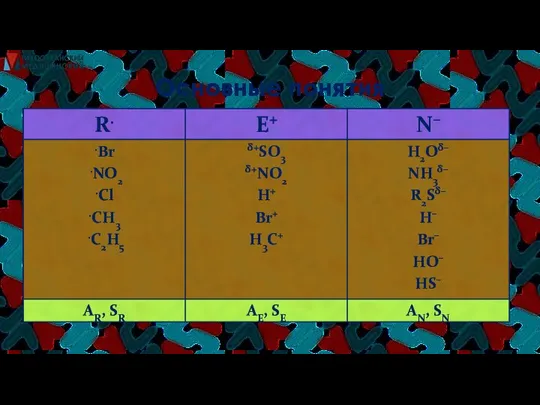
- 8. Основные понятия РАДИКАЛЫ(R.) – свободные атомы или частицы с неспаренным электроном (.CH3, Cl., Br .). ЭЛЕКТРОФИЛЫ
- 9. Основные понятия
- 10. Алканы CnH2n+2
- 11. Реакции радикального замещения (SR) – … … реакции замещения, в которых атаку осуществляют свободные радикалы —
- 12. Пример SR реакции 1)Инициирование реакции 2) Развитие цепи
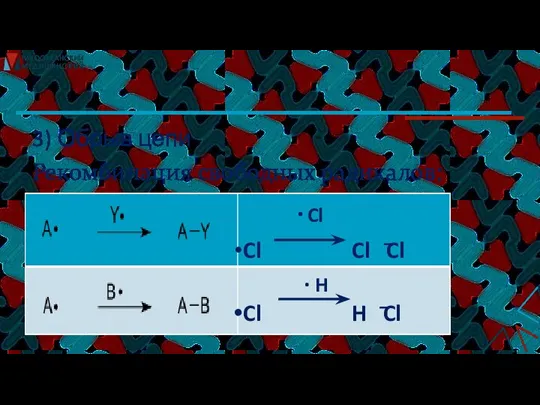
- 13. 3) Обрыв цепи Рекомбинация свободных радикалов:
- 14. Региоселективность реакций SR Реакция галогенирования (Br2, Cl2) протекающая по механизму радикального замещения (SR), характеризуется региоселективностью, т.е.
- 15. * Биологическая роль SR *Поражение кроветворных систем, кожных покровов, желез внутренней секреции, иммунной системы, мутации. *
- 16. Алкены CnH2n
- 17. Механизм реакций АE Реакция идет по механизму электрофильного присоединения (AE) Нижник Я.П. http://norgchem.professorjournal.ru
- 18. Реакции электрофильного присоединения (АЕ) — … … реакции, в которых атаку на начальной стадии осуществляет электрофил
- 19. М е х а н и з м р е а к ц и й АE
- 20. М е х а н и з м р е а к ц и й АE
- 21. Гидрогалогенирование (присоединение галогеноводородов) пропен 2-хлорпропан Реакции идут по механизму электрофильного присоединения (AE) CH2 = CH2 +
- 22. М е х а н и з м р е а к ц и й АE
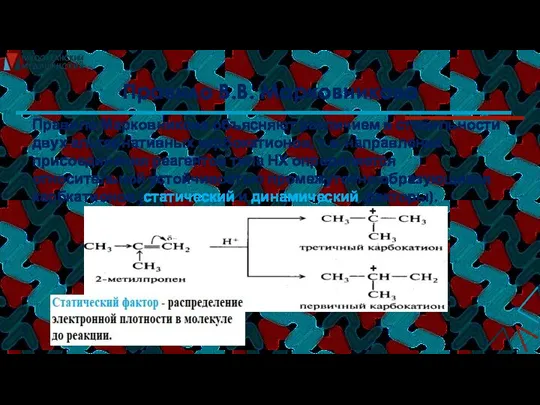
- 23. Правило В.В. Марковникова При присоединении веществ типа НХ (НCl, HBr, HOH) к нессиметричным алкенам, водород присоединяется
- 24. Правило Марковникова объясняют различием в стабильности двух альтернативных карбокатионов, т.е. направление присоединения реагентов типа НХ определяется
- 25. Относительная устойчивость карбкатионов определяется возможностью частичной делокализации положительного заряда в каждом из них (динамический фактор). Алкильные
- 26. Гидратация (присоединение воды) Реакция идет по механизму электрофильного присоединения (AE) в соответствии с правилом Марковникова. этилен
- 27. Механизм реакции гидратации алкенов (AE)
- 28. * Биороль реакций AE *Расщепление жиров в организме, ЖК, углеводов. *Процессы окисления в клетках ЖК липидов.
- 29. фумаровая кислота яблочная кислота Нижник Я.П. http://norgchem.professorjournal.ru Присоединение воды к двойной связи протекает в организме и
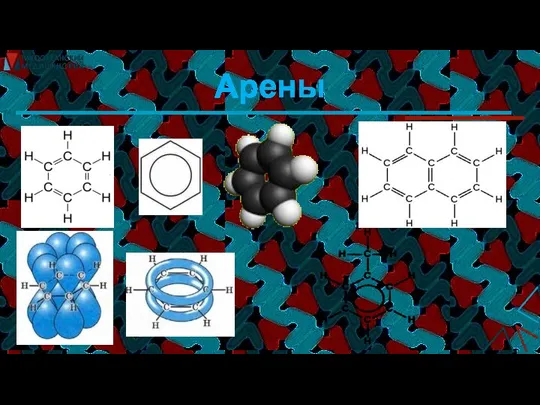
- 30. Арены
- 31. Основной тип реакции для аренов – SЕ (sp2 - гибридизованные атомы углерода), реагенты галогены Hal2 (Cl2
- 32. Реакции электрофильного замещения (SE) Атакующая частица — электрофил (положительно заряженная частица или частица с дефицитом ē).
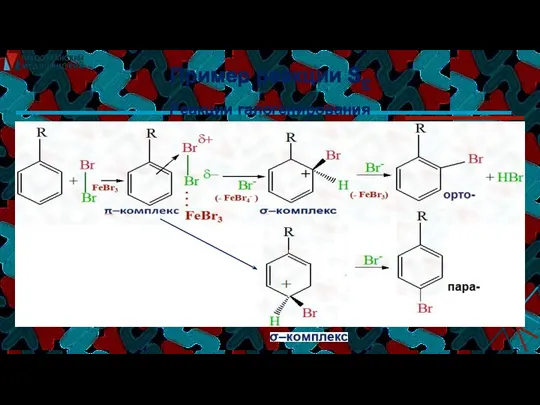
- 33. Пример реакции SE Реакции галогенирования
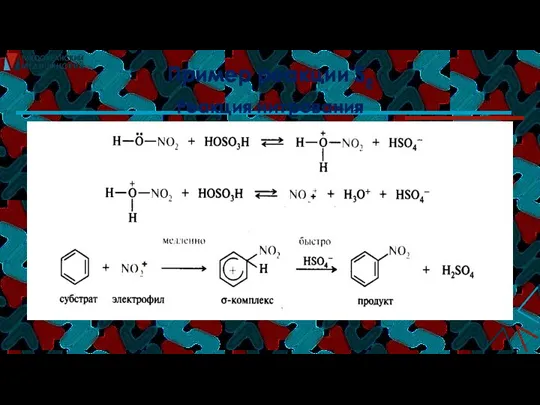
- 34. Пример реакции SE Реакция нитрования
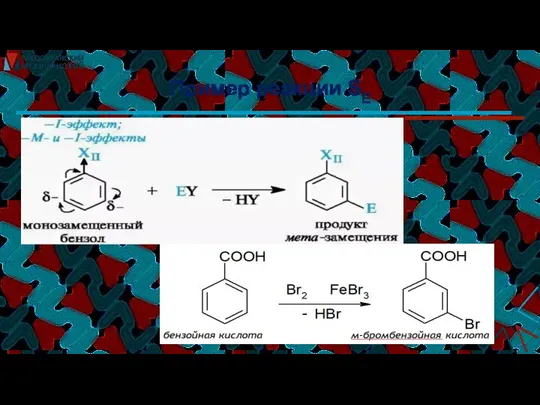
- 35. Ориентирующее действие заместителя По ориентирующему и активирующему/дезактивирующему действию заместители можно разделить на 3 группы: Ориентанты первого
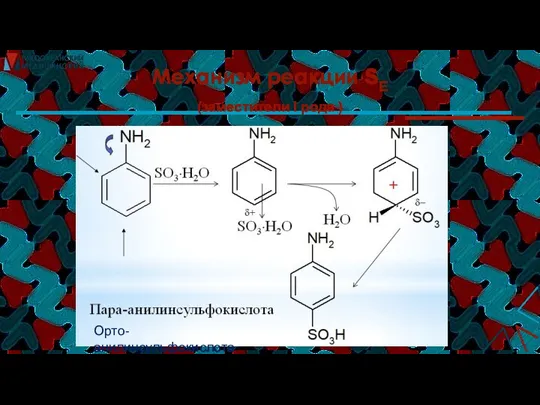
- 36. Механизм реакции SE (заместители I рода ) SE Орто-анилинсульфокислота
- 37. Пример реакции SE
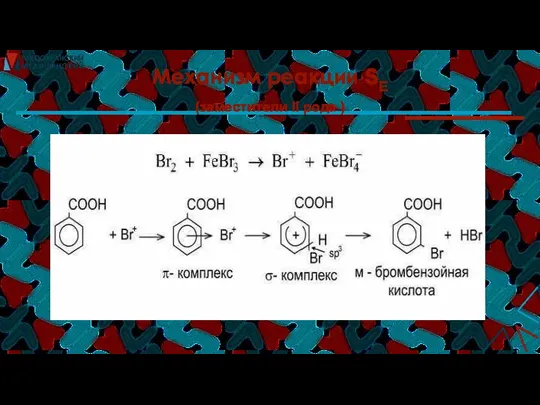
- 38. Механизм реакции SE (заместители II рода )
- 39. *Биологическая роль SE * Биосинтез ароматических гормонов и аминокислот. * Синтезы лекарственных препаратов: сульфаниламидов, салицилатов, антисептиков,
- 41. Скачать презентацию





























 Оксиды углерода
Оксиды углерода Кетоны
Кетоны Производство серной кислоты контактным способом
Производство серной кислоты контактным способом Окислительно-восстановительные реакции с электронной точки зрения
Окислительно-восстановительные реакции с электронной точки зрения Презентация на тему Жидкое состояние вещества
Презентация на тему Жидкое состояние вещества  Строение и функции нуклеиновых кислот. Лекция №3
Строение и функции нуклеиновых кислот. Лекция №3 Антидиабеттік қауынқұрттың реологиялық қасиетін анықтау
Антидиабеттік қауынқұрттың реологиялық қасиетін анықтау Рефолдинг миниантител
Рефолдинг миниантител Электролиз и его применение
Электролиз и его применение Современная аналитическая химия.Учебная литература
Современная аналитическая химия.Учебная литература Раздел 1
Раздел 1 Растворы. Процесс растворения (2)
Растворы. Процесс растворения (2) Азот
Азот Массовая доля элемента в веществе
Массовая доля элемента в веществе Соляная кислота и ее свойства
Соляная кислота и ее свойства Химические явления
Химические явления Углеводороды и их природные источники. Природный газ. Урок химии, 10 класс
Углеводороды и их природные источники. Природный газ. Урок химии, 10 класс Магний (Mg)
Магний (Mg) Воздействие нейропептидов семакс и PGP на содержание транскриптов гена в головном мозге крыс в условиях экспериментальной ишемии
Воздействие нейропептидов семакс и PGP на содержание транскриптов гена в головном мозге крыс в условиях экспериментальной ишемии Терпеноиды. Эфирные масла
Терпеноиды. Эфирные масла Наука Химия на Великой Отечественной войне
Наука Химия на Великой Отечественной войне Неорганические соединения фосфора
Неорганические соединения фосфора Фенолы: методы синтеза и химические свойства
Фенолы: методы синтеза и химические свойства Многоэлектронные атомы
Многоэлектронные атомы Теория электролитической диссоциации
Теория электролитической диссоциации Презентация на тему Химические вещества: строительные и поделочные материалы
Презентация на тему Химические вещества: строительные и поделочные материалы  Химическое равновесие в растворах электролитов
Химическое равновесие в растворах электролитов Презентация на тему Аллотропные видоизменения неметаллов
Презентация на тему Аллотропные видоизменения неметаллов