Содержание
- 3. Её величество Азотная кислота
- 4. Строение Степень окисления азота в азотной кислоте равна +5. Связь – ковалентная полярная. Кристаллическая решетка –
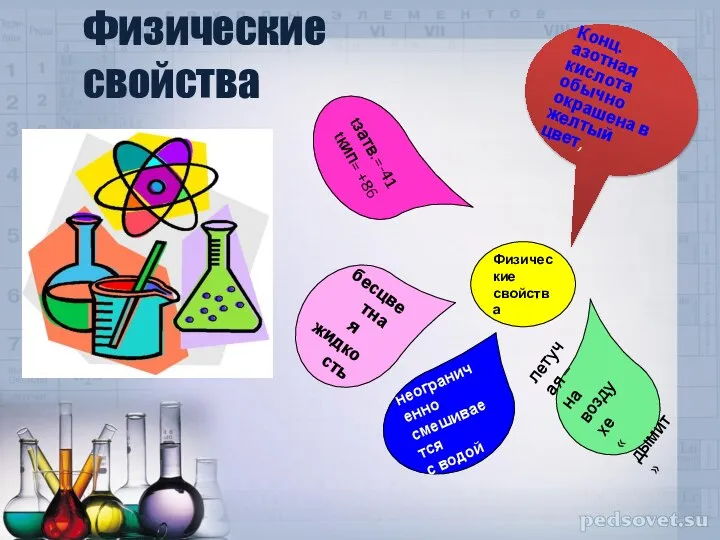
- 5. Физические свойства Физические свойства tзатв.=-41 tкип= +86 бесцветная жидкость неограниченно смешивается с водой летучая – на
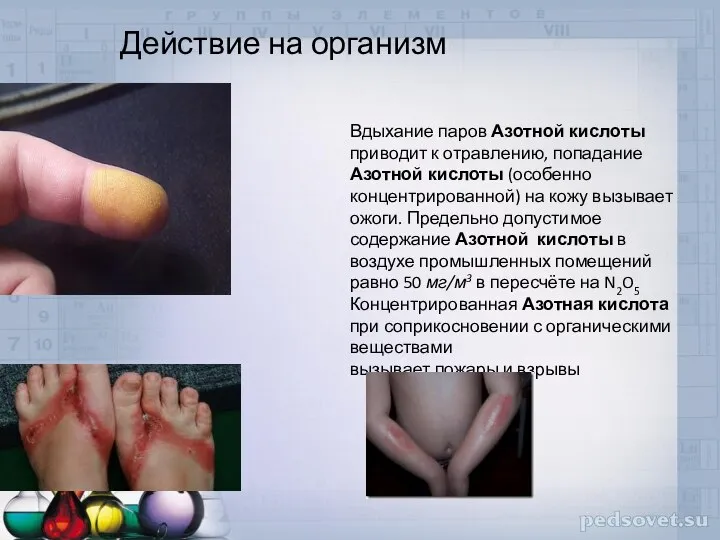
- 6. Действие на организм Вдыхание паров Азотной кислоты приводит к отравлению, попадание Азотной кислоты (особенно концентрированной) на
- 7. Исследования (задания по группам). 1 группа: провести реакцию раствора азотной кислоты и оксида меди (II), записать
- 8. Общие с другими кислотами: 1. Сильный электролит, хорошо диссоциируют на ионы HNO3 -> H+ +NO3- Изменяет
- 9. Взаимодействие с металлами: При взаимодействии с металлами образуются нитрат, вода и третий продукт по схеме: HNO3(р.)+Me(до
- 10. 4HN+5O3 + Hg0 = Hg+2(NO3)2 + 2N+4O2 + 2H2O N+5 + 1e → N+4 1 2
- 12. Проверь себя: Степень окисления азота в HNO3 а)-3 б)0 в)+5 г)+4 При хранении на свету HNO3
- 13. Ключ: 1 - в 2 - б 3 - а 4 - а 5 - б
- 14. Вывод: 1. Азотной кислоте характерны общие свойства кислот: реакция на индикатор, взаимодействие с оксидами металлов, гидроксидами,
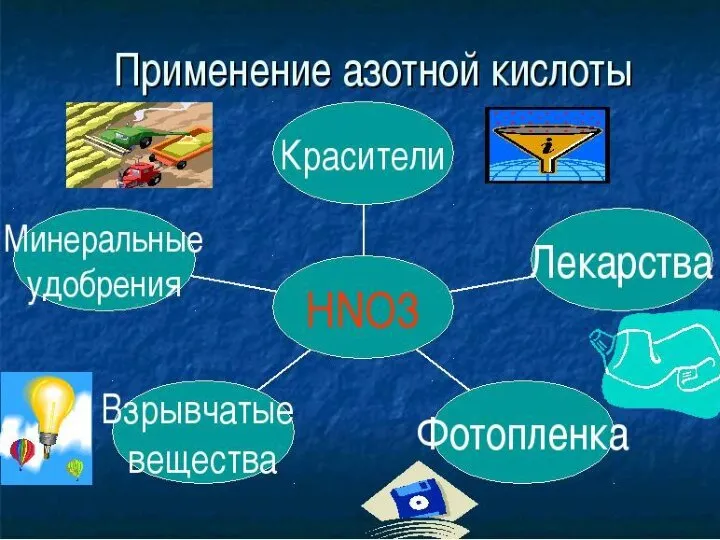
- 15. Домашнее задание: §26 упр. 2,7 Творческие задания: способы получения азотной кислоты. Почему « царская водка» растворяет
- 17. Скачать презентацию











 Валентность химических элементов
Валентность химических элементов Презентация на тему Задачи на смеси и сплавы (9 класс)
Презентация на тему Задачи на смеси и сплавы (9 класс)  Природный газ, состав применение в качестве топлива
Природный газ, состав применение в качестве топлива Презентация на тему Химия в промышленности
Презентация на тему Химия в промышленности  Валентность. Что же это такое?
Валентность. Что же это такое? Презентация на тему Знакомство с кислотами
Презентация на тему Знакомство с кислотами  Ароматические и гетероциклические соединения. Электронная спектроскопия
Ароматические и гетероциклические соединения. Электронная спектроскопия Спирты и фенолы. (Лекция 6.1)
Спирты и фенолы. (Лекция 6.1) Альдегиды. Строение молекул
Альдегиды. Строение молекул Моющие и чистящие средства
Моющие и чистящие средства Презентация тема 7.5. 7.6
Презентация тема 7.5. 7.6 Вывод формул химических веществ
Вывод формул химических веществ Презентация на тему Барометр анероид
Презентация на тему Барометр анероид  Соли. Состав и классификация
Соли. Состав и классификация Выращивание кристаллов соли и сахара в домашних условиях
Выращивание кристаллов соли и сахара в домашних условиях Свойства кремниевой кислоты и области применения силикатов
Свойства кремниевой кислоты и области применения силикатов Презентация на тему Амины
Презентация на тему Амины  Фундаментальные механизмы биохимической адаптации
Фундаментальные механизмы биохимической адаптации Обобщить и систематизировать знания учащихся о кислотах неорганических и органических, о их составе и свойствах
Обобщить и систематизировать знания учащихся о кислотах неорганических и органических, о их составе и свойствах Альдегиды
Альдегиды Средства для мытья окон
Средства для мытья окон Ртуть
Ртуть Алканы
Алканы электролитическая диссоциация
электролитическая диссоциация Классификация оксидов по химическим свойствам
Классификация оксидов по химическим свойствам Свойства солёной воды. Море у меня в стакане
Свойства солёной воды. Море у меня в стакане Окислительно-восстановительные реакции (ОВР). Лекция 1
Окислительно-восстановительные реакции (ОВР). Лекция 1 Вариативные задачи по химии различных типов в тестовой форме
Вариативные задачи по химии различных типов в тестовой форме