Слайд 2 Сероводород H2S - бесцветный газ с резким неприятным запахом (запахом тухлых яиц), растворяется в

воде с образованием слабой сероводородной кислоты, соли которой называются сульфидами.
Очень ядовит, вызывает отравление даже при незначительном содержании в воздухе (около 0,01%), может накапливаться в организме. Он разрушает гемоглобин, превращая содержащееся в нем железо в сульфид. Цвет крови изменяется: из красной она становится черно-зеленой. Отравление сероводородом может привести к обморочному состоянию и смерти от кислородного голодания.
Слайд 3 Однако, несмотря на свое пагубное действие на человека, сероводород используют и

в медицинских целях: для лечения кожных заболеваний, нервной системы. Купание в сероводородных ваннах вызывает легкое раздражение кожи, расширение кровеносных сосудов и тем самым оказывает целительное действие при ревматизме и других болезнях.
Слайд 4Получение:
1. Синтез из простых веществ:
2. Действие неокисляющих кислот на сульфиды:
3. Действие конц. серной кислоты

на высокоактивные металлы:
4. Необратимый гидролиз:
Слайд 5 Раствор H2S в воде - бескислородная, двухосновная, слабая кислота. Диссоциация протекает по двум

ступеням, преимущественно по первой:
Слайд 6 Сероводородная кислота проявляет типичные свойства кислоты и взаимодействует с:
металлами, стоящими в

ряду напряжения до водорода:
с основными оксидами:
с щелочами. В избытке щелочей образуются средние соли:
при недостатке щелочей образуются кислые соли:
Слайд 7с солями. Реакция протекает в тех случаях, если образуется сульфид, который нерастворим

не только в воде, но и в сильных кислотах:
При долгом стоянии на воздухе сероводородная кислота мутнеет:
Сероводород горит на воздухе голубым пламенем:
Слайд 8выпадает осадок сульфида свинца черного цвета, который при окислении перекисью водорода превращается

в осадок сульфата свинца белого цвета:
Слайд 9 Газообразный сероводород обнаруживается с помощью влажной бумаги, смоченной раствором нитрата свинца:

бумага — чернеет:
Слайд 10 Сероводород проявляет ряд специфических свойств и вступает в окислительно-восстановительные реакции со сложными веществами:

Слайд 11 Сульфиды металлов имеют многообразие цветов осадков.
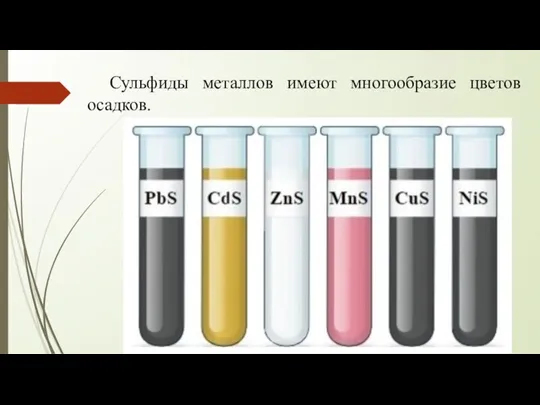
Слайд 12 Сульфиды щелочных и щелочно-земельных металлов (Ca,Sr,Ba) и аммония растворимыв воде.
Такие

как ZnS, MnS, FeS, CdS не растворимы в воде, но растворимы в минеральных кислотах (соляной, ортофосфорной, разбавленной серной):
Сульфиды Ag, Cu, Pb, Hg не растворимы в воде и не реагируют с минеральными кислотами, только с кислотами - окислителями:
Слайд 13Сера образует два оксида:
сернистый газ SO2
серный ангидрид SO3
SO2 - это

бесцветный тяжелый газ с резким удушливым запахом (горелой серы), хорошо растворимый в воде, глицерине, спирте.
Сернистый газ убивает бактерии, поэтому раньше им окуривали овощехранилища, использовали при консервировании. Он находит применение в производстве бумаги. Однако наибольшее количество оксида серы(IV) идет на производство серной кислоты.
Слайд 14Получение:
В промышленности
сжигание серы:
обжигом сульфидных руд, например, свинцового блеска или пирита:

Слайд 15В лабораторных условиях:
действием серной кислоты на сульфиты – соли сернистой соли:
Na2SO3 +

H2SO4 = Na2SO4 + SO2 + H2O
при окислении металлов концентрированной серной кислотой:
Слайд 16 SO2 - кислотныq оксид, но кислоту не образует, хотя отлично растворяется

в воде - 40л оксида серы в 1 л воды (для удобства составления химических уравнений такой раствор называют сернистой кислотой). Сернистая кислота H2SO3 неустойчива и существует лишь в растворах:
H2O + SO2 = H2SO3
Образует два ряда солей – сульфиты (Na2SO3) и гидросульфиты (NaHSO3).
В присутствии катализатора -оксида ванадия (V2O5) оксид серы присоединяет кислород и превращается в триоксид серы:
Слайд 17 При пропускании SO2 через раствор щелочи его характерный резкий запах исчезает – газ

полностью поглощается раствором:
Подобно другим кислотным оксидам, сернистый газ вступает во взаимодействие не только с щелочами, но и с основными оксидами, например, с негашеной известью:
Слайд 18 Атом серы в степени окисления +4 (S+4) в ОВР, в зависимости

от условий, может проявлять и окислительные, и восстановительные свойства:
Слайд 19Качественная реакция на SO2:
обесцвечивание растворов KMnO4 и Br2(aq)

Слайд 20 SO3 - кислотный оксид, маслянистая жидкость, со временем превращающася в игольчатые

кристаллы. Раствор в воде - серная кислота.
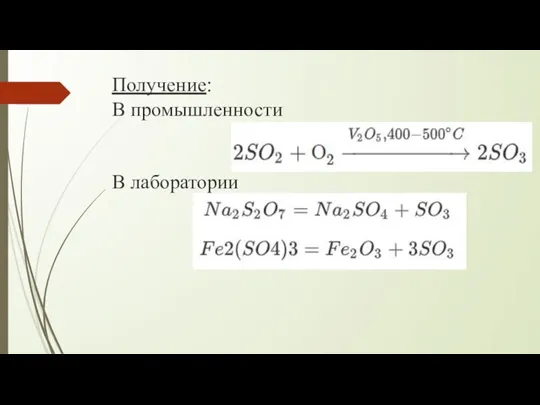
Слайд 21Получение:
В промышленности
В лаборатории




















 Периодическая система Д.И. Менделеева
Периодическая система Д.И. Менделеева Презентация на тему ОВР в органической химии
Презентация на тему ОВР в органической химии  Презентация на тему Золото
Презентация на тему Золото  Презентация на тему Неметаллы, особенности строения
Презентация на тему Неметаллы, особенности строения  Алгоритм решения задач по химии.
Алгоритм решения задач по химии. Физика полимеров Ч1
Физика полимеров Ч1 Наука химия. Интеллектуальная игра. 5-8 класс
Наука химия. Интеллектуальная игра. 5-8 класс Алмаз. Свойства алмазов
Алмаз. Свойства алмазов Процесс образования неметаллических включений в стали
Процесс образования неметаллических включений в стали Строение электронных оболочек атомов
Строение электронных оболочек атомов Круговорот серы в природе
Круговорот серы в природе Оценка возможности повышения эффективности процесса гидрирования бутилен- бутадиеновой фракции
Оценка возможности повышения эффективности процесса гидрирования бутилен- бутадиеновой фракции Французский физик, химик, металловед 1850 - 1936
Французский физик, химик, металловед 1850 - 1936 Что такое электрон?
Что такое электрон? Бериллий, магний и щелечноземельные металлы
Бериллий, магний и щелечноземельные металлы Строение материалов. Дефекты кристаллической структуры
Строение материалов. Дефекты кристаллической структуры Алкены
Алкены Ионные равновесия в растворах
Ионные равновесия в растворах Химическая идентификация основных классов биомолекул
Химическая идентификация основных классов биомолекул Презентация на тему Ковалентная химическая связь
Презентация на тему Ковалентная химическая связь  Природные источники углеводородов
Природные источники углеводородов Металлы
Металлы Презентация на тему Йод
Презентация на тему Йод  Электролитическая диссоциация. Электролиты и неэлектролиты
Электролитическая диссоциация. Электролиты и неэлектролиты Тепловой эффект
Тепловой эффект Презентация на тему Углерод
Презентация на тему Углерод  Аммиак NH3
Аммиак NH3 Презентация на тему Щавелевая кислота
Презентация на тему Щавелевая кислота