Содержание
- 2. Алмаз Алмазы образовывались из этой жидкости либо путем восстановления окисленного углерода (например, CO2 или CO3), либо
- 3. Изумруд Изумруд– Be3Al2Si6O18
- 4. Сапфир Сапфир– Al2O3
- 5. Рубин
- 6. Аквамарин
- 7. Апатит Апатит– Ca5(PO4)3(F,Cl,OH)
- 8. Аметист Аметист– SiO2
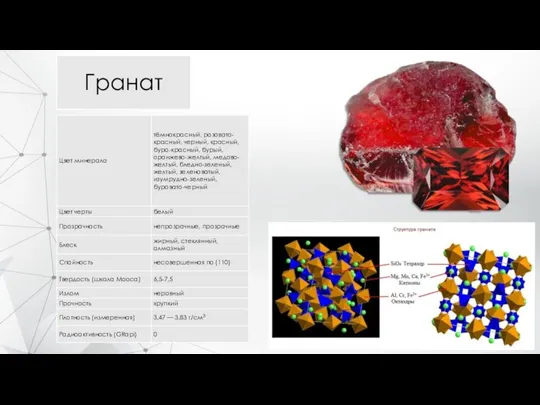
- 9. Гранат
- 10. Лунный камень Лунный камень– КАlSi3О8
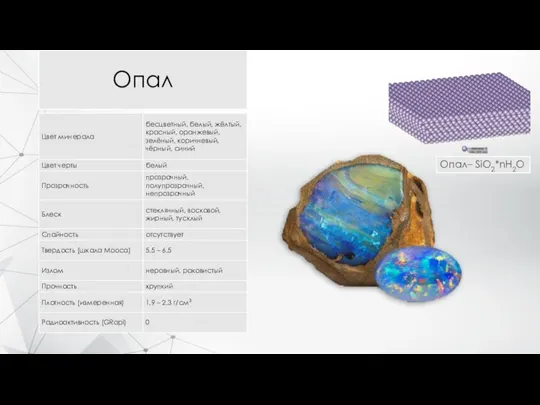
- 11. Опал Опал– SiO2*nH2O
- 14. Скачать презентацию









 Предмет химии, простые и сложные вещества
Предмет химии, простые и сложные вещества Без золота прожить можно, без соли нельзя
Без золота прожить можно, без соли нельзя Теория электролитической диссоциации
Теория электролитической диссоциации Тестирование по химии
Тестирование по химии Понятие о сплавах и методах их получения
Понятие о сплавах и методах их получения lektsia_7
lektsia_7 Основы химии буровых растворов
Основы химии буровых растворов Трансляция. Активирование аминокислоты
Трансляция. Активирование аминокислоты Решение экспериментальных задач по теме Подгруппы азота и углерода
Решение экспериментальных задач по теме Подгруппы азота и углерода Скорость химических реакций
Скорость химических реакций Презентация на тему Зеленая химия и проблемы устойчивого развития
Презентация на тему Зеленая химия и проблемы устойчивого развития  Строение бензола
Строение бензола Расчетная работа. Тепловой эффект клинкерообразования
Расчетная работа. Тепловой эффект клинкерообразования Электрохимия. Решение задач. ИДЗ 4
Электрохимия. Решение задач. ИДЗ 4 Электролиз. Правила электролиза
Электролиз. Правила электролиза Презентация по Химии "Законы газового состояния вещества"
Презентация по Химии "Законы газового состояния вещества"  Предельные углеводороды. Урок №4
Предельные углеводороды. Урок №4 Посвящение в химики
Посвящение в химики Кроссворд Интересные факты в химии
Кроссворд Интересные факты в химии Количество вещества. Молярная масса. Молярный объем
Количество вещества. Молярная масса. Молярный объем Химическая связь. 11 класс
Химическая связь. 11 класс НХ 6 Растворы Коллигативные свойства
НХ 6 Растворы Коллигативные свойства Особенности растворов высокомолекулярных соединений (ВМС). Вязкость растворов ВМС. Набухание. Рубежный контроль №1
Особенности растворов высокомолекулярных соединений (ВМС). Вязкость растворов ВМС. Набухание. Рубежный контроль №1 Полимеры
Полимеры Төртінші негізгі топша элементтері
Төртінші негізгі топша элементтері Температурная зависимость времени спин-решеточной релаксации протонов в H2La2Ti3O10
Температурная зависимость времени спин-решеточной релаксации протонов в H2La2Ti3O10 Взаимодействие кислот с металлами
Взаимодействие кислот с металлами Ковалентная связь. Радикалы
Ковалентная связь. Радикалы