Содержание
- 2. Почему окружающие нас вещества обладают столь разными свойствами? Каким образом структура объекта влияет на его свойства?
- 3. От структуры к свойствам
- 4. Свойства веществ определяется их качественным и количественным составом
- 5. I. Состав и свойства молекул
- 7. Качественный состав Н2О Н2S
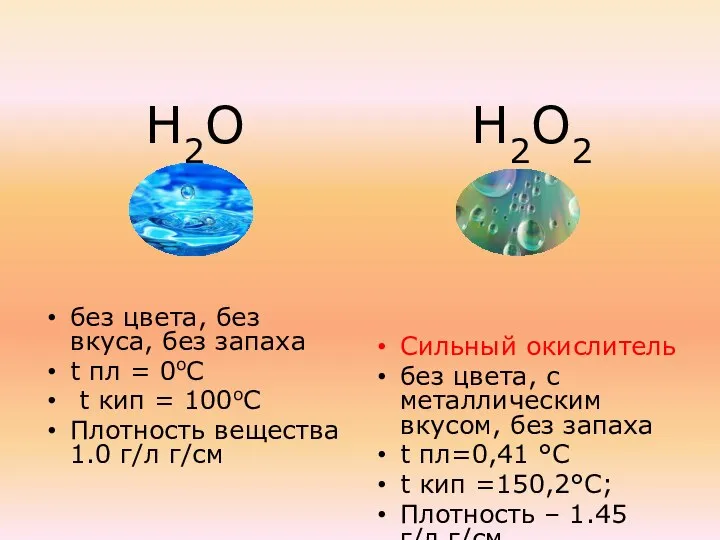
- 8. Физические свойства Н2О без цвета, без вкуса, без запаха, прозрачная t пл = 0оС t кип
- 9. Количественный состав Н2О Н2О2
- 10. Н2О без цвета, без вкуса, без запаха t пл = 0оС t кип = 100оС Плотность
- 11. II. Порядок связи атомов в молекулах
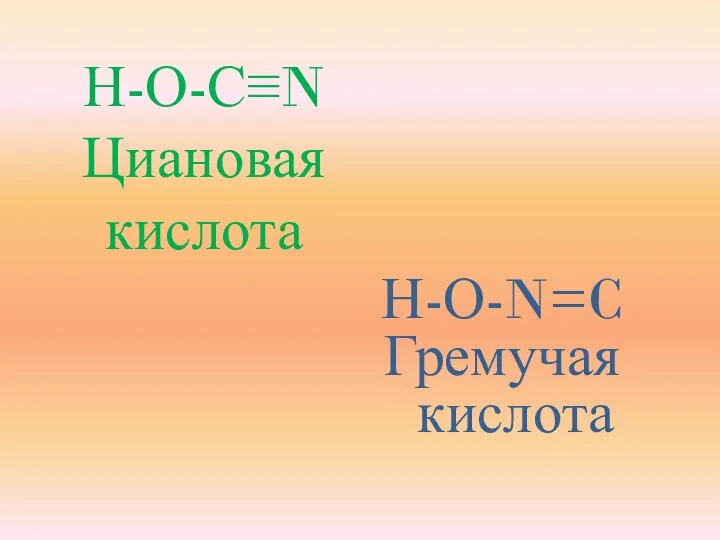
- 12. В 1822 году немецкий учёный Ф. Вёлер показал, что серебряные соли гремучей кислоты AgONC и изоциановой
- 13. Н-О-С≡N Циановая кислота Н-О-N=C Гремучая кислота
- 14. Впоследствии Берцелиус предложил называть такие вещества - изомерами
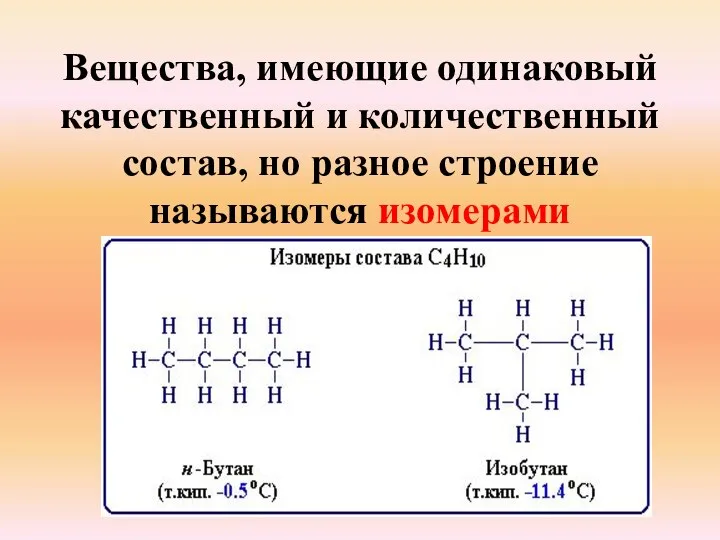
- 15. Вещества, имеющие одинаковый качественный и количественный состав, но разное строение называются изомерами
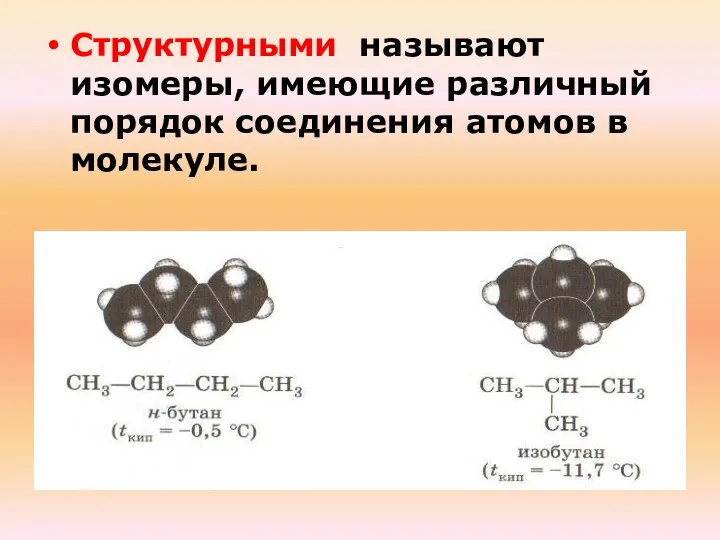
- 17. Структурными называют изомеры, имеющие различный порядок соединения атомов в молекуле.
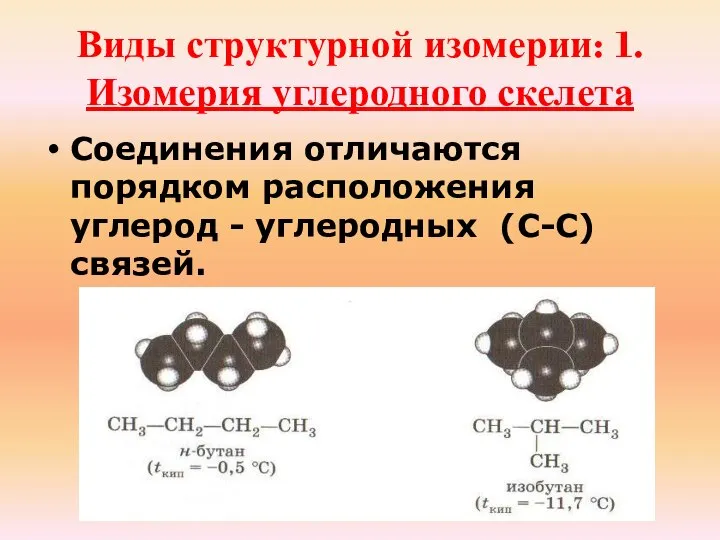
- 18. Виды структурной изомерии: 1.Изомерия углеродного скелета Соединения отличаются порядком расположения углерод - углеродных (С-С) связей.
- 19. Виды структурной изомерии: 2. Изомерия положения кратной связи или функциональной группы Определяет принадлежность соединения к тому
- 20. Виды структурной изомерии: 3. Межклассовая изомерия Изомеры относятся к разным классам органических соединений. СН3 СН2 ОН
- 21. Типы изомерии Структурная Структурными называют изомеры, имеющие различный порядок соединения атомов в молекуле. Пространственная Пространственные изомеры
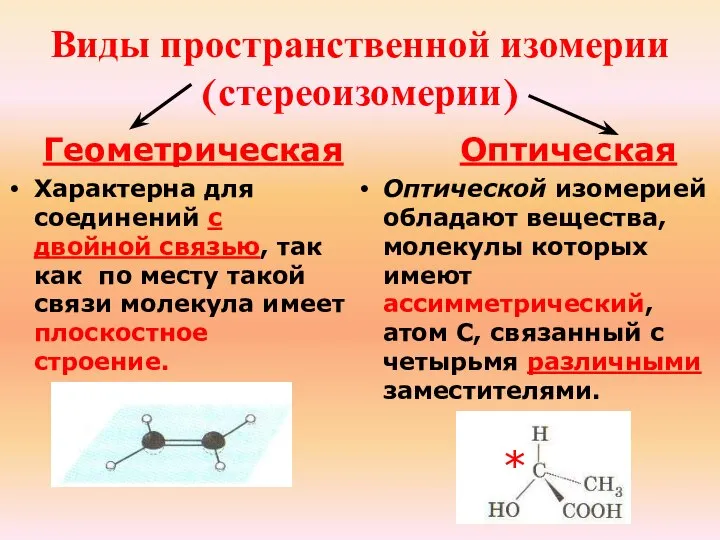
- 22. Виды пространственной изомерии (стереоизомерии) Геометрическая Характерна для соединений с двойной связью, так как по месту такой
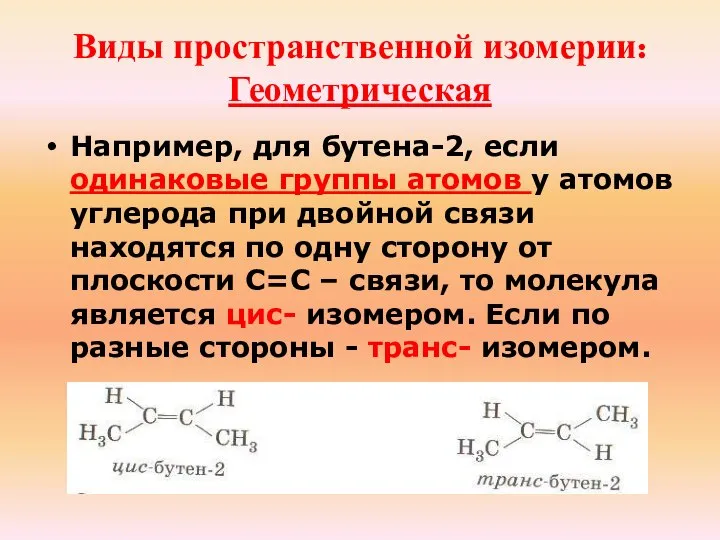
- 23. Виды пространственной изомерии: Геометрическая Например, для бутена-2, если одинаковые группы атомов у атомов углерода при двойной
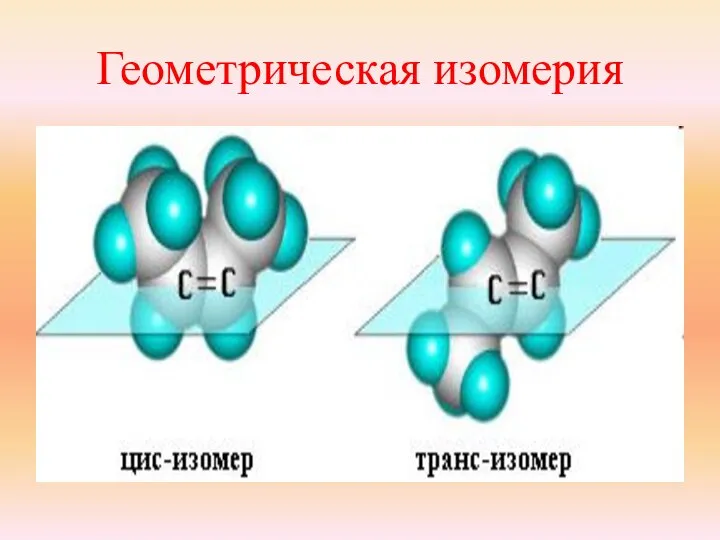
- 24. Геометрическая изомерия
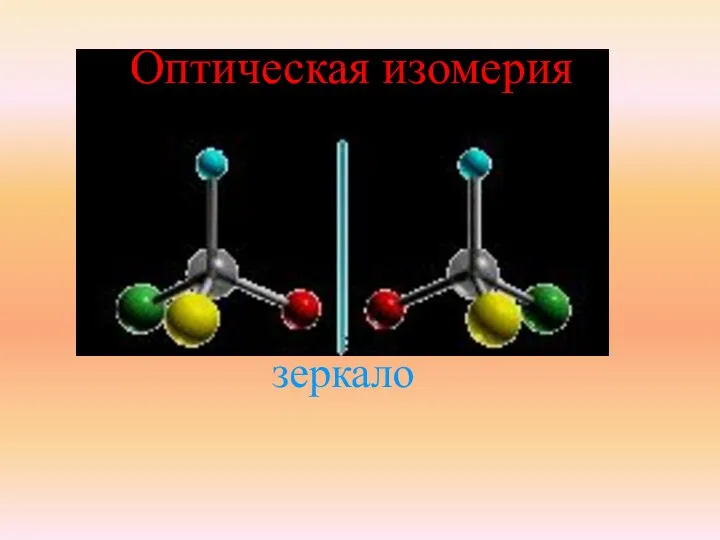
- 25. Виды пространственной изомерии: Оптическая Оптические изомеры являются зеркальным изображением друг друга, подобно двум ладоням. 2 изомера
- 26. зеркало Оптическая изомерия
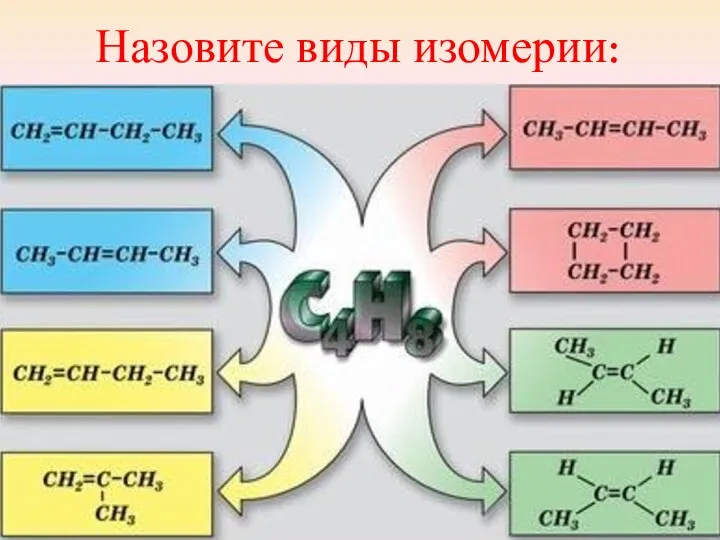
- 27. Назовите виды изомерии:
- 28. Составьте структурные формулы изомеров: С6Н12
- 29. III. Электронное строение
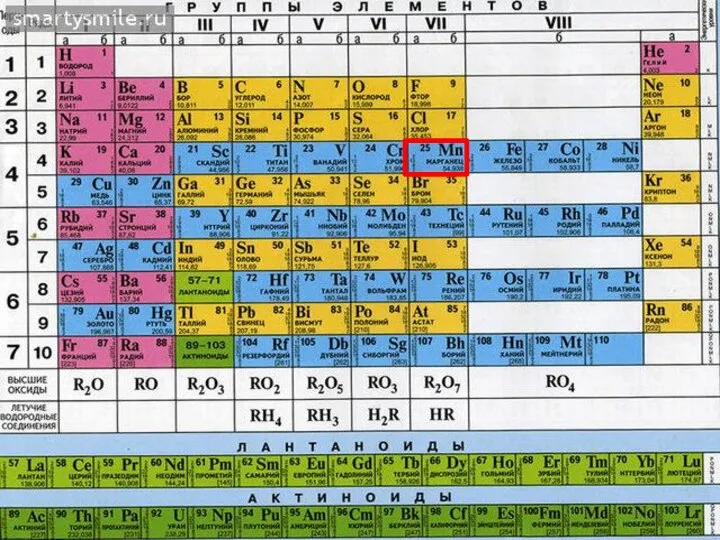
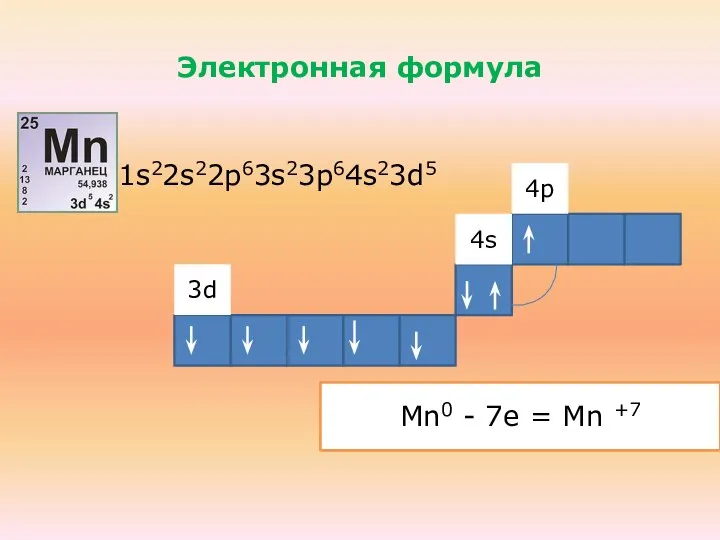
- 32. 4 период, VII группа, побочная подгруппа d-элемент, внешний уровень-4-ый
- 33. Mn0 - 2e = Mn +2 Mn0 - 3e = Mn +3 Электронная формула 1s22s22p63s23p64s23d5 4s
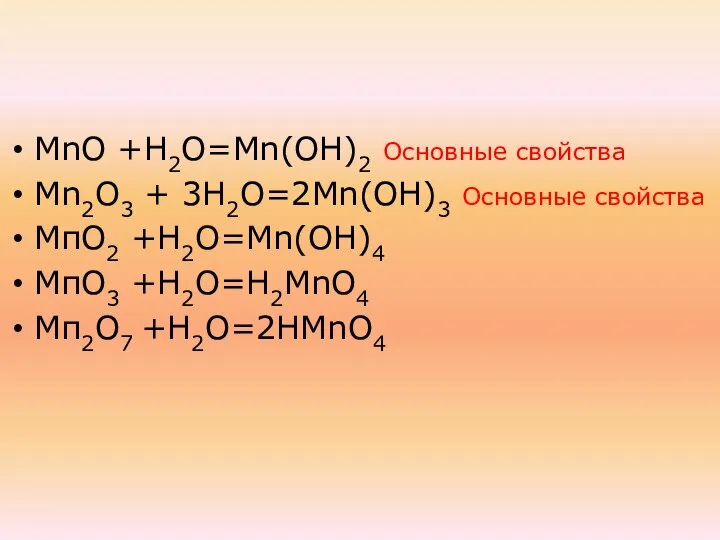
- 34. Оксиды марганца МnО Мn2О3 МпО2 МпО3 Мп2О7
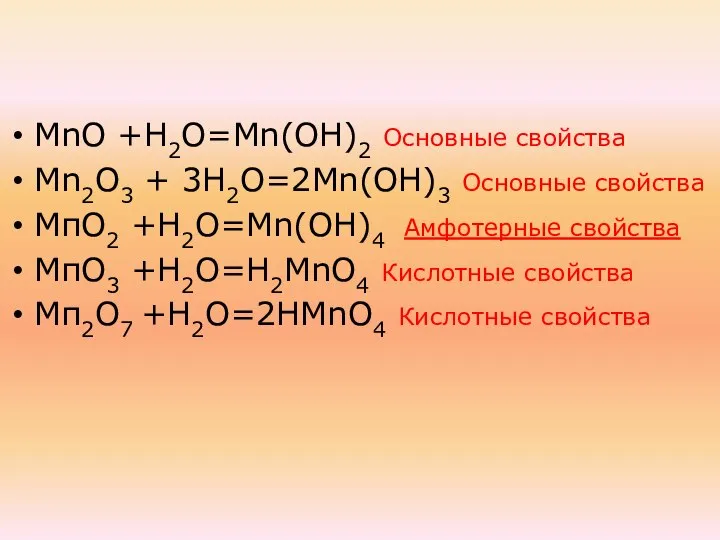
- 35. При взаимодействии в водой образуют: МnО +Н2О=Мn(ОН)2 Мn2О3 + 3Н2О=2Мn(ОН)3 МпО2 +Н2О=Mn(ОН)4 МпО3 +Н2О=Н2МnО4 Мп2О7 +Н2О=2НМnО4
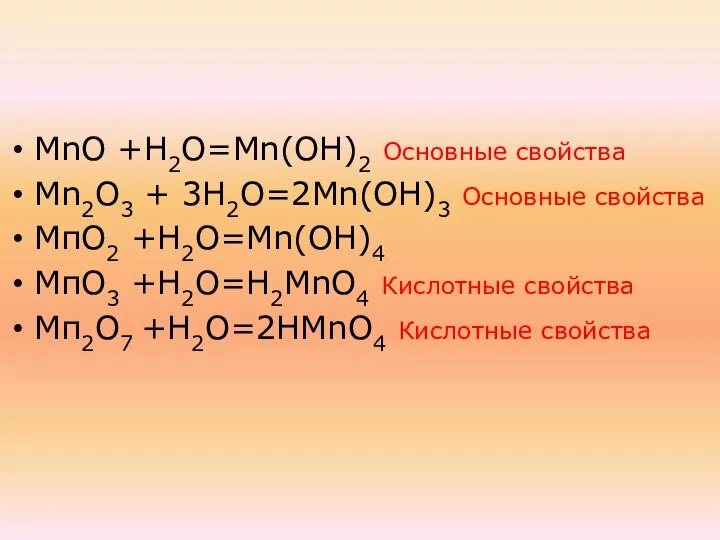
- 36. МnО +Н2О=Мn(ОН)2 Основные свойства Мn2О3 + 3Н2О=2Мn(ОН)3 Основные свойства МпО2 +Н2О=Mn(ОН)4 МпО3 +Н2О=Н2МnО4 Мп2О7 +Н2О=2НМnО4
- 37. МnО +Н2О=Мn(ОН)2 Основные свойства Мn2О3 + 3Н2О=2Мn(ОН)3 Основные свойства МпО2 +Н2О=Mn(ОН)4 МпО3 +Н2О=Н2МnО4 Кислотные свойства Мп2О7
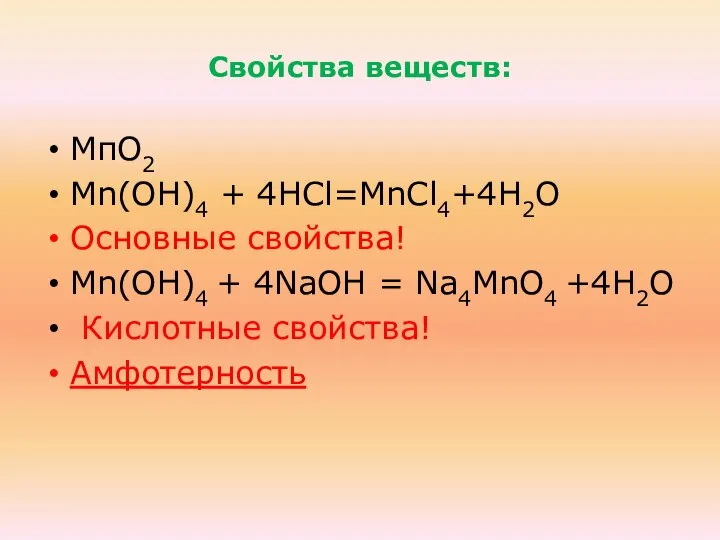
- 38. Свойства веществ: МпО2 Mn(ОН)4 + 4НCl=MnCl4+4Н2О Основные свойства! Mn(ОН)4 + 4NaOH = Na4МnО4 +4Н2О Кислотные свойства!
- 39. МnО +Н2О=Мn(ОН)2 Основные свойства Мn2О3 + 3Н2О=2Мn(ОН)3 Основные свойства МпО2 +Н2О=Mn(ОН)4 Амфотерные свойства МпО3 +Н2О=Н2МnО4 Кислотные
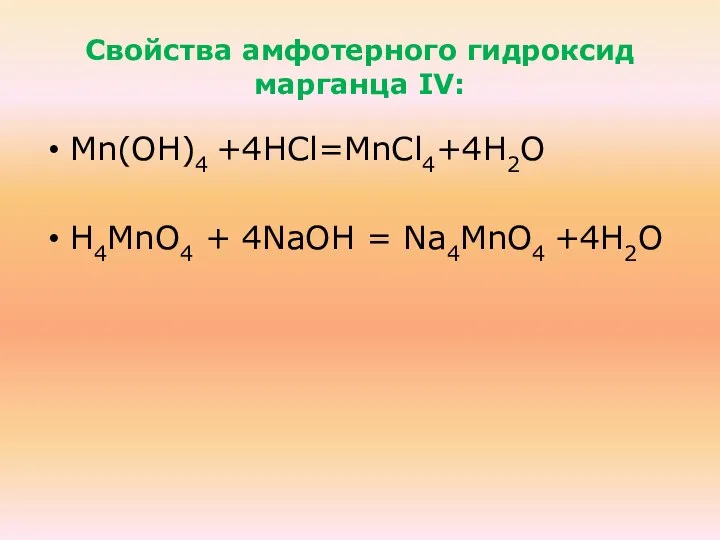
- 40. Гидроксид марганца IV можно записать как основание и как кислоту: Mn(ОН)4 = Н4МnО4
- 41. Свойства амфотерного гидроксид марганца IV: Mn(ОН)4 +4НCl=MnCl4+4Н2О Н4МnО4 + 4NaOH = Na4МnО4 +4Н2О
- 42. Вывод: Особенности электронного строения марганца позволяют проявлять данному химическому элементу амфотерные свойства
- 44. Скачать презентацию























 Молекула воды, какая ты?
Молекула воды, какая ты? Ионные уравнения
Ионные уравнения Увлекательный мир химии
Увлекательный мир химии Понятие о сплавах и методах их получения
Понятие о сплавах и методах их получения Учёные-химики в годы Великой Отечественной войны
Учёные-химики в годы Великой Отечественной войны Эфиры. Жиры
Эфиры. Жиры Железо и его соединения
Железо и его соединения Презентация на тему Основные законы науки химии
Презентация на тему Основные законы науки химии  Натуральный каучук
Натуральный каучук Гравиметрический анализ. Лекция №11
Гравиметрический анализ. Лекция №11 Презентация на тему Пластмасса
Презентация на тему Пластмасса  Ароматические и ненасыщенные альдегиды и кетоны
Ароматические и ненасыщенные альдегиды и кетоны Аргументы к апелляции на ЕГЭ по химии 2021
Аргументы к апелляции на ЕГЭ по химии 2021 Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Алкены (CnH2n)
Алкены (CnH2n) Современные представления о строении атома
Современные представления о строении атома Изучение свойств азотной кислоты для учащихся 9 классов
Изучение свойств азотной кислоты для учащихся 9 классов Химическая связь
Химическая связь Презентация на тему Биологические действия радиации
Презентация на тему Биологические действия радиации  Ступенчатые процессы получения полимеров: полиприсоединение, поликонденсация
Ступенчатые процессы получения полимеров: полиприсоединение, поликонденсация Роль Хеуорса, Фишера, Лемье в изучении структуры углеводов
Роль Хеуорса, Фишера, Лемье в изучении структуры углеводов Условия хранения и подготовка скоропортящихся грузов к перевозкам
Условия хранения и подготовка скоропортящихся грузов к перевозкам Презентация на тему Сплавы металлов
Презентация на тему Сплавы металлов  Амины
Амины Нефть. Состав и свойства
Нефть. Состав и свойства Электролитическая диссоциация
Электролитическая диссоциация 10 класс природные источники углеводородов
10 класс природные источники углеводородов Электролиз
Электролиз