- Главная
- Математика
- Правильные многогранники

Содержание
- 2. ИСТОРИЯ ПРАВИЛЬНЫХ МНОГОГРАННИКОВ Правильные многогранники известны с древнейших времён. Их орнаментные модели можно найти на резных
- 3. ПРАВИЛЬНЫЕ МНОГОГРАННИКИ В НАУКЕ Многогранники в физике Некоторые атомные ядра могут иметь вид правильных многогранников
- 4. ПРАВИЛЬНЫЕ МНОГОГРАННИКИ В ПРИРОДЕ Метан. Кристаллическая решётка метана имеет форму тетраэдра. Метан горит бесцветным пламенем. С
- 6. Скачать презентацию
Слайд 2 ИСТОРИЯ ПРАВИЛЬНЫХ МНОГОГРАННИКОВ
Правильные многогранники известны с древнейших времён. Их орнаментные
ИСТОРИЯ ПРАВИЛЬНЫХ МНОГОГРАННИКОВ
Правильные многогранники известны с древнейших времён. Их орнаментные

В XVI веке немецкий астроном Иоганн Кеплер пытался найти связь между пятью известными на тот момент планетами Солнечной системы (исключая Землю) и правильными многогранниками. В книге «Тайна мира», опубликованной в 1596 году, Кеплер изложил свою модель Солнечной системы. В ней пять правильных многогранников помещались один в другой и разделялись серией вписанных и описанных сфер. Каждая из шести сфер соответствовала одной из планет (Меркурию, Венере, Земле, Марсу, Юпитеру и Сатурну). Многогранники были расположены в следующем порядке (от внутреннего к внешнему): октаэдр, за ним икосаэдр, додекаэдр, тетраэдр и, наконец, куб. Таким образом, структура Солнечной системы и отношения расстояний между планетами определялись правильными многогранниками. Позже от оригинальной идеи Кеплера пришлось отказаться, но результатом его поисков стало открытие двух законов орбитальной динамики — законов Кеплера, — изменивших курс физики и астрономии, а также правильных звёздчатых многогранников (тел Кеплера — Пуансо).
Слайд 3ПРАВИЛЬНЫЕ МНОГОГРАННИКИ В НАУКЕ
Многогранники в физике
Некоторые атомные ядра могут
ПРАВИЛЬНЫЕ МНОГОГРАННИКИ В НАУКЕ
Многогранники в физике
Некоторые атомные ядра могут

округлѐнными углами.
Кристаллы являются природными многогранниками
Слайд 4ПРАВИЛЬНЫЕ МНОГОГРАННИКИ В ПРИРОДЕ
Метан.
Кристаллическая решётка метана имеет форму тетраэдра. Метан горит бесцветным пламенем.
ПРАВИЛЬНЫЕ МНОГОГРАННИКИ В ПРИРОДЕ
Метан.
Кристаллическая решётка метана имеет форму тетраэдра. Метан горит бесцветным пламенем.

Аммиак.
Каждая молекула аммиака имеет не поделённую пару электронов у атома азота. Орбитали атомов азота, содержащие не поделённые пары электронов, перекрываются с sp3-гибридными орбиталями цинка(II), образуя тетраэдрический комплексный катион тетраамминцинка(II) [Zn(NH3)4]2+.
 Алгоритмы на графах
Алгоритмы на графах Додавання, редагування та формування таблиць
Додавання, редагування та формування таблиць Линейная алгебра Матрицы
Линейная алгебра Матрицы Геометрические фигуры
Геометрические фигуры Степень многочлена
Степень многочлена Формулы корней квадратных уравнений
Формулы корней квадратных уравнений Геометрические преобразования пространства
Геометрические преобразования пространства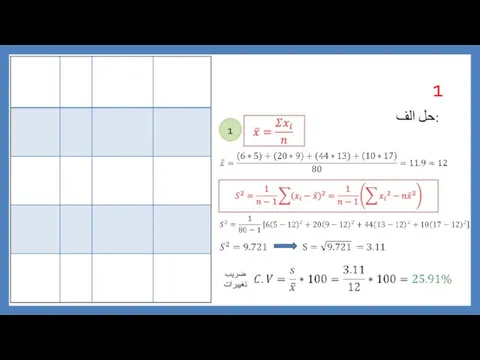 حل تمرین آمار
حل تمرین آمار Большие квадраты
Большие квадраты Разгадайте загадки
Разгадайте загадки Числа, кратные 6
Числа, кратные 6 Начала теории вероятностей
Начала теории вероятностей Презентация на тему Вычитание и сказка "Царевна-лягушка" 2 класс
Презентация на тему Вычитание и сказка "Царевна-лягушка" 2 класс  Математический счет. Весёлые задачки
Математический счет. Весёлые задачки 1662566576077__omk2yv
1662566576077__omk2yv Уравнение. Корень уравнения
Уравнение. Корень уравнения Введение в геометрию. Городской математический кружок. 6-7 классы
Введение в геометрию. Городской математический кружок. 6-7 классы Меню. Основные простые формы. Общие простые формы
Меню. Основные простые формы. Общие простые формы Математика. Треугольник
Математика. Треугольник “Розв’язування задач”. Навчальний зошит. 2 клас. 3 частина
“Розв’язування задач”. Навчальний зошит. 2 клас. 3 частина Памятка по оформлению краткой записи к задачам (1 класс)
Памятка по оформлению краткой записи к задачам (1 класс) Симметрия в науке
Симметрия в науке Готовимся к ОГЭ по математике
Готовимся к ОГЭ по математике Тригонометрические уравнения. Частные случаи
Тригонометрические уравнения. Частные случаи Таблица умножения. Анимированная сорбонка
Таблица умножения. Анимированная сорбонка Сечение поверхности плоскостью
Сечение поверхности плоскостью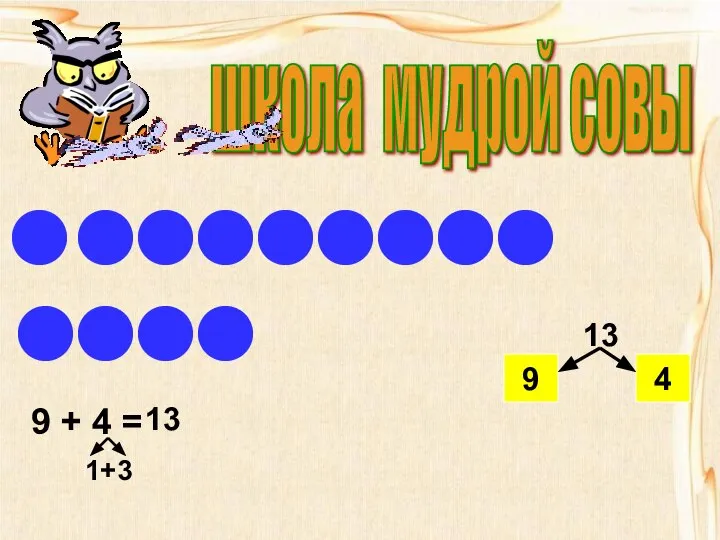 Состав числа 13
Состав числа 13 Запись Арифметических выражений и на языке программирования Паскаль
Запись Арифметических выражений и на языке программирования Паскаль