Слайд 2Качество дезинфекции зависит:
1. от правильности выбора дезинфицирующего средства для данной инфекции:

2. от концентрации примененного дезинфектанта;
3. от температуры дезинфицирующего раствора;
4. от количества раствора, израсходованного на 1 кв/м.
Слайд 3Кроме того, качество произведенной дезинфекции зависит от качества механической очистки объекта (помещения).

Для того чтобы убедиться - правильно-ли выбран дезинфектант, его концентрация и пр., существует бактериологическая методика контроля качества дезинфекции.
Слайд 4Прежде чем остановиться на методике, необходимо выяснить, надо ли при дезинфекции убивать

всех патогенных микроорганизмов или достаточно уничтожить только большую их часть.
Слайд 5Установлено, что не все и не всегда микробы погибают или теряют свою

вирулентность даже при взаимодействии с высокоэффективными дезинфицирующими веществами. Доказано, что часто вирулентность, оставшихся в живых микробов сохраняется, но количество их резко уменьшается.
Слайд 6Во многих случаях животное может преодолеть воздействие оставшихся после дезинфекции микроорганизмов, но

возможны случаи и заражения.
Все в данном случае зависит от числа оставшихся возбудителей, их вирулентности, состояния самого животного и условий его содержания. Это обязывает тщательно проводить дезинфекцию.
Слайд 7В последнее время принято считать, что при дезинфекции надо полностью уничтожать патогенных

возбудителей инфекции.
В 1954 году Минздрав СССР составил "Инструкцию по бактериологическому контролю качества дезинфекционной обработки очагов кишечных инфекций".
Слайд 8Критерием для оценки дезинфекции в этих очагах служит кишечная палочка (Eschericha coli),

как постоянно присутствующий микроб.
Поляков А.А., Тереньтьева К.И. в 1952-1955 годах провели исследования и разработали метод контроля качества дезинфекции животноводческих объектов.
Полученные данные показали, что кишечная палочка может быть использована для контроля качества дезинфекции.
Слайд 9Этот вид микроба наиболее распространен в животноводческих помещениях; как правило, кишечная палочка

выделяется до дезинфекции (после очистки и промывки) в 100% случаев из проб с пола и в подавляющем большинстве случаев из проб со стен.
После правильно проведенной дезинфекции ни в одном случае не было обнаружено роста кишечной палочки.
Слайд 10Кишечная палочка по своей устойчивости к химическим дезинфицирующим средствам не уступает многим

патогенным неспорообразующим и некокковым микроорганизмам или превосходит их.
Установлено, что если при дезинфекции будет уничтожена кишечная палочка, будут уничтожены и возбудители таких болезней, как бруцеллез, сальмонеллез, колибактериоз, рожа.
Исключением в этом отношении могут быть возбудители туберкулеза, мыта и спорообразующая микрофлора, устойчивость которой гораздо выше.
Слайд 11Е.С. Цой в 1969 году установил одинаковую устойчивость к химическим дезосредствам разных

патогенных возбудителей туберкулеза и стафилококков.
Стафилококки, как и кишечная палочка, присутствуют в 100% проб, взятых в помещениях для животных.
Это дало возможность использовать данные микроорганизмы в качестве контрольно-санитарных при бактериологическом контроле качества произведенной дезинфекции при туберкулезе.
Слайд 12Отбор проб для определения качества дезинфекции проводит ветеринарный врач хозяйства.
Пробы берут

через 2-3 часа после проведения профилактической дезинфекции или по истечению определенной экспозиции при текущей дезинфекции.
Пробы берут с пола, с двух стен в стойле, в месте расположения задних конечностей животного, из углов и кормушек.
Всего - с 10-ти различных участков.
Слайд 13Для этого намечают квадраты величиной 10 х 10 см и протирают их

в течение 1-2 минут стерильным ватным тампоном, пропитанным и хорошо отжатым в колбе (пробирке) с нейтрализующим раствором.
Тампон, каждый в отдельности, помещают в стерильный нейтрализующий раствор или стерильную воду (20 мл) и в таком виде доставляют в лабораторию.
Слайд 15Для нейтрализации:
хлорной извести используют 0,1% раствор тиосульфата натрия;
для щелочных растворов

- 0,01% раствор уксусной кислоты;
для формалина - 1-2% раствор нашатырного спирта.
Концентрация нейтрализующих растворов должна быть в 10 раз меньше концентрации растворов, применяющихся для дезинфекции.
Слайд 16При применении креолина, лизола, серно-карболовой смеси и других дезинфектантов, при которых нет

нейтрализаторов, тампоны промывают двукратно по 5-10 минут в стерильной воде.
Пробы доставляют в лабораторию не позднее чем через 2 часа после их отбора.
Слайд 17К пробам пишут сопроводительную, в которой указывают:
хозяйство;
2) тип постройки;
3)

дату и время дезинфекции;
4) дату и время отбора проб;
5) вид дезинфекции (профилактическая, текущая, заключительная);
6) качество механической очистки.
В лаборатории пробы исследуют в тот же день.
Слайд 18Тампоны отмывают во флаконе с 20 мл стерильной нейтрализующей жидкости или воды,
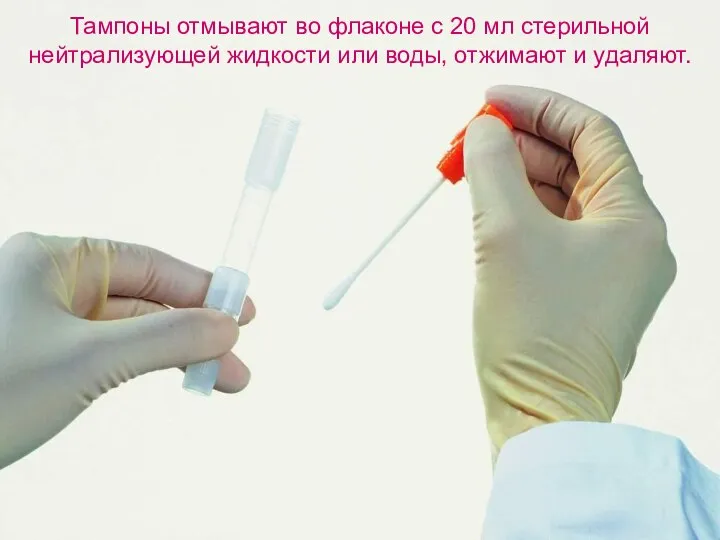
отжимают и удаляют.
Слайд 19Жидкость центрифугируют 20-30 минут при 3000-3500 об/мин.

Слайд 20В осадок добавляют равное количество стерильной воды, содержимое смешивают и вновь центрифугируют

20 минут.
Жидкость сливают, а с осадка делают посев на элективные питательные среды.
Слайд 21Для индикации кишечной палочки высев делают на модифицированную среду Хейфеца (индикаторами, в

которой служат розоловая кислота и метиленовая синька), по 0,5 мл центрифугата на 5 мл среды.
Культивируют при температуре 43°С в течение 12-18 часов.
Кишечная палочка изменяет цвет среды из малинового в зеленый или салатовый, среда становится мутной с пузырьками газа.
Слайд 22Высев на модифицированную среду Хейфеца.

Слайд 23Для индикации стафилококков 0,5 мл центрифугата высевают в 5 мл 50%-ного сахарозного

мясопептонного бульона (МПБ). Инкубируют 24 часа при температуре 37ºС, затем пересевают на 8,5%-ный солевой мясопептонный бульон (МПБ) и инкубируют 24 часа при 37°С. Полученную культуру исследуют под микроскопом.
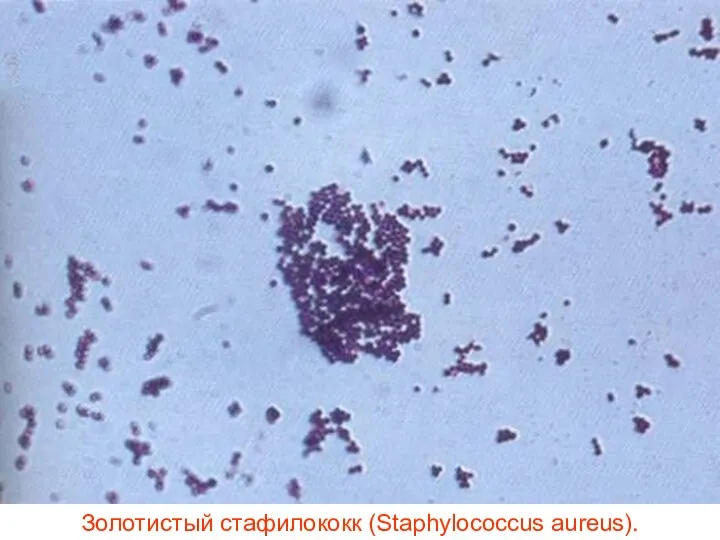
Слайд 24Золотистый стафилококк (Staphylococcus aureus).
Слайд 25Учет результатов:
Удовлетворительный результат означает, что при:
1) профилактической дезинфекции ни в

одной из проб не выделен контрольно-санитарный микроорганизм, или он установлен не более чем в 20% проб;
2) текущей дезинфекции - отрицательный результат не менее чем в 90% проб;
3) заключительной дезинфекции - во всех пробах отрицательный результат.
Контроль качества заключительной дезинфекции при туберкулезе проводят параллельно двумя методами: по выделению стафилококка и микобактерий.
Слайд 26Контроль качества дезинфекции по микобактериям.
Из кислотоупорных сапрофитов рода микобактерий готовят нефиксированные

мазки (тестобъекты) на предметных стеклах, которые раскладывают в различных местах помещения до дезинфекции. После окончания дезинфекции и срока экспозиции тестобъекты собирают обрабатывают в нейтрализующем растворе и помещают в микрокультиватор Н.М. Колычева, который заполняют жидкой средой Сотона и культивируют при 37ºС в течение 48 часов.
Слайд 27По окончании этого срока тестобъекты извлекают, промывают от среды, фиксируют над пламенем

горелки и окрашивают методом Циль Нильсона.
Если в процессе дезинфекции тестмикробы не погибли на стекле образуются микроколонии, которые можно обнаружить под микроскопом.
Слайд 28Изучение тестобъекта под микроскопом.



























 О мерах по обеспечению безопасности несовершеннолетних в связи с угрозой распространения коронавирусной инфекции
О мерах по обеспечению безопасности несовершеннолетних в связи с угрозой распространения коронавирусной инфекции Понятие риска и общие аспекты использования методологии риска в системах СГМ и управления санитарно-эпидемиологической ситуацией
Понятие риска и общие аспекты использования методологии риска в системах СГМ и управления санитарно-эпидемиологической ситуацией Уход и наблюдение за пациентами с нарушением функции пищеварительной и мочеполовой системы
Уход и наблюдение за пациентами с нарушением функции пищеварительной и мочеполовой системы Школа для пациентов с болезнью Паркинсона и их родственников. Занятие №5
Школа для пациентов с болезнью Паркинсона и их родственников. Занятие №5 Физиология ССС. Электрогенез в миокарде
Физиология ССС. Электрогенез в миокарде Близнецы. Сиамские близнецы
Близнецы. Сиамские близнецы Слизстая протезного ложа
Слизстая протезного ложа Осложнения при выскабливаниях матки во время беременности
Осложнения при выскабливаниях матки во время беременности Неотложные состояния в урологии Донецк 2021
Неотложные состояния в урологии Донецк 2021 Mécanismes biochimiques du développement des pathologies des tissus de la cavité buccale
Mécanismes biochimiques du développement des pathologies des tissus de la cavité buccale Артериальное кровотечение. Признаки и оказания первой помощи
Артериальное кровотечение. Признаки и оказания первой помощи APC и b-катенин
APC и b-катенин Лучшая в СНГ программа по омоложению организма. Помолодей за 30 дней
Лучшая в СНГ программа по омоложению организма. Помолодей за 30 дней Связочные нарушения миофасциальных цепей. Вентральная МФЦ. Дорзальная МФЦ
Связочные нарушения миофасциальных цепей. Вентральная МФЦ. Дорзальная МФЦ Правила взятия периферической крови
Правила взятия периферической крови Диагностика сахарного диабета
Диагностика сахарного диабета Профилактика сахарного диабета
Профилактика сахарного диабета Аритмогенная кардиомиопатия правого желудочка сердца (АДПЖ)
Аритмогенная кардиомиопатия правого желудочка сердца (АДПЖ) Анатомо-физиологические особенности поджелудочной железы
Анатомо-физиологические особенности поджелудочной железы Болезни суставов у животных (лекция 6)
Болезни суставов у животных (лекция 6) ЭхоКГ-признаки ТЭЛА
ЭхоКГ-признаки ТЭЛА Клиническое наблюдение.Клиническое наблюдение
Клиническое наблюдение.Клиническое наблюдение Лабораторная диагностика патологий печени. Гепатиты и гепатозы
Лабораторная диагностика патологий печени. Гепатиты и гепатозы Наркомания
Наркомания Как геймеры помогают сделать жизнь лучше
Как геймеры помогают сделать жизнь лучше 4 февраля – всемирный день борьбы против рака
4 февраля – всемирный день борьбы против рака АРИТМИИ
АРИТМИИ Антибактериальные препараты. Карбапенемы
Антибактериальные препараты. Карбапенемы