Содержание
- 2. В нормально функционирующем организме иммунные реакции должны быть (подобно кровяному давлению) адекватными (нормальными) - их неоправданное
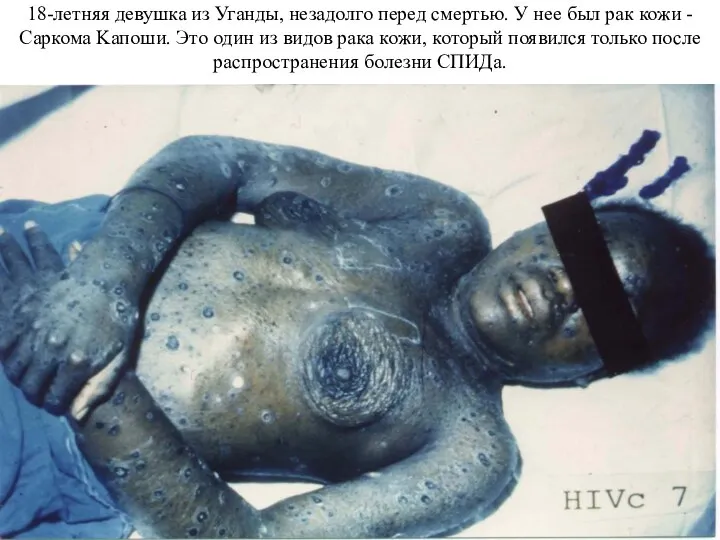
- 3. 18-летняя девушка из Уганды, незадолго перед смертью. У нее был рак кожи - Саркома Kaпоши. Это
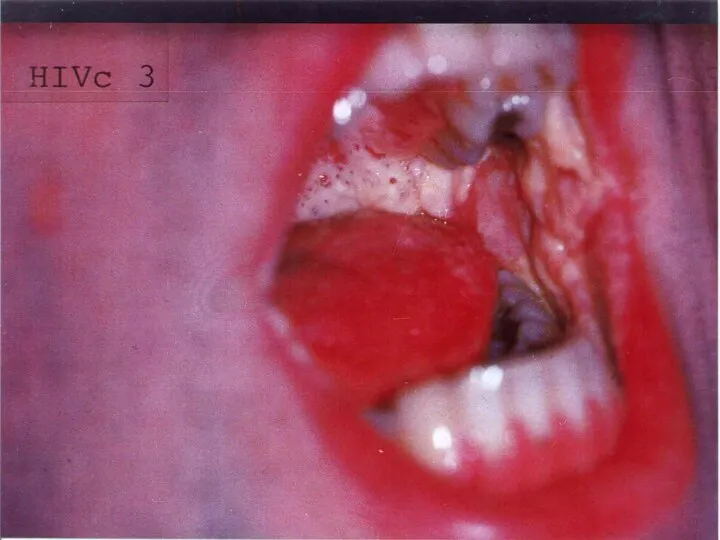
- 4. Очень грубые формы иммунодефицитов называются СПИД (англ. AIDS). При СПИДе большое количество различной патогенной микрофлоры (ВИЧ-инфекции),
- 6. Будучи свойствами, зависящими от состояния организма, иммунные реакции никогда (!) не нарушаются сами по себе, изолированно,
- 7. Главное в лечении иммунопатологических состояний (иммунодефицитов и аллергий) — это компенсация причин иммунных нарушений у пациента.
- 9. ТРАНСПЛАНТАЦИОННЫЙ ИММУНИТЕТ Идея пересадки органов была продиктована перспективой замены больного органа здоровым. Впервые в мире трансплантация
- 11. В связи с тем, что клетки донора несут на своей поверхности антигены, которые отличаются от антигенов
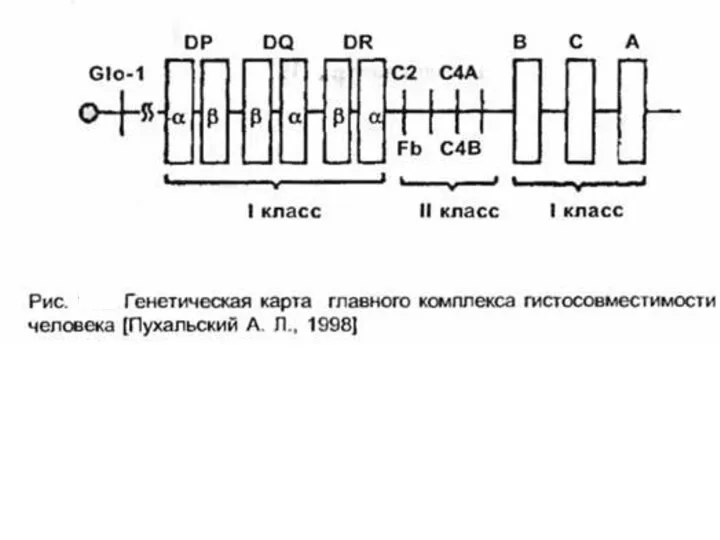
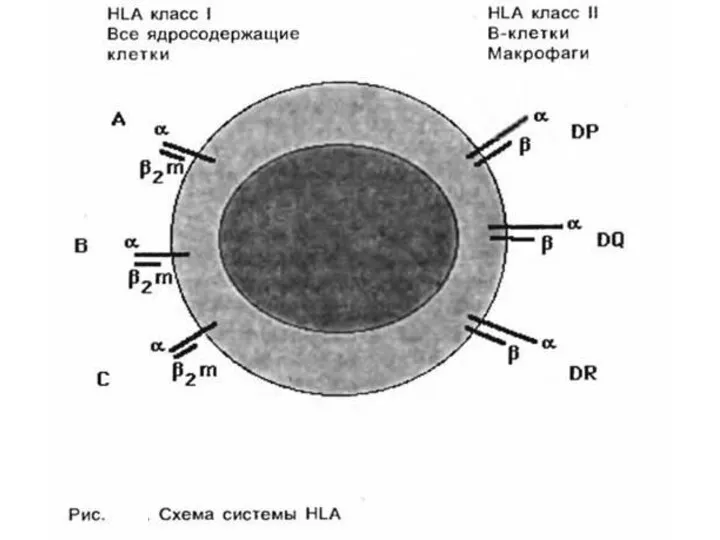
- 12. У человека комплекс МНС иногда называют HLA [от англ. human leucocyte antigen, Аг лейкоцитов человека]. В
- 17. Собственно селекция преследует подбор такой пары донор — реципиент, в которой донор наименьшим образом отличается от
- 18. Предсуществующие антитела. Согласно общеизвестному правилу, пересадка аллогенного органа категорически запрещена при наличии у реципиента предсуществующих антител
- 19. Стандартный тест перекрестной совместимости по комплементзависимой цитототоксичности (cross-match) Этот стандартный тест перекрестной совместимости основан на комплемент-опосредованной
- 20. Оценка перекрестной совместимости с помощью проточной цитометрии Анализ перекрестной совместимости с помощью проточной цитометрни – это
- 21. Оценка перекрестной совместимости с помощью Luminex На первом этапе суммарные лимфоциты донора выделяют из образцов периферической
- 22. Возможны (и нередко) случаи отторжения трансплантата при отрицательной кросс матч, и, наоборот, при положительной кросс матч
- 23. Положительные результаты пересадки аллогенного органа при положительной кросс матч, можно объяснить существованием двух видов предсуществующих антител;
- 24. Для более тщательной селекции пары донор – реципиент необходимо выявить пресенсибилизацию реципиента к антигенам донора, которые
- 25. Итак, для селекции пары донор-реципиент необходимо определить: Степень гистосовместимости, т.е. HLA-фенотип донора и реципиента; Разнотемпературные предсуществующие
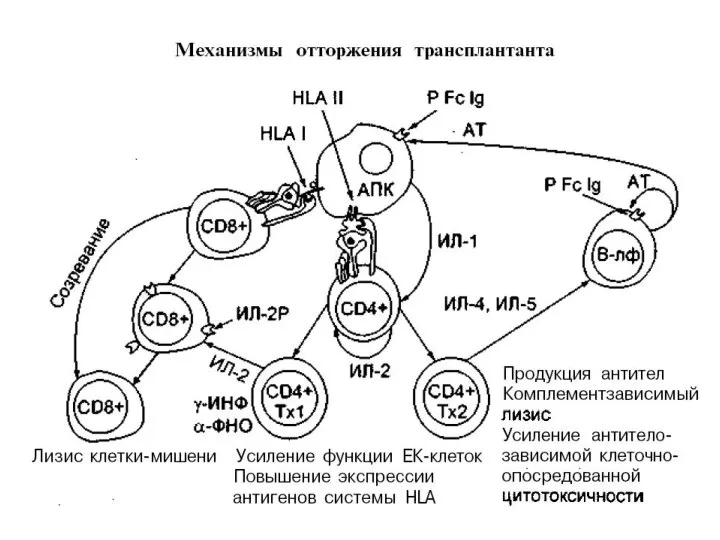
- 26. Аллотрансплантат, наделенный чужеродными антигенными структурами, инициирует у реципиента иммунный ответ. В результате этого развивается реакция отторжения,
- 27. Механизм острого отторжения. В патогенезе острого криза отторжения, возникающего вследствие недостаточной иммуносупрессивной терапии, основная роль принадлежит
- 28. Прямое распознавание основано на том, что антигены донора в виде пептидов представляются для распознавания Т-лимфоцитам реципиента
- 30. Непрямое распознавание антигенов донора основано на общебиологическом принципе: процессинг донорских антигенов и презентация пептидов осуществляются антигенпредставляющими
- 31. Механизм хронического отторжения. Развитие хронического отторжения трансплантата возможно через несколько месяцев или даже лет после пересадки
- 32. Кроме трансплантационных антигенов главного комплекса гистосовместимости существуют также минорные антигены гистосовместимости. Они представляют собой аллельные варианты
- 33. Проведение иммуносупрессивной терапии является обязательной процедурой во всех случаях аллотрансплантации, как при пересадке органа от HLA-совместимого
- 34. В иммуносупрессивной терапии наиболее часто применяют следующие препараты и средства: 1. Азатиоприн (имуран). Препарат угнетает клеточный
- 35. 6. Рапамицин. Препарат подавляет реакции клеточного иммунитета, ингибирует активность клеток в G1 фазе клеточного цикла, подавляет
- 36. Находясь в суспензии, под действием постоянного электрического поля клетки мигрируют к аноду. Миграция становится возможной вследствие
- 38. Скачать презентацию
Слайд 2В нормально функционирующем организме иммунные реакции должны быть (подобно кровяному давлению) адекватными
В нормально функционирующем организме иммунные реакции должны быть (подобно кровяному давлению) адекватными

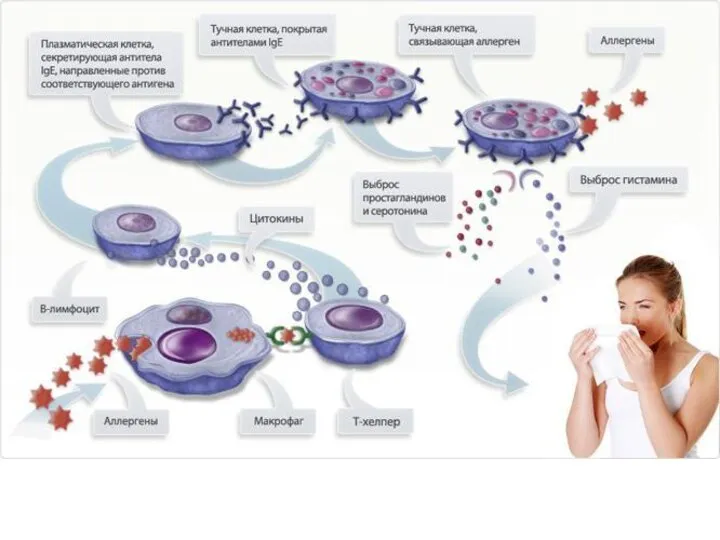
Неадекватные повышения иммунных реакций (гипериммунный ответ) называются аллергии.
Неадекватные понижения иммунных реакций (иммунного ответа) называются иммунодефицитные состояния (иммунодефициты).
Грубые иммунодефициты позволяют длительно функционировать на человеке различным видам патогенной бактериальной и вирусной микрофлоры, в т.ч. хламидийной, герпетической, Эпштейн-Барр, энтеровирусной, цитомегаловирусной, вирусам гепатита В и С, вирусам папилломы человека и другим внутриклеточным инфекциям, что ведёт не только к дальнейшему осложнению состояния, но и вызывает риск появления онкологических изменений, особенно, если у ближайших родственников больного уже отмечались случаи онкологии. В частности, в современной медицине длительно протекающие заболевания герпесом, Эпштейн-Барр, ЦМВ, хламидиозом, гепатитом В и С, папилломавирусом и некоторые другие рассматриваются как предраковые состояния.
Иммунопатологии в экспериментах in vivo, исследование патогенеза и этиологии иммунопатологических заболеваний
Слайд 318-летняя девушка из Уганды, незадолго перед смертью. У нее был рак кожи
18-летняя девушка из Уганды, незадолго перед смертью. У нее был рак кожи
Слайд 4Очень грубые формы иммунодефицитов называются СПИД (англ. AIDS). При СПИДе большое количество
Очень грубые формы иммунодефицитов называются СПИД (англ. AIDS). При СПИДе большое количество

Важно отметить, что практически всегда иммунные реакции нарушаются разнонаправленно. Когда одни из них неадекватно понижаются, другие неадекватно повышаются, что называется дисбалансом иммунной системы. Поэтому у аллергиков почти всегда наблюдаются и признаки иммунодефицитного состояния - или хронические воспалительные процессы, или склонность к частым ОРВИ и др., а у пациентов с иммунодефицитными состояниями присутствует в какой-либо форме и симптоматика аллергии. Следует помнить, что при всяком длительно протекающем воспалительном процессе обязательно происходит местная аллергизация тканей. И в этом еще одна опасность осложнений, которую несут хронические воспалительные процессы. В частности, хронические или частые бронхиты могут спровоцировать возникновение бронхоспазмов, бронхиальной астмы.
Слайд 6Будучи свойствами, зависящими от состояния организма, иммунные реакции никогда (!) не нарушаются
Будучи свойствами, зависящими от состояния организма, иммунные реакции никогда (!) не нарушаются

Наличие иммунной дисфункции — это всегда свидетельство наличия у пациента серьезных системных нарушений. Поэтому результаты объективной диагностики (клинико-лабораторной и аппаратной), являющейся первым и необходимым этапом лечебного процесса, должны дать ответы на два основных вопроса:
какие иммунные реакции пациента в какой степени нарушены?
и, самое главное, в результате чего они нарушены?
Слайд 7Главное в лечении иммунопатологических состояний (иммунодефицитов и аллергий) — это компенсация причин
Главное в лечении иммунопатологических состояний (иммунодефицитов и аллергий) — это компенсация причин

Поэтому, попытки аллергика выявить, что является для него аллергенами, и в дальнейшем избегать этих веществ, приводят только к временному чисто внешнему облегчению симптоматики.
Патологически измененное состояние организма при этом в полной мере сохраняется и, чаще всего, усугубляется в дальнейшем, что проявляется и в постепенном расширении спектра аллергенов, и во все большем обострении аллергических реакций, и в появлении новых, не отмечавшихся ранее, заболеваний.
Слайд 9ТРАНСПЛАНТАЦИОННЫЙ ИММУНИТЕТ
Идея пересадки органов была продиктована перспективой замены больного органа здоровым. Впервые
ТРАНСПЛАНТАЦИОННЫЙ ИММУНИТЕТ
Идея пересадки органов была продиктована перспективой замены больного органа здоровым. Впервые

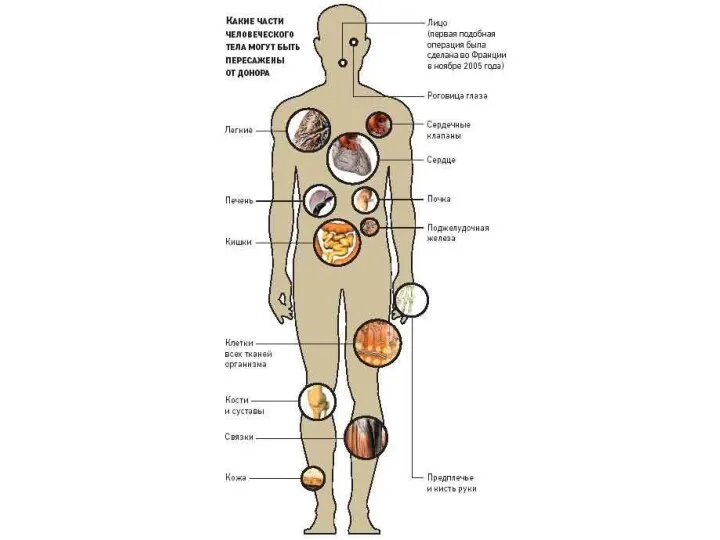
Существуют следующие виды трансплантации:
1) Аутотрансплантация — пересадка собственных тканей;
2) Аллотрансплантация — пересадка органов и тканей в пределах одного и того же биологического вида;
3) Ксенотрансплантация — пересадка органов и тканей в пределах разных биологических видов;
4) Изотрансплантация — пересадка между идентичными близнецами или между генетически идентичными животными.
Субъект, которому пересаживают трансплантат, является реципиентом, а тот, от которого забирают орган или ткань — донором.
Слайд 11В связи с тем, что клетки донора несут на своей поверхности антигены,
В связи с тем, что клетки донора несут на своей поверхности антигены,

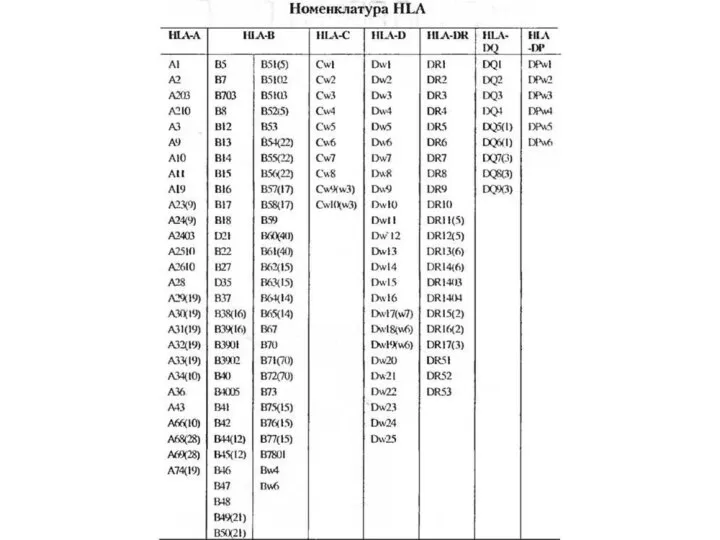
Способом, который в большей или меньшей мере уменьшает реакцию отторжения, является селекция (подбор) пары донор — реципиент по антигенам гистосрвместимости, которые у человека объединены в систему HLA (Human leucocyte antigens). Они также получили название трансплантационных антигенов. В практике трансплантационной иммунологии типирование, т. е. определение фенотипа HLA донора и реципиента, проводится чаще всего по антигенам локусов А, В, С, DR. На практике необходимо узнать, насколько донор отличается от реципиента по системе HLA. Селекция и предполагает подбор наиболее совместимых донора и реципиента.
Для оценки степени гистосовместимости был предложен индекс гистосовместимости. При одном идентичном у реципиента и донора антигене системы HLA индекс гистосовместимости составляет 25%, при двух 50%, при трех — 75%, при четырех — 100%. При этом оценивают степень гистосовместимости по антигенам так называемых классических локусов HLA. Некоторые антигены системы HLA подобны по строению (последовательность аминокислотных остатков имеет определенную степень гомологии). Наличие таких подобных антигенов у донора может повысить степень гистосовместимости.
Слайд 12У человека комплекс МНС иногда называют HLA [от англ. human leucocyte antigen,
У человека комплекс МНС иногда называют HLA [от англ. human leucocyte antigen,

Оба класса принимают участие в иммунном ответе. Так, в формировании клеточной формы иммунного ответа принимают участие антигены HLA I класса, в частности при образовании цитотоксических Т-лимфоцитов — Т-киллеров. Антигены локуса DR играют важную роль в процессах распознавания Т-хелперами/индукторами чужеродных антигенов. Кроме того, выделяют и III класс антигенов.
Одним из клинически значимых стимулов, не относящихся к системе
HLA. является семейство антигенов MICA (МНС class I related chain А), которые
экспрессируется на эпителиальных клетках в ответ на стресс. Специфические антитела в сыворотке пациентов, которым выполнили трансплантацию, распознают антиген MICA, а следовательно MICA может быть молекулой-мишенью в процессах отторжения. Эти антигены могут участвовать в отторжении аллотрансплантата. активируя антителозависимые и клеточные иммунные механизмы.
Слайд 17Собственно селекция преследует подбор такой пары донор — реципиент, в которой донор
Собственно селекция преследует подбор такой пары донор — реципиент, в которой донор

С целью выявления HLA-фенотипа проводится типирование лимфоцитов периферической крови донора и реципиента.
Для типирования лимфоцитов по антигенам I класса (HLA-A, В, С) используют лимфоцитотоксический тест в микромодификации Пауля Терасаки. Ингредиентами являются анти-HLA активные сыворотки, которые составляют типирующую панель, лимфоциты периферической крови субъекта, нормальная кроличья сыворотка (в качестве источника комплемента).
Для выявления антигенов класса II (HLA — DR, DP, DQ) используют пролонгированный лимфоцитотоксический тест с суспензией клеток, обогащенных В-лимфоцитами, на поверхности которых представлены эти антигены. Как известно, в периферической крови человека содержится всего 5—20% В-клеток, чего для выполнения теста недостаточно. Существует метод получения суспензии лимфоцитов, обогащенной В-клетками, который основан на свойстве В-лимфоцитов прикрепляться к волокнам синтетической ваты.
Слайд 18Предсуществующие антитела. Согласно общеизвестному правилу, пересадка аллогенного органа категорически запрещена при наличии
Предсуществующие антитела. Согласно общеизвестному правилу, пересадка аллогенного органа категорически запрещена при наличии

Предсуществующие антитела, специфические к лимфоцитам конкретного донора, выявляют в обычном лимфоцитотоксическом тесте (лимфоциты донора и сыворотка реципиента). Реакция в таком исполнении получила название перекрестной пробы, или cross-match (кросс матч). Предсуществующие антитела являются фактором риска сверх острого (и в какой-то мере, острого) отторжения трансплантата и учитываются как негативный прогностический показатель.
Активность предсуществующих антител в перекрестной пробе обозначается цитотоксическим индексом, %. Традиционно учитывается цитотоксический индекс > 5%, что означает 5 погибших лимфоцитов на 100 лимфоцитов в поле зрения.
Слайд 19Стандартный тест перекрестной совместимости по комплементзависимой цитототоксичности (cross-match)
Этот стандартный тест перекрестной совместимости
Стандартный тест перекрестной совместимости по комплементзависимой цитототоксичности (cross-match)
Этот стандартный тест перекрестной совместимости

Слайд 20Оценка перекрестной совместимости с помощью проточной цитометрии
Анализ перекрестной совместимости с помощью проточной
Оценка перекрестной совместимости с помощью проточной цитометрии
Анализ перекрестной совместимости с помощью проточной

Оценка перекрестной совместимости с помощью проточной цитометрии плохо стандартизирована между разными лабораториями, поэтому интерпретировать полученные данные надо с осторожностью.
Слайд 21Оценка перекрестной совместимости с помощью Luminex
На первом этапе суммарные лимфоциты донора выделяют
Оценка перекрестной совместимости с помощью Luminex
На первом этапе суммарные лимфоциты донора выделяют

Полученные клетки лизируют, и затем полученный лизат, содержащий донорские HLA-антигены, инкубируют с микросферами, предварительно конъюгированными с антителами к HLA класса I или II. При добавлении сыворотки реципиента, находящиеся в ней антитела связываются с соответствующими антигенами донора (которые в свою очередь находятся в комплексе с микросферами). Добавление флуоресцентно-меченного коньюгата к анти-IgG позволяет визуализировать результат.
Данный тест способен не только зафиксировать положительную реакцию перекрестной пробы «cross-match» по I или II классу, но и отслеживать титр накопления антидонорских антител в посттрансплантационном периоде, что важно для прогноза риска отторжения трансплантата.
Слайд 22Возможны (и нередко) случаи отторжения трансплантата при отрицательной кросс матч, и, наоборот,
Возможны (и нередко) случаи отторжения трансплантата при отрицательной кросс матч, и, наоборот,

Первое исключение можно объяснить следующим обстоятельством:
лимфоцитотоксический тест, с помощью которого производится перекрестная проба, недостаточно чувствительный и дает ложноотрицательные результаты;
сенсибилизация реципиента сопровождается синтезом не активирующих систему комплемента антител, и поэтому они не могут быть выявлены в комплемензависимой реакции (в лимфоцитотоксическом тесте), однако в организме реципиента способны оказать разрушительное действие на трансплантат;
сенсибилизация осуществляется с помощью иных антигенов (органных, а не HLA).
Слайд 23Положительные результаты пересадки аллогенного органа при положительной кросс матч, можно объяснить существованием
Положительные результаты пересадки аллогенного органа при положительной кросс матч, можно объяснить существованием

Антитела, направленные против молекул II класса главного комплекса гистосовместимости, не являются цитотоксическими. Их рассматривают как блокирующие антитела, которые экранируют (покрывают) DR-антигены на клетках трансплантата, предотвращая иммунологическое распознавание. Эти предсуществующие антитела определяются при температуре 8-10 °С в лимфоцитотоксическом тесте с В-лимфоцитами, на которых представлены молекулы II класса системы HLA и называются Холодовыми анти-В-антителами.
Таким образом, перекрестную пробу необходимо проводить параллельно со взвесями лимфоцитов, обогащенных Т- и В-клетками при разных температурах согласно двум видам предсуществующих антител: Холодовых и тепловых.
Слайд 24Для более тщательной селекции пары донор – реципиент необходимо выявить пресенсибилизацию реципиента
Для более тщательной селекции пары донор – реципиент необходимо выявить пресенсибилизацию реципиента

В рамках селекции пары донор – реципиент также исследуют исходный иммунный статус реципиента, который, как правило, влияет на течение посттрансплантационного периода. Для полной характеристики исходного иммунного статуса в обязательном порядке проводится иммунограмма. Из показателей системного иммунитета существенное значение имеет абсолютное количество Т-хелперов и Т-супрессоров/киллеров, а также их количественное соотношение – показатель ИРИ (иммуно-регуляторный индекс).
Слайд 25Итак, для селекции пары донор-реципиент необходимо определить:
Степень гистосовместимости, т.е. HLA-фенотип донора и
Итак, для селекции пары донор-реципиент необходимо определить:
Степень гистосовместимости, т.е. HLA-фенотип донора и

Разнотемпературные предсуществующие антитела у реципиента к антигенам системы HLA донора (анти-Т и анти-В антитела);
Антиэндотелиальные антитела у реципиента к антигенам донора;
Исходный иммунный статус реципиента.
Слайд 26Аллотрансплантат, наделенный чужеродными антигенными структурами, инициирует у реципиента иммунный ответ. В результате
Аллотрансплантат, наделенный чужеродными антигенными структурами, инициирует у реципиента иммунный ответ. В результате

Согласно клинической картине криза отторжения была предложена его классификация, которой соответствуют определенные иммунологические особенности.
Различают отторжение:
сверхострое, которое развивается немедленно после подключения трансплантата к кровотоку реципиента;
острое, развивающееся в течение первых трех недель после трансплантации;
хроническое, наблюдающееся через несколько месяцев либо лет.
Механизм сверхострого отторжения обусловлен пресенсибилизацией реципиента к антигенам системы HLA донора, т. е. связан с наличием у реципиента предсуществующих антител. Как уже отмечалось, материальным субстратом пресенсибилизации являются антигены системы HLA, которые индуцируют у реципиента гуморальный иммунный ответ еще до трансплантации вследствие гемотрансфузий, беременности либо лечения программным гемодиализом. Функция аллогенной почки (выделение мочи) при немедленном кризе отторжения прекращается в первые минуты или часы после пересадки. Доказательством того, что предсуществующие антитела являются причиной сверхострого криза отторжения, есть факт их исчезновения из периферического кровообращения реципиента сразу же после подключения трансплантата к кровотоку. Эти антитела фиксируются в пересаженной почке, о чем свидетельствуют результаты иммунофлюорес-ценции и электронной микроскопии.
Слайд 27Механизм острого отторжения. В патогенезе острого криза отторжения, возникающего вследствие недостаточной иммуносупрессивной
Механизм острого отторжения. В патогенезе острого криза отторжения, возникающего вследствие недостаточной иммуносупрессивной

Иммунологическое распознавание антигена системы HLA донора происходит двумя путями: прямым и непрямым.
Слайд 28Прямое распознавание основано на том, что антигены донора в виде пептидов представляются
Прямое распознавание основано на том, что антигены донора в виде пептидов представляются

Слайд 30Непрямое распознавание антигенов донора основано на общебиологическом принципе: процессинг донорских антигенов и
Непрямое распознавание антигенов донора основано на общебиологическом принципе: процессинг донорских антигенов и

Чрезвычайно важным является тот факт, что в зависимости от типа стимулированных Т-хелперов инициируется либо клеточный, либо гуморальный иммунный ответ. Как уже упоминалось, существует два типа хелперов, Первые (Т-хелперы 1-го типа) помогают предшественникам Т-лимфоцитов-киллеров дифференцироваться в сенсибилизированные Т-лимфоциты, а вторые (Т-хелперы 2-го типа) помогают В-клеткам дифференцироваться в плазмоциты. Данные морфологических исследований свидетельствуют, о том, что острый криз отторжения является результатом стимуляции, в основном, Т-хелперов 1-го типа, поскольку отторжение сопровождается клеточной иммунной реакцией.
Слайд 31Механизм хронического отторжения. Развитие хронического отторжения трансплантата возможно через несколько месяцев или
Механизм хронического отторжения. Развитие хронического отторжения трансплантата возможно через несколько месяцев или

Слайд 32Кроме трансплантационных антигенов главного комплекса гистосовместимости существуют также минорные антигены гистосовместимости. Они
Кроме трансплантационных антигенов главного комплекса гистосовместимости существуют также минорные антигены гистосовместимости. Они

При хорошей совместимости донора и реципиента отторжение может наступить из-за несовместимости по минорным антигенам, поскольку аллельные варианты белков являются источником эндогенных пептидов, которые могут презентироваться молекулами ГКГ I класса и распознаются СД8+ Т-лимфоцитами киллерами реципиента, приводя к реакции отторжения.
Слайд 33 Проведение иммуносупрессивной терапии является обязательной процедурой во всех случаях аллотрансплантации, как
Проведение иммуносупрессивной терапии является обязательной процедурой во всех случаях аллотрансплантации, как

В посттрансплантационный период иммуносупрессивную терапию проводят с первого дня пересадки органа. Терапия направлена на подавление развития иммунных реакций на пересаженный орган и предупреждение острого отторжения трансплантата.
Следует заметить, что большинство разработанных к настоящему времени методов иммуносупрессии имеют недостаток, связанный с неспецифичностью их действия. Применяемые средства оказывают иммуносупрессивное действие не только на аллотрансплантационные реакции, но и подавляют общую иммунореактивность организма, что способно приводить к развитию инфекционных осложнений.
Слайд 34В иммуносупрессивной терапии наиболее часто применяют следующие препараты и средства:
1. Азатиоприн
В иммуносупрессивной терапии наиболее часто применяют следующие препараты и средства:
1. Азатиоприн

2. Циклофосфамид (циклофосфан). Препарат подавляет иммуно-реактивность клеток путем алкилирования ДНК, в результате чего становится невозможным деспирализация и репликация ядерных нуклеопротеидов и деление клеток. Препарат особенно активен в отношении быстроделящихся клеток. Назначают в дозе 1-3 мг/кг массы тела в сутки.
3. Метотрексат. Действует как антогонист фолиевой кислоты, блокирует синтез пуринов. Обычно назначают в дозе 7,5-25 мг 1 раз в неделю в три приема.
4. Преднизолон. Часто препарат применяют в комбинации с азатиоприном. Препарат обладает выраженным иммуносупрессивным и противовоспалительным действием. Для профилактики кризов отторжения преднизолон назначают сразу после пересадки органа в дозе 3-4 мг/кг массы тела в день до стабилизации клинического статуса реципиента, затем переходят на поддерживающую дозу.
5. Циклоспорин А, FK506. Оба препарата блокируют активацию покоящихся Т-лимфоцитов, ингибируют транскрипцию генов, кодирующих молекулу ИЛ-2 и высокоаффинный рецептор ИЛ-2. Блокируют продукцию иммунокомпетентными клетками цитокинов. Средняя суточная доза циклоспорина А составляет 5 мг/кг массы тела, FK506 – 1-1,5 мг/кг массы тела. Циклоспорин А обладает нефротоксическим и гепатотоксическим действием.
Слайд 35 6. Рапамицин. Препарат подавляет реакции клеточного иммунитета, ингибирует активность клеток в
6. Рапамицин. Препарат подавляет реакции клеточного иммунитета, ингибирует активность клеток в

7. Антилимфоцитарная сыворотка (АЛС) или антилимфоцитарный глобулин (АЛГ), антитимоцитарная сыворотка.
Иммуносупрессивное действие сывороток проявляется в результате опсонизирующего и цитотоксического действия специфических антител на лимфоциты и Т-клетки. Применяют сыворотки для купирования кризов отторжения, как правило, в комплексе с азатиоприном, преднизолоном и другими препаратами. Возможны побочные действия препаратов: токсическое действие на тимус, аллергические реакции.
8. Моноклональные антитела против CD3 компонента ТКР Т-лимфоцитов (ОКТ-3) и рецептора ИЛ-2 (симулект). Оба препарата блокируют активацию Т-лимфоцитов. Первый препарат свое действие проявляет за счет блокирования рецептора, распознающего антиген, второй – за счет блокирования рецептора ИЛ-2 и подавления пролиферации Т-клеток и формирования зрелых Т-киллеров. В последние годы разработаны технологии получения химерных мышино-человеческих антител и человеческих моноклональных антител, которые, в силу своей высокой гомологии, не вызывают развития антииммунной реакции в организме реципиента.
Сейчас на стадии клинических испытаний находятся препараты, основой которых являются моноклональные антитела против ФНОα, ИНФγ, ИЛ-2, молекул адгезии и костимулирующих молекул.
Слайд 36Находясь в суспензии, под действием постоянного электрического поля клетки мигрируют к аноду.
Находясь в суспензии, под действием постоянного электрического поля клетки мигрируют к аноду.

Электрофорез клеток
 Алгоритм проведения интенсивной терапии и реанимации беременных и рожениц при анафилактическом шоке
Алгоритм проведения интенсивной терапии и реанимации беременных и рожениц при анафилактическом шоке Современные стандарты ведения пациентов с ОНМК
Современные стандарты ведения пациентов с ОНМК Экологическая иммунология
Экологическая иммунология Salt editable
Salt editable Оценка качества жизни пациентов с циррозом печени
Оценка качества жизни пациентов с циррозом печени Ожоги. Ожоги первой и второй степени
Ожоги. Ожоги первой и второй степени Реанимация и интенсивная терапия при ожогах
Реанимация и интенсивная терапия при ожогах Созылмалы миелоидтық лейкоз
Созылмалы миелоидтық лейкоз Сохраним стопы здоровыми (профилактика плоскостопия)
Сохраним стопы здоровыми (профилактика плоскостопия) ЭС 2ДЗУ
ЭС 2ДЗУ Осуществление зоогигиенических, профилактических и ветеринарно-санитарных u мероприятий
Осуществление зоогигиенических, профилактических и ветеринарно-санитарных u мероприятий Туляремия
Туляремия Грудной возраст
Грудной возраст Дәріс неврологияға кіріспе. Пән және клиникалық неврология тарихы. Неврологиядағы дәлелдену медицинасы
Дәріс неврологияға кіріспе. Пән және клиникалық неврология тарихы. Неврологиядағы дәлелдену медицинасы Инфекционная безопасность
Инфекционная безопасность Лістеріоз. Визначення хвороби
Лістеріоз. Визначення хвороби Пищевые отравления
Пищевые отравления Сбалансированное питание
Сбалансированное питание Пренатальная диагностика
Пренатальная диагностика Резонансно-волновая ДМВ терапия. Аппараты Акватон. Практика применения. ООО Телемак
Резонансно-волновая ДМВ терапия. Аппараты Акватон. Практика применения. ООО Телемак Комплексная оценка состояния здоровья и развития детей
Комплексная оценка состояния здоровья и развития детей Использование локального отрицательного давления в хирургии
Использование локального отрицательного давления в хирургии Пастереллез кроликов
Пастереллез кроликов Упаковка для стерилизации
Упаковка для стерилизации Атеросклероз. Классификация
Атеросклероз. Классификация Первая помощь при кровотечениях
Первая помощь при кровотечениях Группа риска. Роль санитарнопросветительной работы в снижении заболеваемости ИППП
Группа риска. Роль санитарнопросветительной работы в снижении заболеваемости ИППП Болезнь Фара
Болезнь Фара