Содержание
- 2. Определение ВОЗ: Health is a state of complete physical, mental and social well-being and not merely
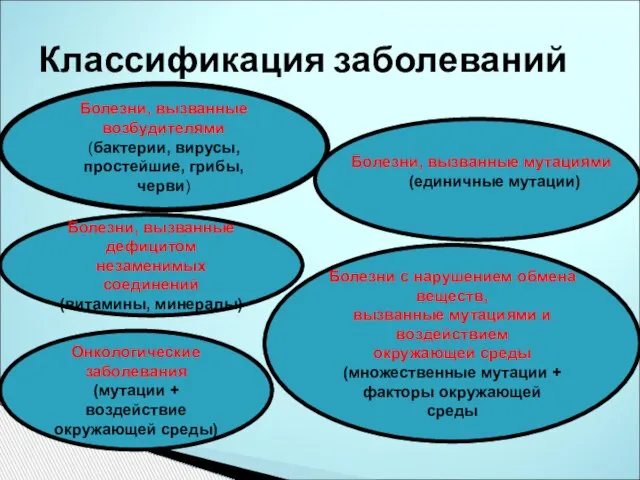
- 3. Классификация заболеваний Болезни, вызванные возбудителями (бактерии, вирусы, простейшие, грибы, черви) Болезни, вызванные мутациями (единичные мутации) Болезни,
- 4. Александр Флеминг Александр Флеминг ( Sir Alexander Fleming) –английский бактериолог, открывший лизоцим (антибактериальный фермент, вырабатываемый у
- 5. Нобелевская премия по физиологии и медицине 1945 года Работу Флеминга продолжили Говард Флори и Эрнст Борис
- 6. Один и тот же симптом (признак) может возникнуть при многих заболеваниях. Группу родственных симптомов, которые обычно
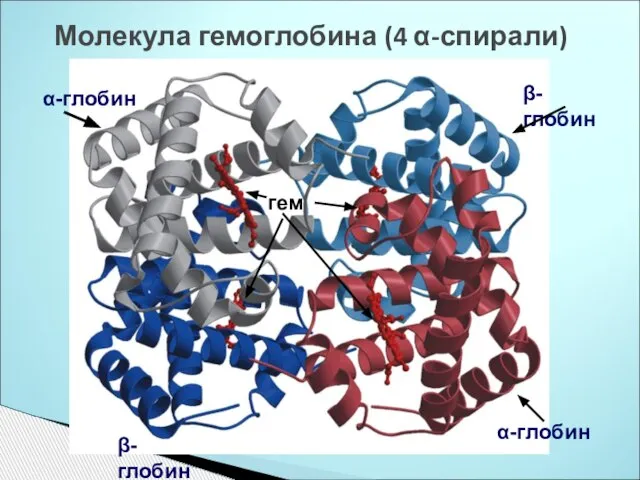
- 7. Молекула гемоглобина (4 α-спирали) α-глобин β-глобин гем α-глобин β-глобин
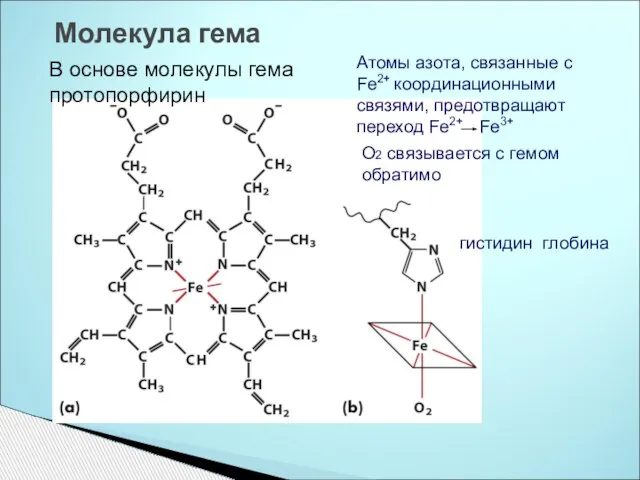
- 8. Молекула гема Атомы азота, связанные с Fe2+ координационными связями, предотвращают переход Fe2+ Fe3+ В основе молекулы
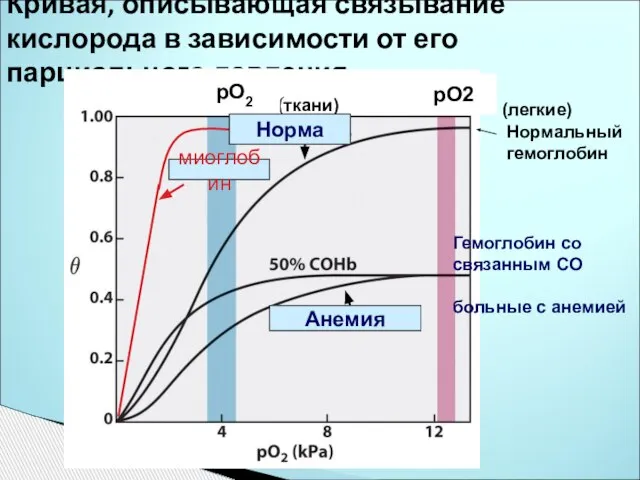
- 9. Кривая, описывающая связывание кислорода в зависимости от его парциального давления (ткани) (легкие) Нормальный гемоглобин Гемоглобин со
- 10. Структуры молекул трансферрина и ферритина Ионы железа вовлечены в различные метаболические процессы: связывание и перенос кислорода,
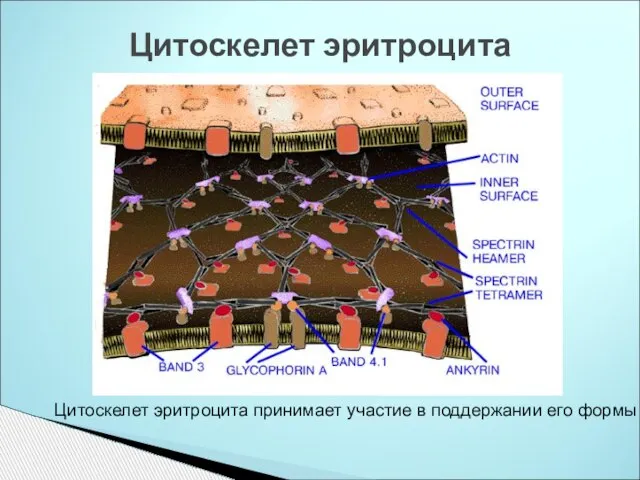
- 11. Цитоскелет эритроцита Цитоскелет эритроцита принимает участие в поддержании его формы
- 12. Для нормального функционирования эритроцита необходимо поддержание его нормальной формы, иначе эритроцит просто не пройдёт через просвет
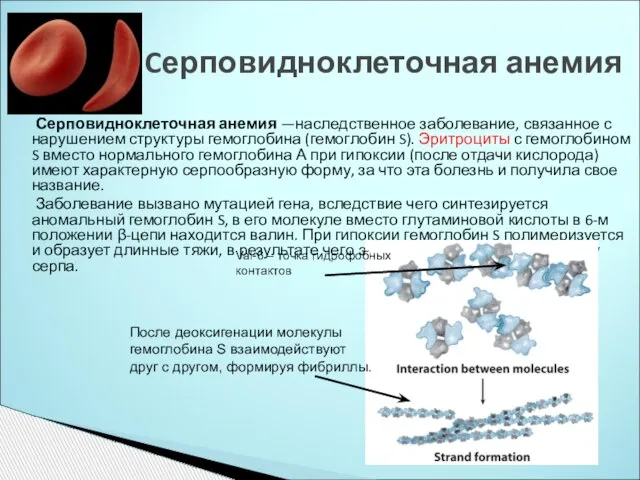
- 13. Серповидноклеточная анемия —наследственное заболевание, связанное с нарушением структуры гемоглобина (гемоглобин S). Эритроциты с гемоглобином S вместо
- 14. Серповидноклеточная анемия наследуется по аутосомно-рецессивному типу (с неполным доминированием). У носителей, гетерозиготных по гену серповидноклеточной анемии,
- 15. Для нормальной жизнедеятельности малярийный паразит из актиновых филаментов, протянутых под мембраной, конструирует транспортную систему, с помощью
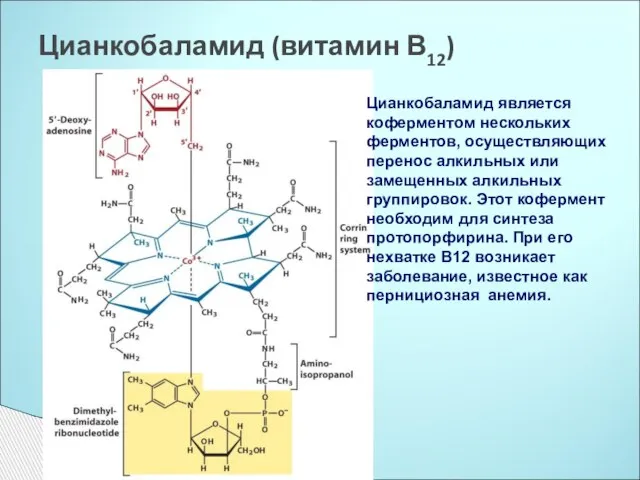
- 16. Цианкобаламид (витамин В12) Цианкобаламид является коферментом нескольких ферментов, осуществляющих перенос алкильных или замещенных алкильных группировок. Этот
- 17. Внутренний фактор Кастла — белок, секретируемый обкладочными клетками фундальных желёз слизистой оболочки желудка. Это гликопротеин, состоящий
- 18. Талассемия – (одна из форм гемоглобинопатий) - заболевание, наследуемое по рецессивному типу (дефектными должны быть два
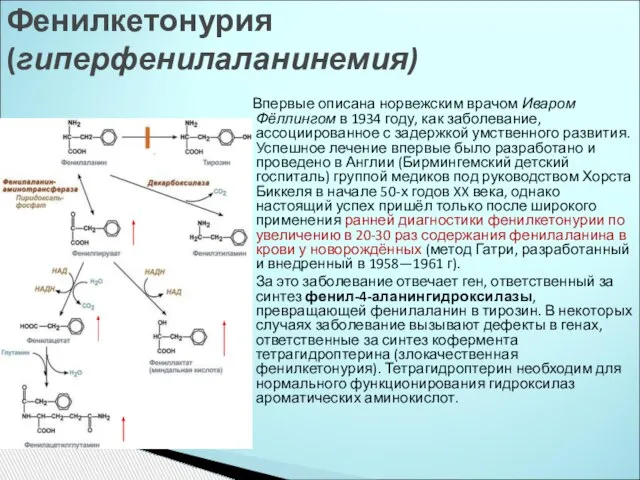
- 19. Ферментопатии – изменение структуры ферментов вследствие мутаций, что приводит к нарушению обмена веществ и патологиям. Фенилкетонурия
- 20. Впервые описана норвежским врачом Иваром Фёллингом в 1934 году, как заболевание, ассоциированное с задержкой умственного развития.
- 21. Гликогеновые болезни - группа наследственных заболеваний, в основе которых лежит снижение или полное отсутствие активности ферментов,
- 22. Классификация заболеваний относительна, она пересматривается каждые 10 лет, так как происходит улучшение понимания механизма развития заболевания.
- 23. Кислота – фактор агрессии для клеток эпителия, как желудка, так и пищевода Слабокислая среда (рН 3-4)
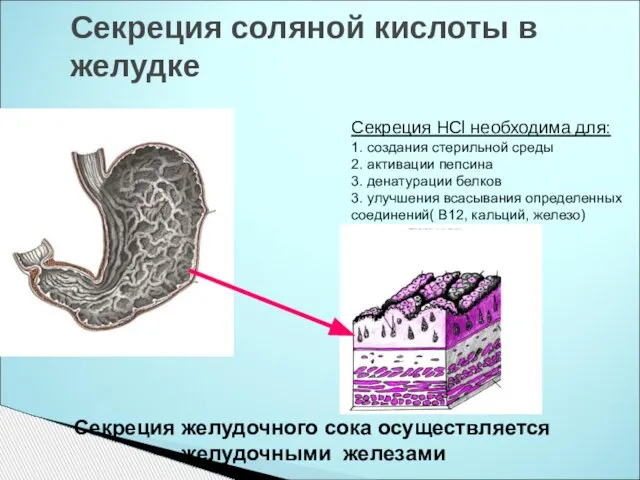
- 24. Секреция соляной кислоты в желудке Секреция желудочного сока осуществляется желудочными железами Секреция HCl необходима для: 1.
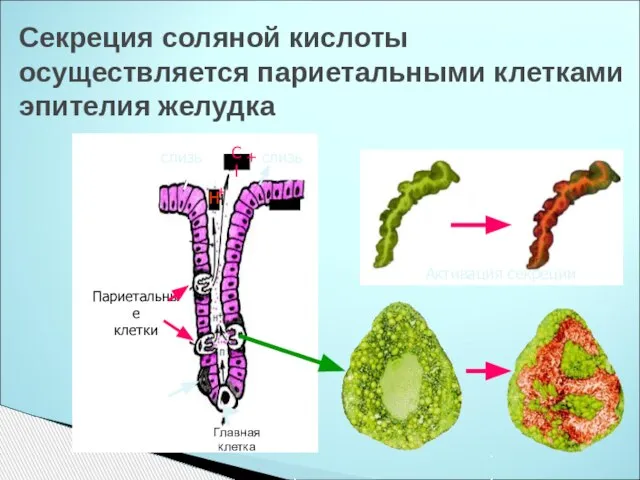
- 25. Секреция соляной кислоты осуществляется париетальными клетками эпителия желудка слизь слизь Париетальные клетки Cl + Н Н
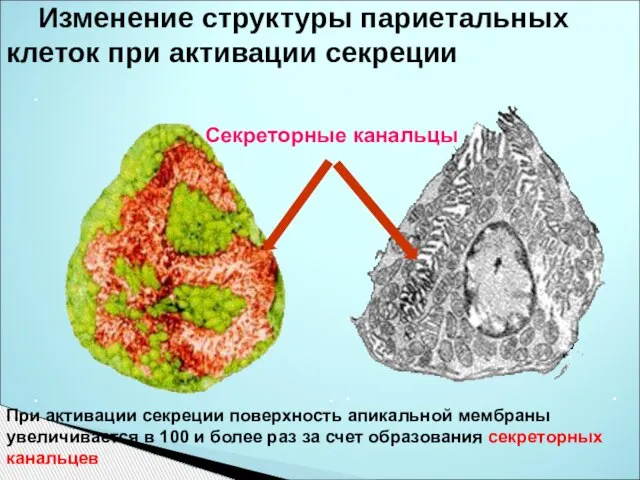
- 26. Изменение структуры париетальных клеток при активации секреции Секреторные канальцы При активации секреции поверхность апикальной мембраны увеличивается
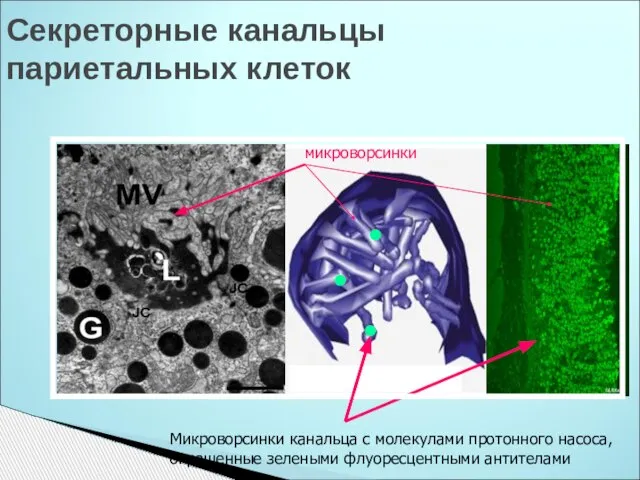
- 27. Секреторные канальцы париетальных клеток микроворсинки Микроворсинки канальца с молекулами протонного насоса, окрашенные зелеными флуоресцентными антителами
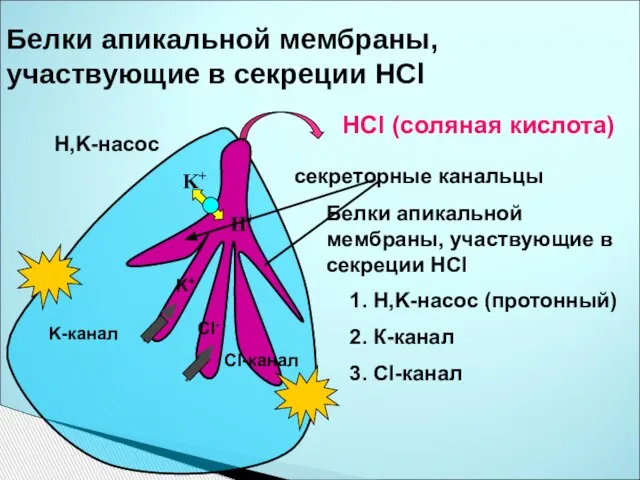
- 28. Белки апикальной мембраны, участвующие в секреции HCl секреторные канальцы HCl (соляная кислота) Белки апикальной мембраны, участвующие
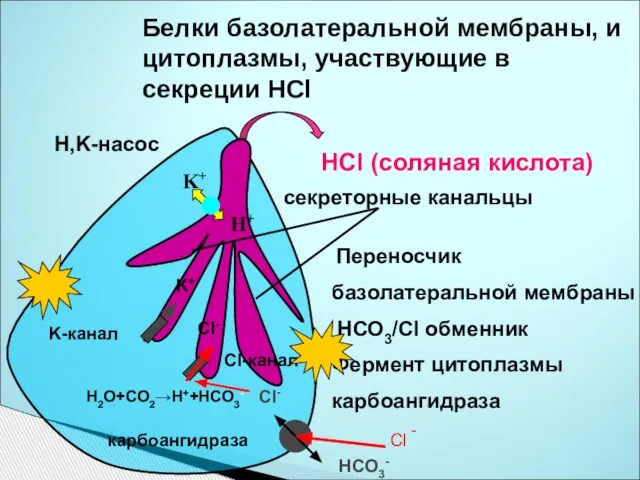
- 29. Белки базолатеральной мембраны, и цитоплазмы, участвующие в секреции HCl секреторные канальцы HCl (соляная кислота) H2O+CO2→H++HCO3- карбоангидраза
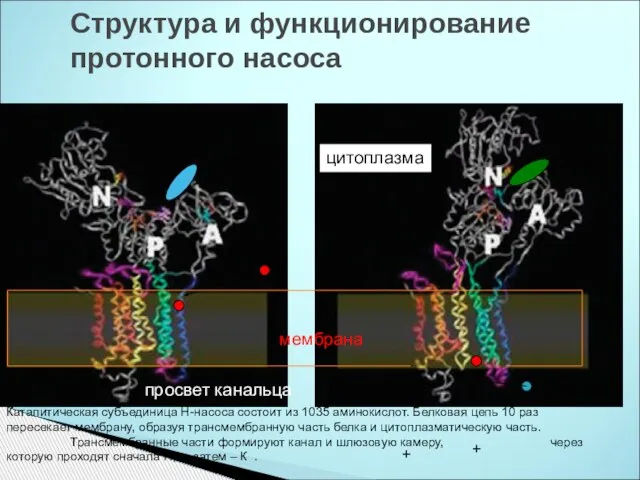
- 30. Структура и функционирование протонного насоса H К + цитоплазма мембрана АТФ АДФ просвет канальца Каталитическая субъединица
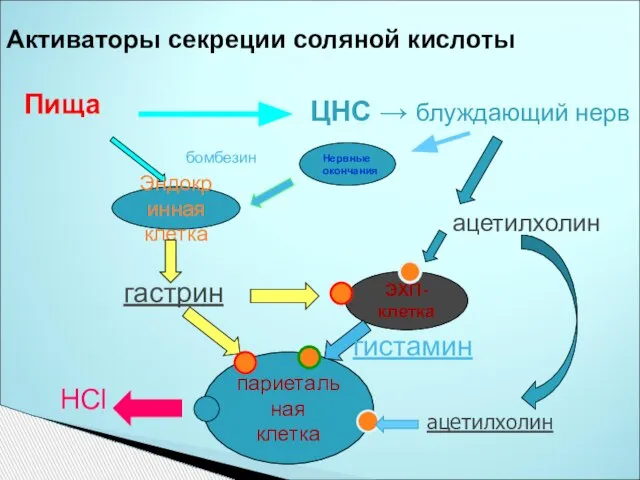
- 31. Активаторы секреции соляной кислоты Пища ЦНС → блуждающий нерв Эндокринная клетка гастрин ЭХП- клетка ацетилхолин париетальная
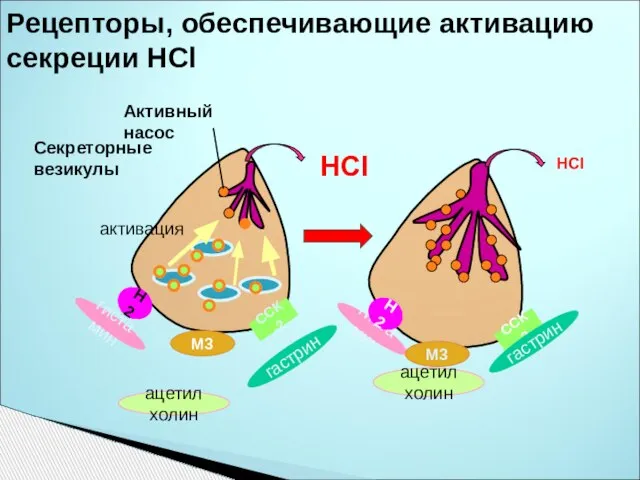
- 32. Рецепторы, обеспечивающие активацию секреции НСl М3 Н2 ССК-2 Активный насос гистамин ацетилхолин гастрин Секреторные везикулы Н2
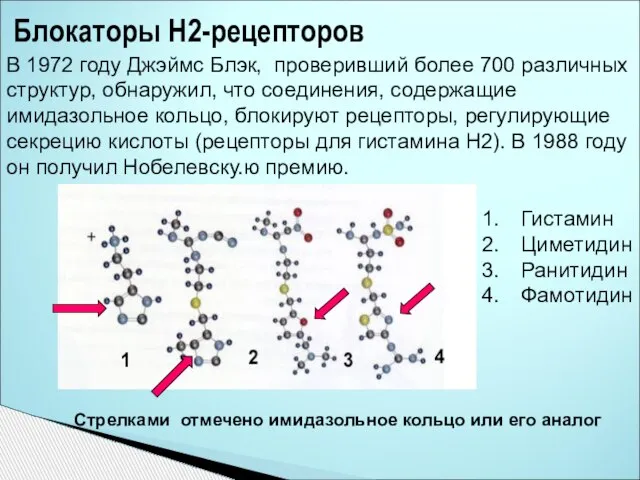
- 33. Блокаторы Н2-рецепторов Гистамин Циметидин Ранитидин Фамотидин Стрелками отмечено имидазольное кольцо или его аналог В 1972 году
- 34. Недостатки блокаторов Н2–рецепторов Блокада только одного пути стимуляции секреции Обратимость связывания: нестабильность эффекта Формирование толерантности* Синдром
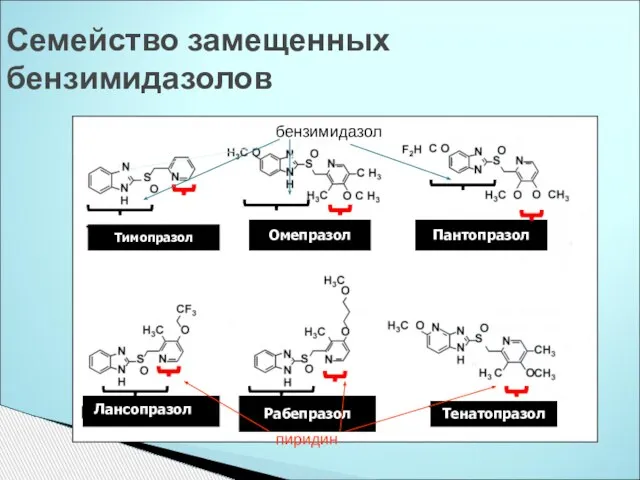
- 35. Семейство замещенных бензимидазолов Тимопразол Омепразол Пантопразол Лансопразол Рабепразол Лансопразол Тенатопразол бензимидазол пиридин
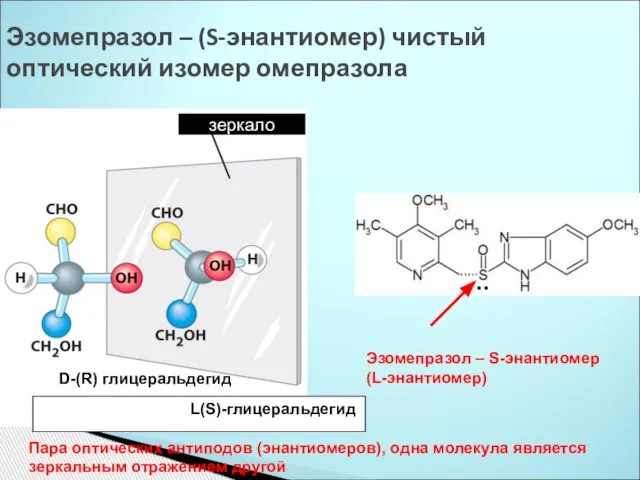
- 36. Эзомепразол – (S-энантиомер) чистый оптический изомер омепразола зеркало D-(R) глицеральдегид L(S)-глицеральдегид .. Эзомепразол – S-энантиомер (L-энантиомер)
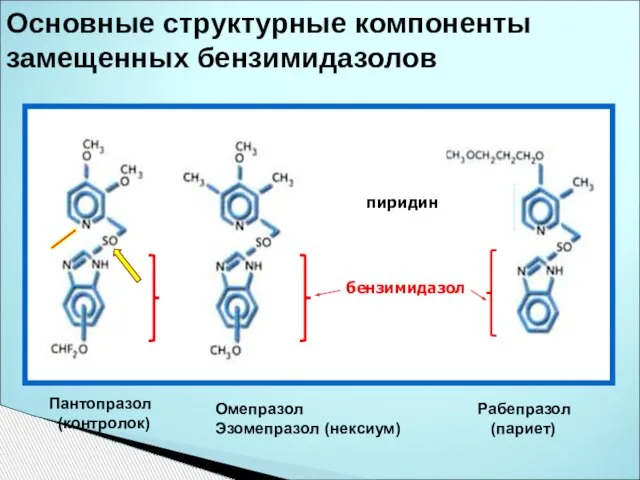
- 37. Основные структурные компоненты замещенных бензимидазолов Пантопразол (контролок) Омепразол Эзомепразол (нексиум) Рабепразол (париет) пиридин бензимидазол
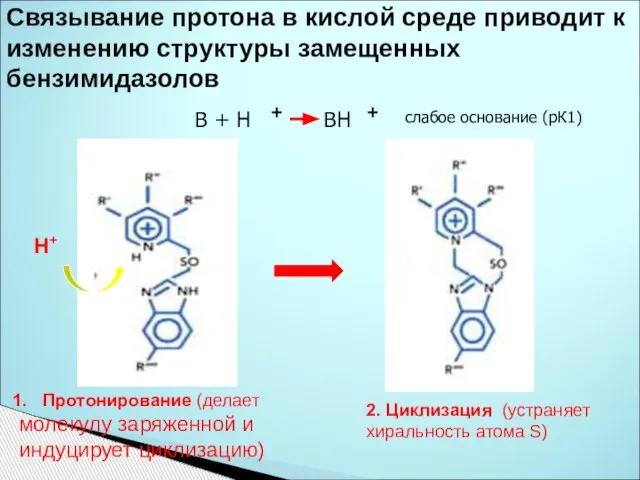
- 38. Связывание протона в кислой среде приводит к изменению структуры замещенных бензимидазолов Н+ Протонирование (делает молекулу заряженной
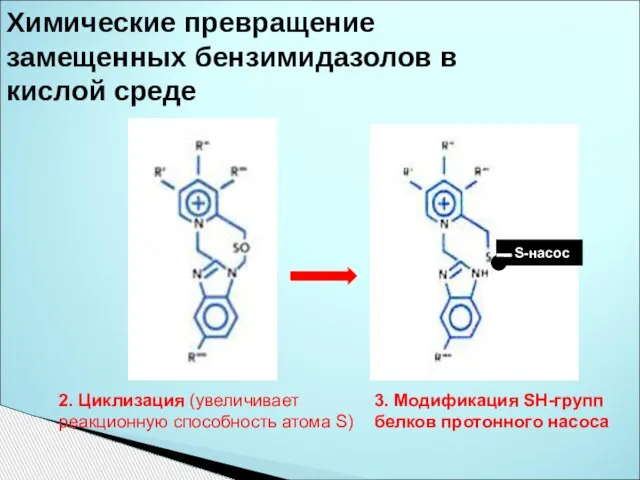
- 39. Химические превращение замещенных бензимидазолов в кислой среде 2. Циклизация (увеличивает реакционную способность атома S) 3. Модификация
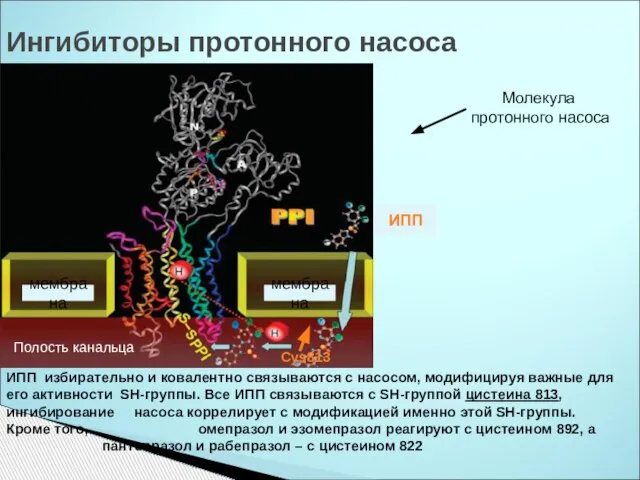
- 40. Ингибиторы протонного насоса ИПП избирательно и ковалентно связываются с насосом, модифицируя важные для его активности SН-группы.
- 41. Механизм действия ингибиторов протонного насоса 1. Всасывание в тонком кишечнике, попадание в кровь 2. Прохождение в
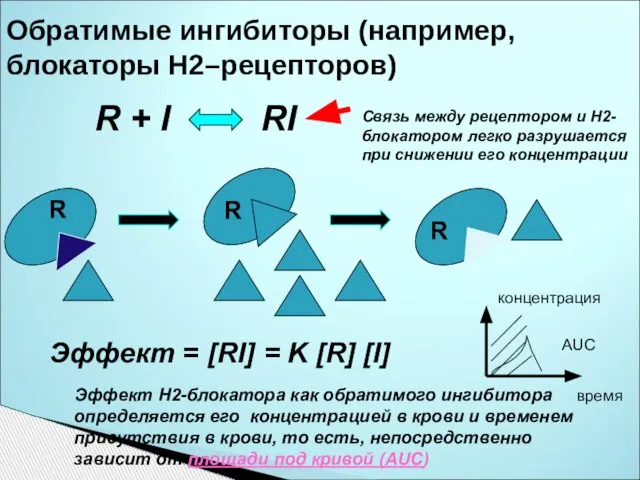
- 42. Обратимые ингибиторы (например, блокаторы Н2–рецепторов) R + I RI Эффект Н2-блокатора как обратимого ингибитора определяется его
- 43. Ингибиторы протонного насоса действуют необратимо P + I PI P-I Связь между ингибитором и насосом ковалентная
- 44. Helicobacter pylori (хеликобактер пилори) — спиралевидная грамотрицательная бактерия, которая инфицирует различные области желудка и двенадцатиперстной кишки.
- 45. Бактерия открыта в 1979 году австралийским патологом Робином Уорреном, который затем провёл дальнейшие исследования её вместе
- 46. Признание научным сообществом роли этого микроорганизма в развитии заболеваний желудка постепенно пришло лишь после проведения дополнительных
- 47. Почему же у многих инфицированных носителей Helicobacter pylori не обнаруживается никаких симптомов заболевания? Это стало понятно
- 48. Ульцерогенные штаммы H. pylori Ген cagA кодирует один из важнейших белков вирулентности H. pylori. Штаммы, имеющие
- 49. Антибиотики Ингибиторы протонного насоса ПОЧЕМУ нужно использовать сочетание двух лекарств? Антибиотики обычно действуют против делящихся бактерий,
- 50. Согласно данным ВОЗ каждый год от рака умирает около 8 миллионов человек, от заболеваний, вызванных бактериями
- 51. Вывод, который можно сделать: надо искать антибиотикам эффективную замену. Альтернативой могут стать бактериофаги — вирусы, поражающие
- 52. Микробиом – это совокупность микроорганизмов, находящихся в симбиозе с организмом хозяина (человека) В теле одного человека
- 53. Микробиом Цель проекта Микробиом человека - охарактеризовать все микробы, присутствующие в организме человека, для чего были
- 55. Скачать презентацию



























 Готовность организма к родам. Периоды родов. Прелименарный период. Родовые изгоняющие силы
Готовность организма к родам. Периоды родов. Прелименарный период. Родовые изгоняющие силы Көмей обыры
Көмей обыры Приготовление мазка буккального эпителия полости рта. Материалы и методы
Приготовление мазка буккального эпителия полости рта. Материалы и методы Контрольно-ревизионная работа по вопросам медицинского снабжения. (Тема 3.7)
Контрольно-ревизионная работа по вопросам медицинского снабжения. (Тема 3.7) Профилактика вирусно-бактериологической инфекции
Профилактика вирусно-бактериологической инфекции Офтальмогипертензия. Классификация, диагностика
Офтальмогипертензия. Классификация, диагностика Аномалии развития женских половых органов
Аномалии развития женских половых органов Дифференциальная диагностика ГЛПС и острого гломерулонефрита
Дифференциальная диагностика ГЛПС и острого гломерулонефрита Сексология. Нормальная сексология
Сексология. Нормальная сексология Перинатальная энцефалопатия
Перинатальная энцефалопатия Микрофото. Мочевыделительная система
Микрофото. Мочевыделительная система Влияние курения, употребления алкоголя и наркотиков родителями на эмбриональное развитие ребенка
Влияние курения, употребления алкоголя и наркотиков родителями на эмбриональное развитие ребенка Чума
Чума Воспаление сосудистой, нервной, гормональной систем
Воспаление сосудистой, нервной, гормональной систем Детское питание. Родительское собрание в школе
Детское питание. Родительское собрание в школе Перемещение больного
Перемещение больного Жатыр артериясының эмболизациясынан (ЖАЭ) кейінгі ауырсыну және қабыну реакциясына дексаметазонның әсерін анықтау
Жатыр артериясының эмболизациясынан (ЖАЭ) кейінгі ауырсыну және қабыну реакциясына дексаметазонның әсерін анықтау Сестринский процесс при заболеваниях печени и жёлчевыводящей системы
Сестринский процесс при заболеваниях печени и жёлчевыводящей системы Малоинвазивные операции. Особенности и преимущества применения их в практике гинеколога
Малоинвазивные операции. Особенности и преимущества применения их в практике гинеколога Эспаргам фатемех 388гр
Эспаргам фатемех 388гр Консервативное лечение при геморрое у беременных, геморрое в послеродовом периоде
Консервативное лечение при геморрое у беременных, геморрое в послеродовом периоде Медицинское обследование математического здоровья
Медицинское обследование математического здоровья Хронической лимфоцитарный лейкоз
Хронической лимфоцитарный лейкоз Кровь
Кровь Иммунопрофилактика. Сущность и цели
Иммунопрофилактика. Сущность и цели Минералды дистрофиялар
Минералды дистрофиялар Кодирование причин смерти и выбор первоначальной причины смерти в медицинских организациях Челябинской области
Кодирование причин смерти и выбор первоначальной причины смерти в медицинских организациях Челябинской области Кровь и кровообращение
Кровь и кровообращение