Содержание
- 2. ЭТАПЫ ГЕМАТОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ Взятие, доставка, прием и регистрация крови Приготовление аналитических проб из доставленных образцов Подготовка
- 3. ПОДГОТОВКА РАБОЧЕГО МЕСТА ДЛЯ ВЗЯТИЯ КРОВИ ИЗ ПАЛЬЦА СИЗ – шапочка, маска, перчатки, очки, фартук «Чистая
- 4. Подготовка пациента Кровь берут из вены, пальца, мочки уха, у новорожденных из пяточки Утром (7:00 –
- 5. Правила взятия крови из пальца Обработать кожу пальца 70% этиловым спиртом Сделать прокол боковой поверхности мякоти
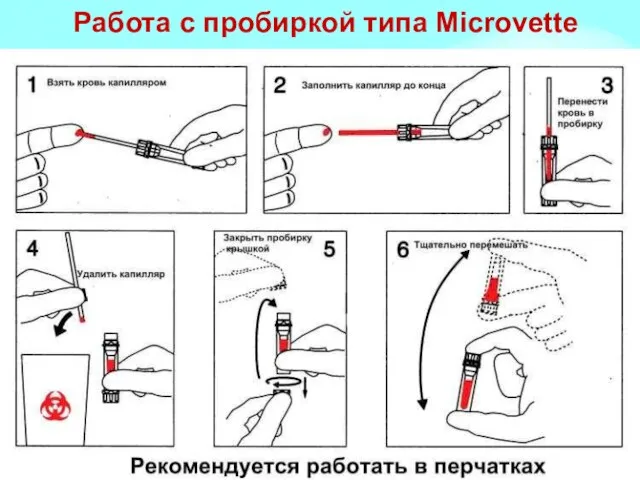
- 6. Работа с пробиркой типа Miсrovette
- 7. Место венепункции обработать 70% раствором этилового спирта Наложить жгут не более чем на 1 – 2
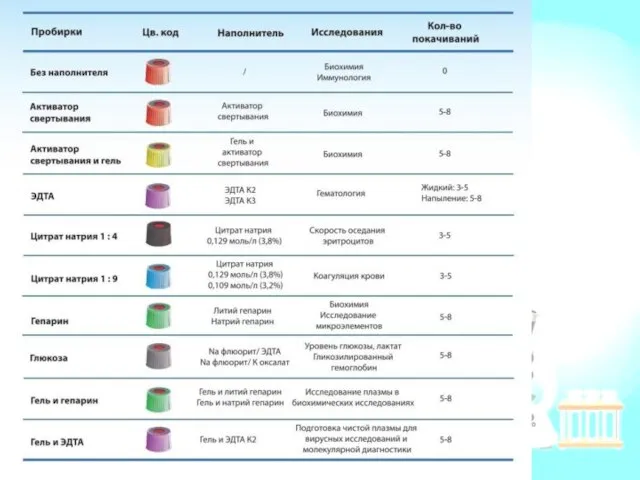
- 9. Подготовка цельной пробы крови к исследования Хранение: венозная кровь до 24 ч при +4 + 8°С
- 10. Подготовка предметных стекол для гематологических мазков Толщина стекла – 1 мм Стекла промыть щеткой в мыльно-содовом
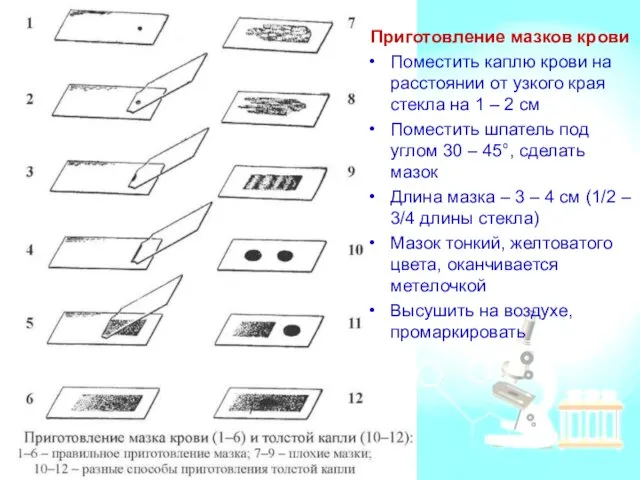
- 11. Приготовление мазков крови Поместить каплю крови на расстоянии от узкого края стекла на 1 – 2
- 12. Приготовление мазков крови с помощью полуавтоматического устройства для приготовления гематологических мазков Hemaprep Устройство позволяет готовить мазки
- 13. Фиксация и окраска мазков крови Смесь Никифорова – 30 мин 96% раствор этилена – 30 мин
- 14. Принцип окраски препаратов крови Тропизм составных частей клетки к анилиновым красителям Основные краски – метиленовый синий,
- 15. Окраска по Нохту Краситель: азур II-эозин – 1 мл 0,1 % азура II + 0,5 мл
- 16. Окраска по Романовскому-Гимза Рабочий краситель: 1 мл концентрата Романовского-Гимза + 1 мл дистиллированной воды На мазок
- 17. Окраска по Паппенгейму На мазок налить 3 – 4 капли фиксатора Май-Грюнвальда на 3 – 5
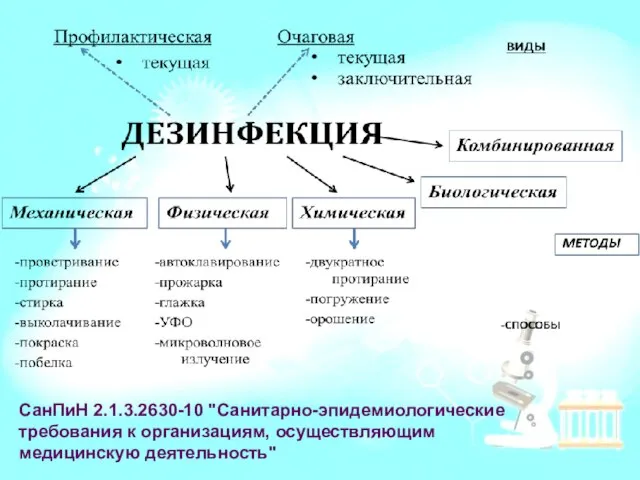
- 18. СанПиН 2.1.3.2630-10 "Санитарно-эпидемиологические требования к организациям, осуществляющим медицинскую деятельность"
- 19. Химическая дезинфекция Объекты – скарификаторы, ланцеты, наконечники к дозаторам, ватно-марлевые тампоны, контейнеры, пробирки и т.д. Основные
- 20. Дезинфекция и предстерилизация лабораторной посуды Пробирки, цилиндры, колбы, штативы, капилляры, груши и др. Объекты погрузить в
- 21. Утилизация Биологический материал и расходный материал, имеющий контакт с кровью – отходы класса Б Скарификаторы, наконечники
- 22. Алгоритм действий при аварийной ситуации - в случае порезов и уколов немедленно снять перчатки, вымыть руки
- 23. СОСТАВ АПТЕЧКИ АНТИ СПИД (ЭКСТРЕННОЙ ПРОФИЛАКТИКИ ПАРЕНТЕРАЛЬНЫХ ИНФЕКЦИЙ) Аптечка экстренной профилактики парентеральных инфекций – (Анти ВИЧ,
- 24. Найдите верные соответствия Стерильные скарификаторы Использованные наконечники Стерильные тампоны Использованные тампоны Емкости для дезинфекции Емкости для
- 26. Скачать презентацию



















 Период грудного возраста. АФО органов пищеварения. Грудное вскармливание
Период грудного возраста. АФО органов пищеварения. Грудное вскармливание Клинический протокол по нозологии Острый холецистит
Клинический протокол по нозологии Острый холецистит Тактическая помощь пострадавшим в бою для медицинского персонала август 2018
Тактическая помощь пострадавшим в бою для медицинского персонала август 2018 Материалы для служения в БУ. Анонимные Наркоманы
Материалы для служения в БУ. Анонимные Наркоманы Альвеоларлық өсіндінің семуі
Альвеоларлық өсіндінің семуі Вспомогательные гигиенические средства восстановления и повышения работоспособности
Вспомогательные гигиенические средства восстановления и повышения работоспособности Рак толстой кишки в Курской области. Перспективы уменьшения смертности
Рак толстой кишки в Курской области. Перспективы уменьшения смертности Үймереттердің ыстық сумен қамту жүйесі
Үймереттердің ыстық сумен қамту жүйесі Уход за кожей и естественными складками, умывание тяжелобольного пациента
Уход за кожей и естественными складками, умывание тяжелобольного пациента Биохимические показатели крови у спортсменов
Биохимические показатели крови у спортсменов Бронхоэктазии
Бронхоэктазии Изменение кариотипа
Изменение кариотипа Доказанная инволюция фиброза печени
Доказанная инволюция фиброза печени Защитно-приспособительные и компенсаторные реакции
Защитно-приспособительные и компенсаторные реакции Уничтожение микроорганизмов в окружающей среде
Уничтожение микроорганизмов в окружающей среде Отношение к жизни и смерти в пожилом возрасте
Отношение к жизни и смерти в пожилом возрасте Полип желудка
Полип желудка История развития учения о туберкулезе
История развития учения о туберкулезе Инфекционные заболевания
Инфекционные заболевания Слышу-говорю. Растормаживание речи неговорящего ребенка
Слышу-говорю. Растормаживание речи неговорящего ребенка Лекарственные растения презентация. Чабрец
Лекарственные растения презентация. Чабрец Сестринский процесс при ревматической лихорадке, пороках сердца. Тема 4.1
Сестринский процесс при ревматической лихорадке, пороках сердца. Тема 4.1 Рибозимы в регенеративной медицине
Рибозимы в регенеративной медицине Проблемы здоровья и долголетия. Маникюр
Проблемы здоровья и долголетия. Маникюр Улучшение сна
Улучшение сна 21 февраля - День фельдшера
21 февраля - День фельдшера Аскарида (Ascarіdae)
Аскарида (Ascarіdae) Иммунитет, виды и формы. Структура иммунной системы. Факторы неспецифической защиты. Лекция № 10
Иммунитет, виды и формы. Структура иммунной системы. Факторы неспецифической защиты. Лекция № 10