Содержание
- 2. План: Понятие об ОВР Степень окисления Окислители и восстановители. Классификация ОВР. Факторы, влияющие на протекание ОВР
- 3. Окислительно – восстановительные реакции –это такие химические реакции, в которых происходит передача ЭЛЕКТРОНОВ от одних частиц
- 4. Правила расчета степени окисления (СО): 1. Сумма СО всех атомов в молекуле равна нулю, в ионе
- 5. Степени окисления
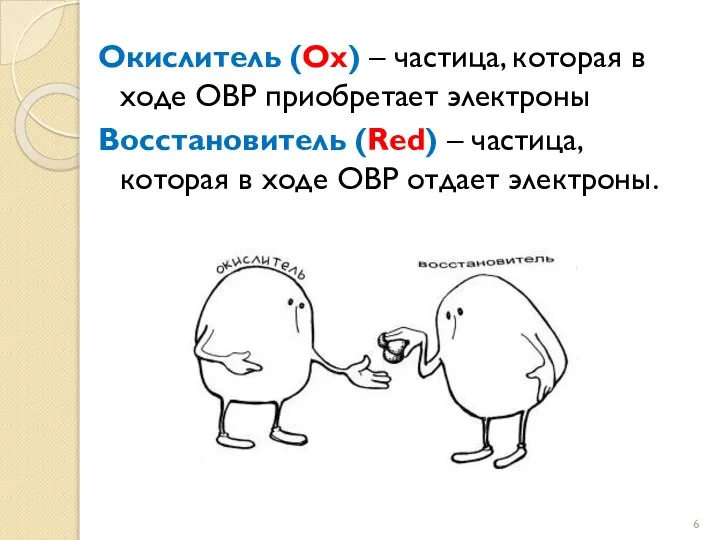
- 6. Окислитель (Ox) – частица, которая в ходе ОВР приобретает электроны Восстановитель (Red) – частица, которая в
- 7. Восстановление – процесс, в ходе которого окислитель приобретает электроны и переходит в сопряженную восстановленную форму. Окисление
- 9. Классификация ОВР Межмолекулярная ОВР — реакция, в которой разные атомы в различных веществах подвергаются окислению и
- 10. Факторы, влияющие на протекание ОВР: Природа вещества Среда Редокс-потенциал Партнер
- 11. рН среды или водородный показатель H2O = H+ + OH-
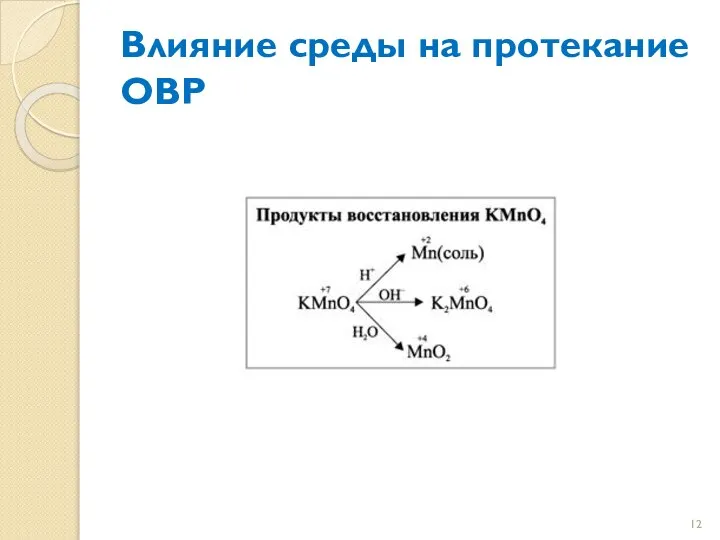
- 12. Влияние среды на протекание ОВР
- 13. Чем больше E0 , тем сильнее Ox как окислитель и слабее Red как восстановитель В любой
- 14. Стандартный окислительно-восстановительный потенциал (Е0) определяется как электродный потенциал относительно стандартного водородного потенциала По определению: E (H+
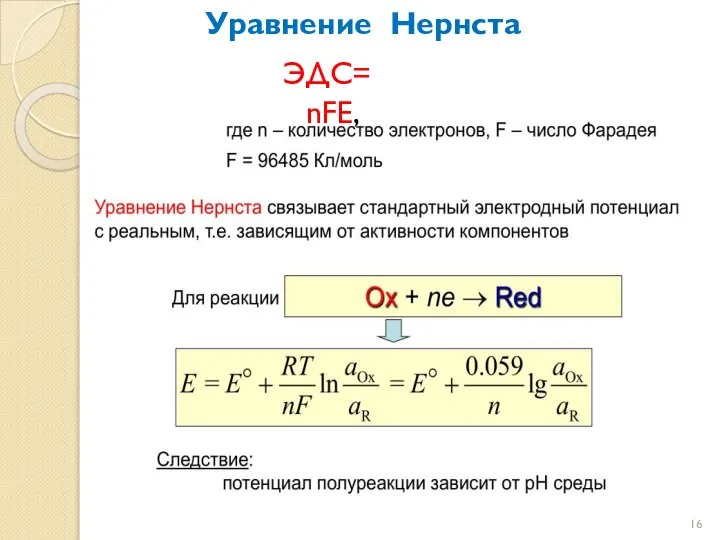
- 16. ЭДС= nFE, Уравнение Нернста
- 17. ОВР – уравнивание химических реакций или что – то еще? Способы уравнивания химических реакций: - алгебраический
- 18. Метод электронно – ионного баланса при составлении полуреакций используют ионы и (или) молекулы, присутствующие в растворе.
- 20. Значение ОВР для человека Химический источник тока ХИТ или гальванический элемент – система, в которой энергия
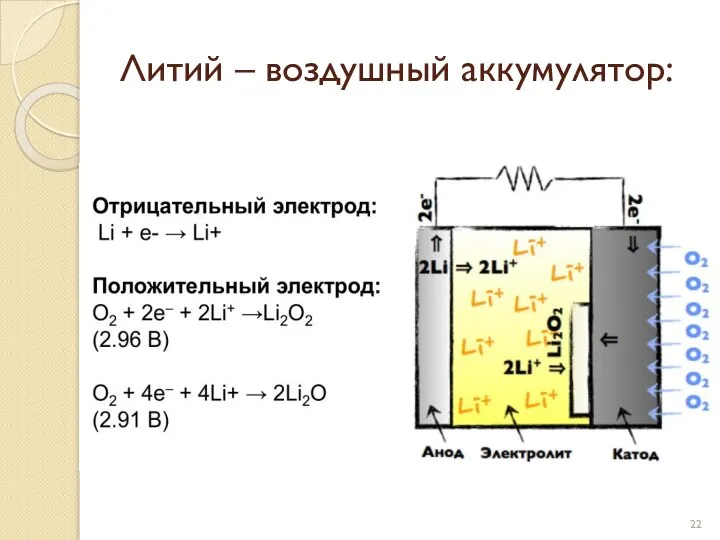
- 22. Литий – воздушный аккумулятор:
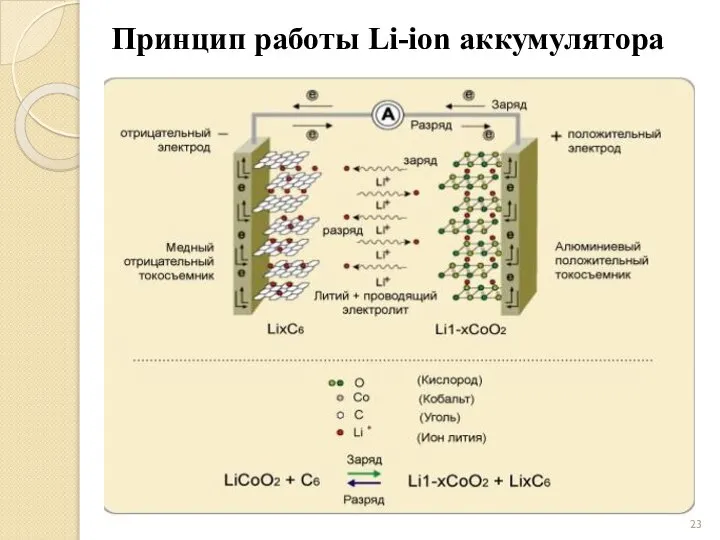
- 23. Принцип работы Li-ion аккумулятора
- 24. Химические процессы Li-ion аккумуляторов При заряде Li-ion аккумулятора происходят реакции: на положительных пластинах: LiCoO2 → Li1-xCoO2
- 26. Выводы: Окислительно-восстановительные равновесия характеризуются окислительно-восстановительными потенциалами ОВР имеют огромное значение в технологических процессах и жизни человека.
- 28. Скачать презентацию




















 Электролитическая диссоциация
Электролитическая диссоциация Строение , свойства и биологическая роль гликолипидов. Тема 14
Строение , свойства и биологическая роль гликолипидов. Тема 14 Презентация на тему Азотная кислота и ее свойства
Презентация на тему Азотная кислота и ее свойства  Железо и его соединения
Железо и его соединения Эфирные масла
Эфирные масла Электролиз воды
Электролиз воды Действие активированного угля
Действие активированного угля Кислоты. К уроку по химии для 8 класса
Кислоты. К уроку по химии для 8 класса Основы химической термодинамики
Основы химической термодинамики Виготовлення водних розчинів з заданою масовою часткою розчиненої речовини
Виготовлення водних розчинів з заданою масовою часткою розчиненої речовини Ресурс Лови оксиды для систематизации знаний, умений, навыков по теме Оксиды
Ресурс Лови оксиды для систематизации знаний, умений, навыков по теме Оксиды АКТИВІЗАЦІЯ ТВОРЧОЇ ДІЯЛЬНОСТІ УЧНІВ У ПРОЦЕСІ СТВОРЕННЯ І ВИКОРИСТАННЯ ПРОЕКТІВ У POWER POINT НА УРОКАХ ХІМІЇ
АКТИВІЗАЦІЯ ТВОРЧОЇ ДІЯЛЬНОСТІ УЧНІВ У ПРОЦЕСІ СТВОРЕННЯ І ВИКОРИСТАННЯ ПРОЕКТІВ У POWER POINT НА УРОКАХ ХІМІЇ Установочная лекция по специальной химии для студентов специальности Прикладная геология
Установочная лекция по специальной химии для студентов специальности Прикладная геология Алканы. Физические свойствава алканов
Алканы. Физические свойствава алканов 01_Khimicheskiy_sostav
01_Khimicheskiy_sostav Технологические процессы получения кислорода
Технологические процессы получения кислорода Кристаллическая структура вещества. Характеристика вещества по формуле
Кристаллическая структура вещества. Характеристика вещества по формуле Гипер-гипофосфатемия
Гипер-гипофосфатемия Презентация на тему Неорганические кислоты
Презентация на тему Неорганические кислоты  Золото. Золотые сплавы
Золото. Золотые сплавы Кафедра общей и биоорганической химии
Кафедра общей и биоорганической химии Получение этилового спирта из древесины
Получение этилового спирта из древесины Явления
Явления Определение времени прохождения диффузии
Определение времени прохождения диффузии Превращение веществ. История химии. Автор: Рассказова Н.Л., учитель химии и биологии МОУ «СОШ №8».
Превращение веществ. История химии. Автор: Рассказова Н.Л., учитель химии и биологии МОУ «СОШ №8». Метил-трет-бутиловый эфир
Метил-трет-бутиловый эфир Prezentatsia_Microsoft_PowerPoint
Prezentatsia_Microsoft_PowerPoint Алкины
Алкины