Содержание
- 2. История открытия С природными соединениями кремния человек знаком еще с древнейших времен. Ему были известны такие
- 3. Физические свойства В момент получения это прозрачное гелевидное вещество, практически нерастворимое в воде.
- 4. Химические свойства Кремниевая кислота - самая слабая из минеральных кислот, она почти не диссоциирует в растворах,
- 5. Способы получения и применения Так как диоксид кремния с водой не взаимодействует, то кремниевая кислота получается
- 7. Скачать презентацию
Слайд 2История открытия
С природными соединениями кремния человек знаком еще с древнейших времен. Ему
История открытия
С природными соединениями кремния человек знаком еще с древнейших времен. Ему

были известны такие минералы как кварц или горный хрусталь, а также халцедон, топаз, оникс. Основу всех этих минералов составляет оксид кремния, или кремнезём. Разложить кремнезём на кремний и кислород не представлялось возможным. Предпринимались попытки получить кремний взаимодействием с другими веществами. Например, Берцеллиус нагревал кремнезём вместе с порошком из железа и углеродом, но получался сплав ферросицилий.
И только в 1823 году был получен чистый кремний. Изучая соединения плавиковой кислоты, в том числе и тетрафторид кремния SiF4,Сент Клер-Девилль провел опыт с калием и получил аморфный кремний.
Слайд 3Физические свойства
В момент получения это прозрачное гелевидное вещество, практически нерастворимое в
Физические свойства
В момент получения это прозрачное гелевидное вещество, практически нерастворимое в

воде.
Слайд 4Химические свойства
Кремниевая кислота - самая слабая из минеральных кислот, она почти не
Химические свойства
Кремниевая кислота - самая слабая из минеральных кислот, она почти не

диссоциирует в растворах, не окрашивает индикаторов.
1. При нагревании она разлагается на диоксид и воду:
H2SiO3 => H2O + SiO2
2. Взаимодействует с растворами щелочей, образуя соли-силикаты:
H2SiO3 + 2NaOH => Na2SiO3 + 2H2O
Слайд 5Способы получения и применения
Так как диоксид кремния с водой не взаимодействует, то
Способы получения и применения
Так как диоксид кремния с водой не взаимодействует, то

кремниевая кислота получается косвенным путем - взаимодействием растворимых силикатов щелочных металлов с кислотами:
Na2SiO3 + 2 HCl => 2NaCl + H2SiO3
Гель кремниевой кислоты можно высушить, он при этом приобретает пористое строение с большой внутренней поверхностью, способной поглощать пары воды и многих органических веществ. Поэтому силикагель используется для осушения газов, разделения смесей. Он может быть и носителем мелко раздробленных катализаторов - это считается одним из важнейших его качеств. Кроме того, и сам силикагель может быть катализатором. Выпускаются и силикагели специального назначения: индикаторы влажности, гели для холодильников и др.
Гель кремниевой кислоты можно высушить, он при этом приобретает пористое строение с большой внутренней поверхностью, способной поглощать пары воды и многих органических веществ. Поэтому силикагель используется для осушения газов, разделения смесей. Он может быть и носителем мелко раздробленных катализаторов - это считается одним из важнейших его качеств. Кроме того, и сам силикагель может быть катализатором. Выпускаются и силикагели специального назначения: индикаторы влажности, гели для холодильников и др.
- Предыдущая
Дефис в наречиях Химическая связь
Химическая связь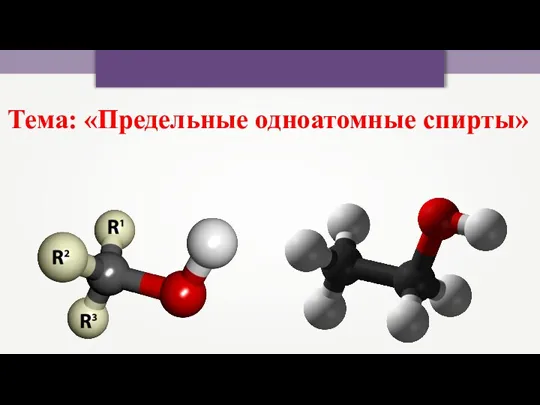 Предельные одноатомные спирты
Предельные одноатомные спирты Статистика в аналитической химии
Статистика в аналитической химии Разработка реактора для отопления домов путем извлечения водорода из воды
Разработка реактора для отопления домов путем извлечения водорода из воды 98675992
98675992 Презентация на тему Барометр анероид
Презентация на тему Барометр анероид  Свойства воды. СВФ
Свойства воды. СВФ Количество вещества
Количество вещества Роль катализа в жизнедеятельности организма. Ферментативный катализ. Классификация ферментов
Роль катализа в жизнедеятельности организма. Ферментативный катализ. Классификация ферментов Оксидтер мен негіздердің реакциялары
Оксидтер мен негіздердің реакциялары Исследования в химической лаборатории УГПИ
Исследования в химической лаборатории УГПИ Растворы вокруг нас
Растворы вокруг нас Алкены
Алкены Оценка качества пищевой соли, реализуемой в розничной торговле
Оценка качества пищевой соли, реализуемой в розничной торговле Флотационный способ обогащения
Флотационный способ обогащения Ионные уравнения
Ионные уравнения Неметаллы. 11 класс
Неметаллы. 11 класс Контрольная работа №1
Контрольная работа №1 Презентация Лекция 1. Химическая термодинамика
Презентация Лекция 1. Химическая термодинамика Обмен липидов
Обмен липидов Алгоритм названия органического соединения
Алгоритм названия органического соединения Исследование структуры продуктов аммонолиза мезопористых магниетермических порошков тантала
Исследование структуры продуктов аммонолиза мезопористых магниетермических порошков тантала Установочная лекция по специальной химии для студентов специальности Прикладная геология
Установочная лекция по специальной химии для студентов специальности Прикладная геология Алканы в торфянисто-подзолисто-глееватых почвах Габов Д.Н., Безносиков В.А., Кондратенок Б.М., Груздев И.В.
Алканы в торфянисто-подзолисто-глееватых почвах Габов Д.Н., Безносиков В.А., Кондратенок Б.М., Груздев И.В. Презентация на тему Типы химических реакций
Презентация на тему Типы химических реакций  Теория химического строения органических веществ А.М. Бутлерова
Теория химического строения органических веществ А.М. Бутлерова Классификация реакций в органической химии
Классификация реакций в органической химии Презентация на тему Коллоидная химия
Презентация на тему Коллоидная химия