Слайд 2Ко́мплексные соединения — частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к

данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами. Теория комплексных соединений (координационная теория) была предложена в 1893 г. А. Вернером.
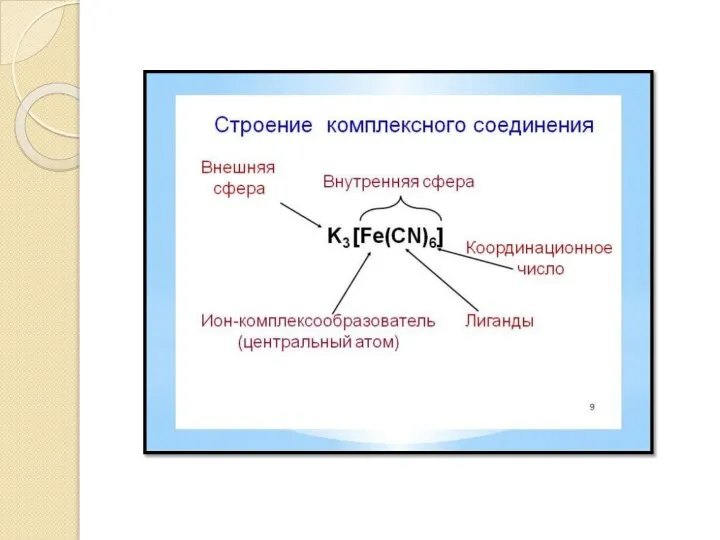
Слайд 3Основные термины
Комплексное соединение — химическое вещество, в состав которого входят комплексные частицы.
Комплексообразователь — центральный атом комплексной частицы.
Лиганды(Адденды) —

атомы или изолированные группы атомов, располагающиеся вокруг комплексообразователя.
Внутренняя сфера комплексного соединения — центральный атом со связанными с ним лигандами, то есть, собственно, комплексная частица.
Внешняя сфера комплексного соединения — остальные частицы, связанные с комплексной частицей ионной или межмолекулярными связями, включая водородные.
Дентатность лиганда определяется числом координационных мест, занимаемых лигандом в координационной сфере комплексообразователя
Координационный полиэдр — воображаемый молекулярный многогранник, в центре которого расположен атом-комплексообразователь, а в вершинах — частицы лигандов, непосредственно связанные с центральным атомом.
Координационное число (КЧ) — число связей, образуемых центральным атомом с лигандами. Для комплексных соединений с монодентантными лигандами КЧ равно числу лигандов, а в случае полидентантных лигандов — числу таких лигандов, умноженному на дентатность.
Слайд 5Типы комплексных соединений
По заряду комплекса
1. Катионные комплексы образованы в результате координации вокруг положительного иона нейтральных молекул

(H2O, NH3 и др.).
2. Анионные комплексы: в роли комплексообразователя выступает атом с положительной степенью окисления, а лигандами являются простые или сложные анионы.
3. Нейтральные комплексы образуются при координации молекул вокруг нейтрального атома, а также при одновременной координации вокруг положительного иона — комплексообразователя отрицательных ионов и молекул.
Слайд 6По числу мест, занимаемых лигандами в координационной сфере
1. Монодентатные лиганды. Такие лиганды бывают

нейтральными (молекулы Н2О, NH3, CO, NO и др.) и заряженными.
2. Бидентатные лиганды. Примерами служат лиганды: ион аминоуксусной кислоты H2N — CH2 — COO−, оксалатный ион −O — CO — CO — O−, карбонат-ион СО32−, сульфат-ион SO42−, тиосульфат-ион S2O32−.
3. Полидентатные лиганды. Например, комплексоны — органические лиганды, содержащие в своём составе несколько групп −С≡N или −COOH. Циклические комплексы, образуемые некоторыми полидентатными лигандами, относят к хелатным.
Слайд 7По природе лиганда
1. Аммиакаты — соединения, в которых лигандами служат молекулы аммиака, например: [Cu(NH3)4]SO4, [Co(NH3)6]Cl3,

[Pt(NH3)6]Cl4 и др.
2. Аквакомплексы — в которых лигандом выступает вода: [Co(H2O)6]Cl2, [Al(H2O)6]Cl3 и др.
3. Карбонилы — комплексные соединения, в которых лигандами являются молекулы оксида углерода(II): [Fe(CO)5], [Ni(CO)4].
4. Ацидокомплексы — комплексы, в которых лигандами являются кислотные остатки. К ним относятся комплексные соли: K2[PtCl4], комплексные кислоты: H2[CoCl4], H2[SiF6].
5. Гидроксокомплексы — комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы: Na2[Zn(OH)4], Na2[Sn(OH)6] и др.
Слайд 8Свойства
Окраска
Окраска комплексных соединений зависит от типа лигандов и комплексообразователя. Из-за расщепления энергии d-орбиталей появляется

возможность перехода электронов с подуровней dxy, dzy, dxz на вакантные подуровни с более высокой энергией dz2,dz2-y2 под действием поглощаемых квантов света. Эти явления можно наблюдать с помощью электронной спектроскопии. В зависимости от разности расщепленных уровней комплексы поглощают кванты света определённых диапазоновдлин волн, поэтому имеют соответствующую окраску.
Слайд 9Магнитные свойства
Среди химических соединений, в том числе комплексных, различают парамагнитные и диамагнитные,

по разному взаимодействующие с внешним магнитным полем. Парамагнитные комплексы обладают моментом µ и поэтому при взаимодействии с внешним магнитным полем втягиваются в него. Напротив, диамагнитные комплексы, не имея собственного магнитного момента, выталкиваются из внешнего магнитного поля.
Парамагнитные свойства веществ обусловлены наличием в их структуре неспаренных электронов и в случае комплексов объясняются специфическим заполнением электронами энергетических уровней.
Слайд 10Существуют два принципа, определяющих заполнение электронами d-орбиталей, расщепленных на dε и dγ

–подуровни:
1. Электроны заполняют орбитали так, чтобы число неспаренных электронов было максимальным (правило Хунда).
2. Сначала заполняются орбитали, имеющие меньшую энергию.








 Химические формулы. Относительная молекулярная масса. 8 класс
Химические формулы. Относительная молекулярная масса. 8 класс Химическая формула. Химия 8 класс
Химическая формула. Химия 8 класс Презентация на тему Палладий
Презентация на тему Палладий  Спирттің сақталуы туралы айтып беріңіз. Көмірқышқылының амидтік туындылары туралы айтып беріңіз
Спирттің сақталуы туралы айтып беріңіз. Көмірқышқылының амидтік туындылары туралы айтып беріңіз Конструкционные и специальные материалы холодильной техники
Конструкционные и специальные материалы холодильной техники Особенные свойства муравьиной кислоты
Особенные свойства муравьиной кислоты Химический диктант как метод формирующего оценивания
Химический диктант как метод формирующего оценивания Характеристика химического элемента по его положению в периодической системе элементов Д. И. Менделеева
Характеристика химического элемента по его положению в периодической системе элементов Д. И. Менделеева Ионные уравнения
Ионные уравнения Дисперсные системы. Лекция №7
Дисперсные системы. Лекция №7 Строение металлов и их сплавов
Строение металлов и их сплавов Алканы
Алканы Обобщение. Неметаллы
Обобщение. Неметаллы Вещество как система. Основы классификации и номенклатуры неорганических веществ
Вещество как система. Основы классификации и номенклатуры неорганических веществ Титан — металл фей
Титан — металл фей Презентация на тему Окислительно – восстановительные реакции
Презентация на тему Окислительно – восстановительные реакции  Обобщение по теме Теория химического строения органических веществ
Обобщение по теме Теория химического строения органических веществ Альдегиды и кетоны. (Лекция 6.2)
Альдегиды и кетоны. (Лекция 6.2) Алкадиены. Каучук. История открытия каучука
Алкадиены. Каучук. История открытия каучука Пищевые добавки
Пищевые добавки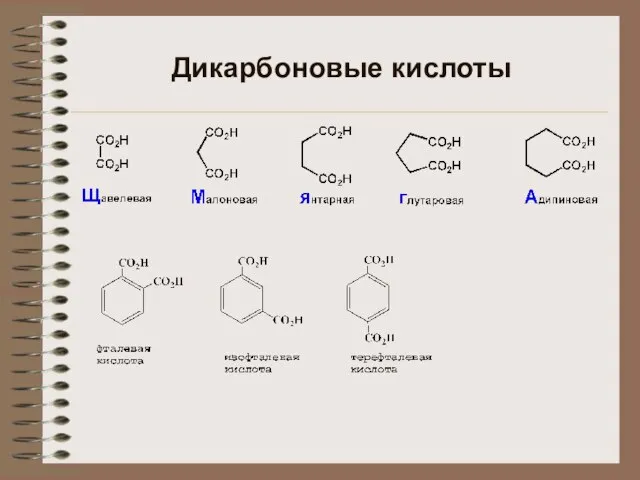 диовые кислоты
диовые кислоты Плазменное состояние вещества
Плазменное состояние вещества Катализ в нефтепереработке
Катализ в нефтепереработке Решение экспериментальных задач по теме Основные классы неорганических соединений. Практическая работа № 4
Решение экспериментальных задач по теме Основные классы неорганических соединений. Практическая работа № 4 Презентация на тему Химические свойства оксидов
Презентация на тему Химические свойства оксидов  Номенклатура алкенов. Теория
Номенклатура алкенов. Теория Вода как растворитель. Растворы. Растворимость. 8 класс
Вода как растворитель. Растворы. Растворимость. 8 класс Валентность. Составление формул по валентности
Валентность. Составление формул по валентности